钝叶瓦松带芽叶片的组织培养和快速繁殖
2012-03-13张彦妮韩荣娜
张彦妮,韩荣娜
(东北林业大学园林学院,黑龙江 哈尔滨 150040)
钝叶瓦松(Orostachysmalacophyllus)[1]为景天科瓦松属的二年生肉质草本植物。在我国东北、华北、内蒙古等地区均有分布,朝鲜、日本也有分布[2]。钝叶瓦松系旱生植物,在内蒙古典型草原和草甸草原地区,为常见的伴生种,生于砾石性山坡或沙砾质土壤。全草皆可入药,有止血通经之功效[3]。钝叶瓦松第1年仅有莲座叶,第2年抽茎[4]。叶片呈莲座状密集排列,总状花序,花期在夏秋季节,开白色或者白绿色小花[5]。可作为花坛花卉植于山坡、岩石园或屋顶,是一种颇具开发价值的野生花卉。迄今为止,对景天科瓦松属植物的组织培养研究较少,曲伟红和赵建国[6]对瓦松愈伤组织的诱导进行了研究,而对于钝叶瓦松组织培养方面尚未见报道。由于野生资源有限,为了快速繁殖出大量的钝叶瓦松植株,本试验以带芽叶片为材料,进行组织培养研究,以期为钝叶瓦松大量繁殖提供新的有效途径,为优良种质资源保存、野生资源的保护以及钝叶瓦松可持续开发利用的实现提供理论依据。
1 材料与方法
1.1试验材料 钝叶瓦松的植株由东北林业大学园林学院花圃提供。选取健康的钝叶瓦松带芽叶片为外植体。
1.2试验方法
1.2.1带芽叶片消毒时间的筛选 参照程林梅等[7]方法,将采集的钝叶瓦松带芽叶片用洗衣粉水浸泡10 min,在流水下冲洗1~2 h后,放入超净工作台,用75%的乙醇溶液消毒15~30 s,再用无菌水冲洗2次,再用0.1%的升汞(HgCl2)溶液分别消毒3、5、7、9、11 min,中间不断晃动,然后用无菌水冲洗5~6次,无菌滤纸吸干外植体表面的水分,用消毒过的小刀将带有腋芽的叶片切成大小约为0.5~1.0 cm的小块,接种到MS培养基上。每个处理30个外植体,重复3次。2周后分别统计不同消毒时间的污染率、启动率和死亡率。筛选出外植体最佳的消毒时间。本试验培养基pH值均调至5.8~6.0,高压灭菌(1.1 MPa,121 ℃)15 min。培养室培养温度为(25±2)℃,光照强度为1 500~2 000 lx,光照时间为16 h·d-1。
1.2.2钝叶瓦松带芽叶片的启动培养 将消毒后的带芽叶片接种到添加不同质量浓度6-BA(1.0、2.0和3.0 mg·L-1)、NAA(0.1、0.3和0.5 mg·L-1)的MS培养基上,试验采取二因素三水平的正交试验设计,每处理接种30个外植体,30 d后统计钝叶瓦松带芽叶片的启动率、出芽指数和出愈率。出芽指数等于发生芽的外植体上出芽数的平均数。
1.2.3腋芽的增殖培养 初代培养得到的腋芽,剪下后接种增殖培养基上进行丛芽的诱导,试验采用三因素三水平的正交试验设计,每处理接种30个外植体,30 d后统计腋芽的增殖倍数。
1.2.4组培苗的生根诱导 将高3 cm左右、未生根的组培苗转至1/2MS +NAA(0.1、0.3 mg·L-1)培养基上进行生根诱导。20 d后分别统计生根率、根长及生根情况。
1.2.5无菌苗的移栽 选取高3 cm左右、根系健壮的钝叶瓦松无菌生根苗进行移栽。用镊子小心的取出生根苗,自来水冲洗掉根上附着的培养基,移栽到事先准备好的基质中,浇适量水,放置在通风良好、湿度较大、光照充足的环境下进行培养,观察幼苗生长情况,30 d后统计移栽成活率,筛选出适宜的移栽基质。
1.3数据分析 数据采用EXCLE、SPSS 17.0软件进行方差分析及多重比较分析(Duncan’s法)。
2 结果
2.1钝叶瓦松带芽叶片消毒时间的筛选 随着0.1% HgCl2处理时间的延长,钝叶瓦松叶片的污染率逐渐递减,启动率呈先升后降的趋势(表1),而死亡率却逐渐增加,可见,HgCl2消毒效果虽然较好,但对外植体的活化等方面影响很大,如果消毒时间过长,就会在杀死外植体表面微生物的同时对植物细胞也造成损伤,导致外植体死亡率的增加,从而影响到外植体愈伤组织的诱导。0.1%HgCl2处理5 min污染率和死亡率均较低,方差分析结果显示,0.1%HgCl2处理5 min污染率与其他灭菌时间相比差异显著,且启动率最高,为56.67%,有利于带芽叶片的启动培养。说明0.1%HgCl2处理5 min最适合钝叶瓦松带芽叶片的消毒。

表1 不同灭菌时间对外植体消毒效果的影响及方差分析结果
2.2钝叶瓦松带芽叶片的启动培养 将带芽钝叶瓦松叶片接种到不同激素组合的培养基上4 d左右,腋芽开始萌动,10 d左右差异并不显著,有些腋芽基部开始产生愈伤组织经继代后会分化出根和不定芽(图1)。其中在A1、A3、A6和A9培养基上腋芽的萌发率均较高,但A1和A9腋芽长势一般,A3、A6出芽指数相对较高且腋芽长势较好(表2),可见高质量浓度的6-BA有利于钝叶瓦松腋芽的萌发与生长,而高质量浓度的NAA(超过0.1 mg·L-1)对于钝叶瓦松腋芽生长有抑制作用。因此高质量浓度的6-BA(3.0 mg·L-1)和低质量浓度的NAA(0.1 mg·L-1)组合是钝叶瓦松带芽叶片启动的最佳培养基。
2.3腋芽的增殖培养 不同质量浓度6-BA、NAA和 2,4-D的组合对于腋芽的增殖及苗的长势影响相差很大。高质量浓度的6-BA(1.5 mg·L-1)和NAA(0.1~0.2 mg·L-1)组合使用有利于带芽叶片腋芽的增殖,随着6-BA质量浓度的升高,腋芽增殖倍数呈增加的趋势,最高达5.35。方差分析表明,此组合与其他组合之间存在显著差异,且苗长势很好(图2A)。但是当低质量浓度的6-BA(0.5 mg·L-1)或6-BA与2,4-D组合使用时,腋芽增殖倍数较小,芽苗长势也较弱,可见在腋芽增殖时低质量浓度的6-BA 或6-BA+2,4-D对于钝叶瓦松叶片腋芽的增殖有抑制作用(表3)。因此最适宜带芽叶片腋芽增殖的培养基为MS+6-BA 1.5 mg·L-1+NAA 0.2 mg·L-1。
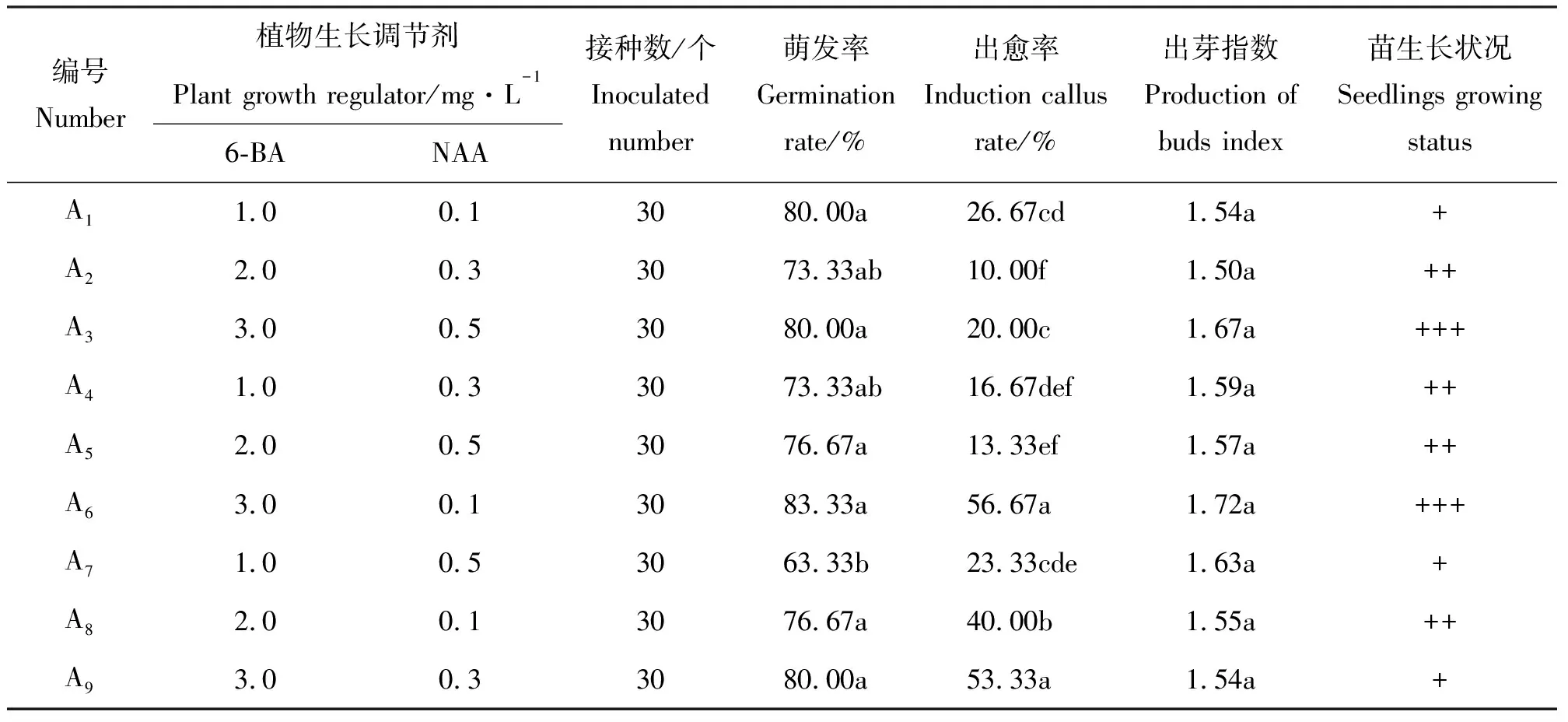
表2 带芽叶片的启动培养结果
2.4组培苗的生根诱导 丛生芽中未生根的苗高3 cm左右时,继代到附加不同质量浓度NAA(0.1~0.3 mg·L-1)的1/2MS培养基中进行生根诱导。试验中发现钝叶瓦松无菌苗较易生根,在接种后4 d左右开始生根,20 d后统计结果,大部分苗已经生根,且生根率均在75%以上,其中,C3培养基的生根率最高,达96.67%,且平均诱导出14条根(表4),从方差分析可以看出,C3培养基的生根率与C1、C2培养基之间存在显著差异,且诱导出的根较粗状数量较多(图2B)。因此钝叶瓦松最适生根培养基为:1/2MS+NAA 0.3 mg·L-1。
2.5组培苗的移栽 选择生根良好的钝叶瓦松生根苗移栽到不同的基质中,30 d后统计不同移栽基质的移栽成活率。基质珍珠岩∶蛭石∶田间土(1∶1∶1)的移栽成活率最高,达76.67%(表5),与另外3种基质的成活率之间存在显著差异,且苗的长势较好(图2C)。

图1 愈伤组织增殖(A)和分化(B)

表3 带芽叶片不定芽的增殖培养

图2 钝叶瓦松带芽叶片腋芽的增殖(A)、生根诱导(B)及移栽(C)

表4 生根试验结果

表5 不同栽培基质对组培苗移栽成活率的影响
3 讨论与结论
关于景天科植物组织培养方面的试验研究已有很多的报道[8-10],国内外有关瓦松属植物的研究报道更多是围绕药理及分子方面[11-12],关于组培方面的报道却很少。本试验以钝叶瓦松带芽叶片为外植体,经过多次试验研究,初步建立了组织培养再生体系,短期内获得了大量的钝叶瓦松的完整植株。
在钝叶瓦松带芽叶片的培养中,用0.1%升汞对外植体消毒5 min污染率较低且启动率较高,灭菌效果最好。在带芽叶片的启动试验中发现:带芽叶片接种4 d左右,腋芽开始萌动,10 d左右叶片展开;另外试验中发现激素种类和浓度对于叶片腋芽启动培养有一定的影响,结果表明,高质量浓度的6-BA(3.0 mg·L-1)和低质量浓度的NAA(0.1 mg·L-1)组合使用腋芽萌发率最高,最适宜钝叶瓦松带芽叶片的启动培养。有些腋芽在培养10 d左右,基部会产生黄绿色或绿色颗粒状的愈伤组织,结构致密但易碎,经过继代后会分化出根和不定芽,初步认定为胚性愈伤组织[13-15]。因此,有关叶片腋芽基部产生的是否为胚性愈伤组织以及进一步提高胚性愈伤组织的诱导率尚待进一步深入研究。
植物生长调节剂在组织培养的过程中有着重要的作用[16]。不同的激素组合对于腋芽增殖的效果各不相同[17]。对钝叶瓦松来说,在培养基MS+6-BA 1.50 mg·L-1+NAA 0.2 mg·L-1上,腋芽增殖效果最好,增殖倍数为5.35,显著高于其他组合的增殖倍数,苗的长势也较好,因此是钝叶瓦松带芽叶片腋芽增殖的最佳培养基。在钝叶瓦松组培苗的生根试验中发现,NAA有利于促进钝叶瓦松植株的生根,其生根的最适培养基为1/2MS+ NAA 0.3 mg·L-1,20 d后生根率高达96.67%,且根系粗壮、苗长势较好。试验苗移栽在基质珍珠岩∶蛭石∶田间土(1∶1∶1)中效果最好,成活率达到76.67%。
本试验以钝叶瓦松的带芽叶片为外植体,首次成功的建立了组织培养再生体系,为组培苗的移栽、大面积的人工栽培及其工厂化生产提供了一定的理论基础与科学依据,为钝叶瓦松的可持续开发利用奠定了基础。
[1]郑万金,张萍,仲英.瓦松属植物的研究进展[J].齐鲁药事,2008,27(3):161-163.
[2]郑艳,徐珞珊.中国瓦松属(Orostachys)的药用资源[J].中国中医药信息杂志,2003,10(11):41.
[3]国家药典委员会.中国药典,Ⅰ部[S].北京:化学工业出版社,2005:47.
[4]陈金法.瓦松的综合利用[J].中国林副特产,2009,6:99-100.
[5]黄献胜.奇趣的多肉花卉世界景天科瓦松属[J].花木盆景,2002,10:63.
[6]曲伟红,赵建国.瓦松愈伤组织诱导研究[J].时珍国医国药,2010,21(11):2832-2833.
[7]程林梅,高洪文,赵茂林.菊苣组织培养与植株再生的研究[J].草业学报,2002,11(4):105-107.
[8]刘海军,郭斌,晏琼,等.4种红景天植物的组织培养研究[J].西北植物学报,2006,26(10):2023.
[9]胡挺松,马兰青,郭万里,等.长鞭红景天的组织培养和快速繁殖[J].植物生理学通讯,2004,40(3):335.
[10]白玛玉珍,李宝海,次仁措姆.大花红景天愈伤组织的诱导[J].西藏科技,2008,2:74.
[11]Jong C P,Won D H,Jeong R P,etal.Changes in hepatic drug metabolizing enzymes and lipid peroxidation by methanol extract and major compound ofOrostachysjaponicus[J].Journal of Ethnopharmacology,2005,102(3):313-318.
[12]Hyoung J K,Jun Y L,Sung M K,etal.A new epicatechin gallate and calpain inhibitory activity fromOrostachysjaponicus.Fitoterapia[J].Agricultural and Biological Sciences,2009,80(1):73-76.
[13]杨和平,程井辰.马唐胚性与非胚性愈伤组织生理差异的初步研究[J].植物生理学通讯,1991,27(5):337-340.
[14]曲复宁,李丽霞,张敏,等.仙客来(CyclamenpersicumMill)胚性愈伤形态和组织结构的动态观察[J].烟台大学学报,2003,16(1):54-59.
[15]齐力旺,李玲,韩一凡,等.落叶松不同类型胚性和非胚性愈伤组织的生理生化差异[J].林业科学,2001,37(3):21-29.
[16]赵丽君,王雪芳,张金林,等.植物组织培养及其在草类植物中的研究和应用[J].草业科学,2011,28(6):1140-1148.
[17]张彦妮,边红琳,陈立新.蝴蝶兰幼嫩花梗组织培养和快速繁殖[J].草业科学,2011,28(4):590-596.
