利用菊芋一步法生产酒精工程菌构建的研究
2012-08-20李雪雁张秀兰
李雪雁,张 维,张秀兰,李 冰
(兰州理工大学生命科学与工程学院,甘肃 兰州730050)
菊芋(Helianthus tuberosus)是菊科向日葵属中能形成地下块茎的栽培种,其块茎中菊粉含量可占其干质量的70%以上,且这种植物适应性强,产量高,价格低廉,是一种宝贵的半野生资源,具有极大的开发利用价值。菊芋是酒精发酵的良好糖源,近年来,有关利用微生物菊粉酶进行菊芋酒精发酵的报道[1]相继出现,但选育高产酒精菌种直接应用于生产仍是人们努力的方向。余响华等[2]以K氏酵母、糖化酵母为亲本,采用单亲灭活原生质体融合技术进行属间融合,构建可直接转化淀粉产酒精的菌株。结果获得高于92%的形成率和6.5%的再生率,最终获得一株性状稳定、酒精转化率高的融合子,在含5.0%的可溶性淀粉发酵液中,酒精度可达7.0%。本研究通过设定合适的原生质体制备与融合条件,使酿酒酵母[3]与一种能高产菊粉酶的青霉菌菌株进行原生质体融合,通过测定融合菌株的产菊粉酶能力和产酒精能力,选用各项性能较优的融合子作为利用菊芋进行酒精发酵的菌株,旨为生物质可再生资源转化生产燃料酒精提供理论依据和研究资料。
1 材料与方法
1.1 材料
1.1.1 菌种 酿酒酵母(Saccharomyces cerevisiae)为兰州理工大学生命学院微生物实验室保存;青霉菌(Penicillium)为本试验前期工作中筛选所得产菊粉酶的菌株。
1.1.2 培养基
酵母YPD培养基:蛋白胨10g·L-1,葡萄糖20g·L-1,酵母膏10g·L-1。
青霉菌培养基:菊粉40g·L-1,酵母膏5 g·L-1,(NH4)2HPO410g·L-1。
再生培养基:将15%蔗糖(溶透稳定剂)加入YPD培养基,成分参见酵母YPD培养基。
融合子酒精发酵培养基:菊粉90g·L-1,酵母膏5g·L-1,蛋白胨10g·L-1。
1.1.3 试剂 Na2HPO4、柠檬酸、蔗糖、EDTA、β-巯基乙醇、PEG、CaCl2、蜗牛酶、纤维素酶、酒石酸钾钠、醋酸钠、冰醋酸和果糖,试验所涉及药品均为分析纯。
1.2 方法
1.2.1 菌种活化与扩大培养 试验中,由于酿酒酵母和青霉菌冷藏了一段时间,故需对其活化1~2代。方法为在试管斜面培养基上,28~30℃培养48 h,然后转接入液体摇瓶中(装量为100mL/500mL三角瓶),28~30℃,200r·min-1振荡培养。
1.2.2 原生质体制备
酵母菌原生质体制备
1)离心洗涤、收集细胞:分别取5mL上述培养至对数生长期的酵母细胞培养液,3 000r·min-1离心10min,弃上清液,向沉淀的菌体中加入5mL缓冲液,用无菌接种环,搅散菌体,振荡均匀后离心洗涤1次,再用5mL高渗缓冲液离心洗涤1次,收集菌体。
2)酶解脱壁:向收集的菌体中加入3mL脱壁预处理剂,振荡均匀,于30℃保温30min,离心5~10min,弃上清,无菌水洗涤2次。所用脱壁酶为1.5%蜗牛酶,30 ℃,150r·min-1轻微振荡,每隔30min取样镜检酶解程度,处理1~2h即可停止酶解处理,加入10%蔗糖溶液低渗冲击,然后离心5~10min,弃酶液,收集原生质体及未酶解细胞[4-6]。用高渗溶液洗涤,悬浮于原生质体保存液。
青霉菌原生质体制备:用无菌接种环从静置液体培养的三角瓶中挑出菌膜(对数生长期内),置于无菌的圆底离心管中,用4mL,加入3mL脱壁预处理剂,稍微振荡,于30℃保温30min,离心5~10 min,弃上清,用4mL,去上清液,加入2%纤维素酶和1%蜗牛酶混合酶液共3mL,同时加入0.1mL 10%β-巯基乙醇,于30℃水浴酶解3h,间或摇动。酶解结束后,2 500r·min-1离心5min,弃酶液,收集原生质体及未酶解细胞[7-8]。
1.2.3 原生质体再生 将原生质体稀释适当倍数后涂于再生高渗培养基平板,28℃培养,3~5d后观察。
1.2.4 原生质体融合 取两亲本原生质体各1mL,混合于灭菌小试管中,2 500r·min-1离心10min,弃上清液,向上述沉淀菌体中加入2mL促溶剂,轻轻摇匀,32℃水浴保温30min,取适量,适当稀释后涂布于完全培养基固体平板上,28℃培养3~5d后观察。
1.2.5 融合子的性能测定 挑取原生质体融合后在以菊粉为唯一碳源的培养基平板上长出的若干大菌落接种,30℃培养24~48h,后转接于液体完全培养基中。利用其营养标记、酶活力的测定、融合子的酒精发酵特性、细胞形态、体积大小、繁殖速率、发酵强度等方面的观察和测定结果来鉴定融合子。
1)融合子菊粉酶活力测定:菊粉酶的活力分为内切酶活力(I)和外切酶活力(S),具体测定方法见参考文献[9]。
2)酒精浓度测定:取100mL成熟发酵液到蒸馏瓶中,加入100mL水,混匀后蒸馏。取馏出液100mL。用酒精比重计测定馏出液中的酒精浓度[10],再校正为20℃时的酒精浓度。
3)糖分利用率与酒精的实际出率的计算参考文献[11]。
2 结果
2.1 原生质体制备条件的选择
2.1.1 菌龄 原生质体的形成与菌龄有很大关系,本试验选取对数生长期的酵母细胞培养液,培养时间控制在12h以内。丝状真菌生长较慢,18h以后肉眼才能看见菌膜,因此,菌龄控制在24h内,以更好地形成原生质体。
2.1.2 脱壁条件的选择 酵母原生质体制备一般选用蜗牛酶作为脱壁酶,本试验所采用的蜗牛酶浓度为1.5%,酶解时间1~2h。丝状真菌类原生质体制备一般选用蜗牛酶,纤维素酶不同浓度的组合酶系,本试验选择2%纤维素酶加1%蜗牛酶的混合酶液,丝状真菌所需脱壁时间较长,酶解时间约3h,究其原因可能是菌膜没有被捣碎,酶与菌丝体接触面积小,不利于原生质体的释放。
2.2 原生质体的融合及融合子的检出 采用PEG(MW 6000)促融法,将两亲本等比例混合,PEG浓度为30%,32℃水浴保温30min。
原生质体融合的两个亲本,其一为可以产生菊粉酶的青霉菌,其二为可以进行酒精发酵的酵母菌,二者融合以后直接采取选择性培养基鉴定的方法可很容易检出真正的融合子,挑取原生质体融合后长出的若干大菌落接种在以菊粉为唯一碳源的培养基平板上,30℃培养24~48h。后转接于液体完全培养基中,其融合子的酒精发酵特性、酶活力测定、细胞形态、体积大小、繁殖速率等方面的观察和测定结果表明,均不同于双亲菌株,因此,可确定为融合子。
2.3 酒精发酵菌株R8菌落形态 R8菌株在平板上的菌落形态更接近于酵母菌,只是菌落透明度并不高,同时没有表现出很明显的青霉菌菌落的形态(图1)。
2.4 融合子性能测定及筛选 通过对初步确定的16株融合菌株的进一步性能测定,包括其产菊粉酶的能力、产酒精的能力以及遗传稳定性的研究,最终确定一株利用菊芋发酵产生酒精的菌株。

图1 R8菌株平板菌落形态Fig.1 Morphology of R8strains flat colony
2.4.1 产菊粉酶能力测定 融合菌株R1、R3、R4、R8、R14产菊粉酶活力均极显著高于其他各组(P<0.01)(图2)。为了能从中筛选出产酒精能力强的发酵菌种,本研究将产菊粉酶活力相对较好的融合菌株R1、R3、R4、R10、R11、R14,在进一步的产酒精能力试验中都作为考察对象。
2.4.2 产酒精能力的测定 菌株R3和R8的产酒精能力均极显著高于其他各组(P<0.01),而且酒精得率均为41.16%(图3),这可能是因为菌株R3的酒精耐受性比R8好,R8的产酶能力随发酵液中酒精浓度的增加而受到抑制。但考虑到R8产菊粉酶活力高于R3,基本确定R8作为后续酒精发酵的菌株。测定误差,进行数据描述和分析。

图2 R1-R16菊粉酶活力测定结果Fig.2 Inulinase activity determination results of R1-R16
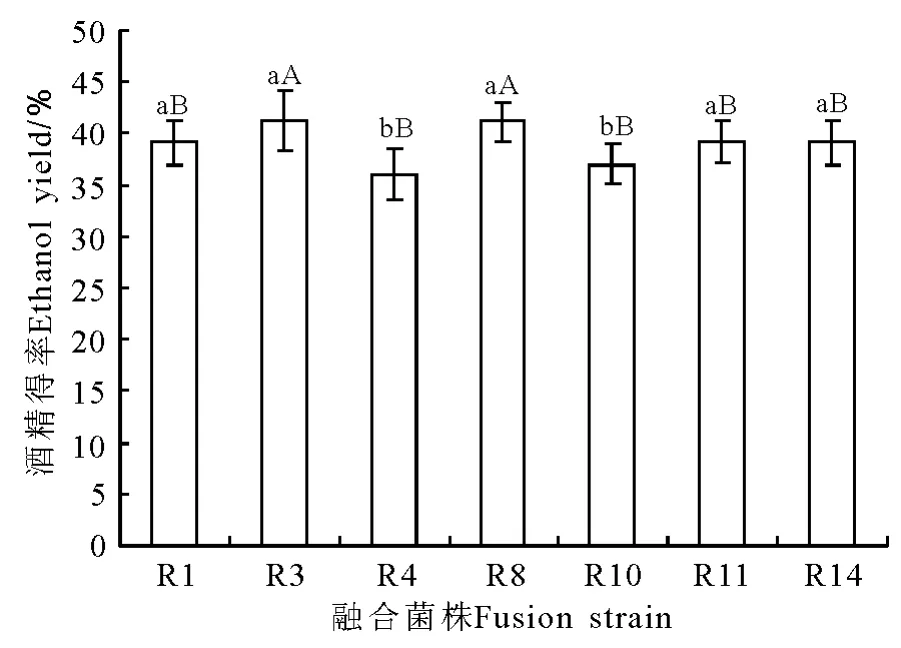
图3 融合菌株酒精发酵得率测定Fig.3 Alcohol fermentation rate determination of fusion strains
2.4.3 融合子稳定性测定结果 融合子R8稳定性测定结果表明,四代以内,酒精得率不变,均为41.16%,内切酶与外切酶活力有所波动,均为无规律小范围波动,稳定性相对良好(表1)。最终选择融合菌株R8作为进行后续发酵的菌株。
3 结论
选用适合酿酒酵母和青霉菌的不同原生质体制备条件,经融合与鉴定,筛选出了16株融合子,分别对其产菊粉酶和产酒精能力及其三代以上遗传稳定性做了测定,最终确定最优菌株为R8,内切酶活力为8.97U·mL-1,外切酶活力为25.09U·mL-1,酒精得率为41.16%,原料糖分利用率为75.52%,稳定性良好。

表1 融合子R8稳定性测定结果Table 1 Stability of fusion R8
利用原生质体融合技术构建出一种可以直接利用菊芋为原料来发酵产生酒精的菌种,经过初步的性能测定,筛选出一种产菊粉酶和产酒精能力较优的菌株,为进一步提高菊芋酒精发酵的产量有一定的参考意义。
[1] 李俊俊,唐艳斌,唐湘华.复合酶在菊芋粉发酵生产燃料乙醇中的应用[J].酿酒科技,2009(3):65-68.
[2] 余响华,张华山,李亚芳.原生质体融合构建直接转化淀粉生产燃料酒精的新型菌株[J].酿酒科技,2006(5):25-28.
[3] 李高扬,李建龙,王艳,等.利用高产牧草柳枝稷生产清洁生物质能源的研究进展[J].草业科学,2008,25(5):15-21.
[4] 彭帮柱,岳田利,袁亚宏.酵母菌与原生质体融合技术[J].西北农业学报,2004,13(1):101-103.
[5] 李英军,马晓燕.马克斯克鲁维酵母原生质体制备和再生条件的研究[J].酿酒科技,2006(7):51-54.
[6] 俞志敏,栾静,徐鹏.耐高糖酿酒酵母原生质体制备与再生过程研究[J].酿酒科技,2008(4):45-48.
[7] 甘志波,赵学慧.黑曲霉AMS-11原生质体的制备[J].湖北农业科学,1994(3):32-34.
[8] 王燕.双亲灭活米曲霉原生质体融合中原生质体制备的研究[J].中国酿造,2007(5):19-22.
[9] 王静,金征宇.黑曲霉产菊粉酶的发酵条件优化及诱变育种[J].生物技术,2002,12(3):42-45.
[10] 秦耀宗.酒精工艺学[M].北京:中国轻工业出版社,1998:317-326.
[11] 诸葛健,王正祥.工业微生物实验技术手册[M].北京:中国轻工业出版社,1994:97-99.
