11-脱氧轮枝菌素A引起前列腺癌PC3M细胞Caspase依赖的凋亡
2012-02-26时迎娣张迎秋倪扬笑史国利杨怀义
时迎娣,张迎秋,倪扬笑,史国利,杨怀义
1 中国科学院微生物研究所,北京 100101
2 中国科学院研究生院,北京 100049
3 辽宁师范大学,辽宁 大连 116029
随着人们饮食结构和生活方式的改变,我国的前列腺癌发病率和死亡率呈现逐年上升趋势[1-2]。针对早期前列腺癌细胞具有雄激素依赖性的特征,前期治疗前列腺癌最有效的手段,是通过雄激素阻断疗法进行治疗,然而在治疗期间,前列癌细胞往往会由雄激素依赖性转变为雄激素非依赖性[3-5]。目前,还没有有效的手段或药物治疗雄激素非依赖性前列腺癌。因此,雄激素非依赖性前列腺癌的治疗成为前列腺癌治疗的难点和重点。
PC3M细胞是前列腺癌高转移细胞系,是一种研究抑制前列腺癌雄激素非依赖性癌细胞生长的常用细胞[6-10]。近年来,人们研究了DIM[6]、金丝桃素[7]、羟基喜树碱[8]、苦参碱[9]、茶多酚[10]等对该细胞的抑制作用,为雄激素非依赖性前列腺癌的治疗提供了新的线索。
11-脱氧轮枝菌素A (又称11′-脱氧沃替西林A,11'-deoxyverticillin A,C42),是一种从冬虫夏草共生菌中分离得到的多硫代二氧基哌嗪(Epipolythiodioxopiperazines,ETPs) 族结构化合物[11],其对结肠癌细胞有诱导细胞凋亡的作用[12]。为探讨其对前列腺癌雄激素非依赖性癌细胞生长的抑制作用,我们研究了其对PC3M细胞凋亡的影响。结果表明,C42具有诱导 caspase依赖性细胞凋亡,抑制PC3M细胞生长的作用。这为进一步研究利用 C42类化合物作为雄激素非依赖性前列腺癌的可能临床药物提供了一定的实验和理论参考。
1 材料与方法
1.1 细胞
雄激素非依赖性前列腺癌高转移细胞系PC3M细胞为本实验室保存。
1.2 主要试剂和仪器
MEM、无酚红DMEM培养基、胎牛血清购自Gibco公司;预染蛋白Marker购自Fermentas公司;β-Actin抗体购自北京中杉金桥公司,PARP抗体购自Sigma-Aldrich公司;ECL发光液购自GE公司;Caspase-Glo 3/7试剂盒、MTS试剂盒(CellTiter 96® Aqueous Non-Radioactive Cell Proliferation Assay) 购自Promega公司;Annexin V-FITC试剂盒购自BD公司。11'-Deoxyverticillin A (C42) 由中国科学院微生物研究所车永胜研究员提供。Sunrise酶标仪为TECAN公司生产;生物发光检测仪为Promega公司生产;流式细胞仪为BD公司生产。
1.3 细胞培养
PC3M细胞于完全MEM培养基 (10%胎牛血清、100 g/L链霉素和100 U/mL的青霉素) 中培养,条件为37 ℃、5% CO2。
1.4 细胞增殖检测
将5 000~10 000个细胞分至96孔板中,每孔加入100 μL完全MEM培养基 (含10%胎牛血清、100 g/L链霉素及100 U/mL的青霉素)。过夜后换为新鲜的无酚红DMEM培养基 (含10%胎牛血清),并加入不同浓度的C42。加入20 μL MTS/PMS (MTS∶PMS=20∶1),37 ℃、5% CO2条件下持续培养,4 h内检测,酶标仪测定490 nm处的OD值,每样品设3次以上重复。
1.5 Western blotting检测
细胞经不同浓度、不同时间C42处理后,PBS漂洗并加入细胞裂解液 (150 mmol/L NaCl,50 mmol/L Tris-HCl,2 mmol/L EDTA,0.5% TritonX-100,0.5%脱氧胆酸钠和 1×蛋白酶抑制剂),收集裂解产物,冰上放置30 min,13 000 r/min离心15 min后收集上清。SDS-PAGE (8%) 电泳,湿转法将蛋白转移至PVDF膜。5%的脱脂牛奶封闭 2 h。孵育特异性抗体,anti-PARP为1∶1 000,anti-β-actin为1∶4 000,二抗分别为辣根过氧化物酶标记的抗兔 IgG 1∶4 000或抗小鼠IgG 1∶2 000,加ECL发光液,X-ray自显影后采用图像系统软件Quantity One分析,分析目的蛋白的表达差异。
1.6 Caspase-Glo 3/7检测
将5 000~10 000个细胞分至96孔板中,每孔加入100 μL完全MEM培养基 (含10%胎牛血清、100 g/L链霉素及100 U/mL的青霉素)。过夜后换为新鲜的DMEM培养基 (含10%胎牛血清),并加入不同浓度的 C42,每孔100 μL。37 ℃、5% CO2条件下持续培养6 h后,于室温下,加入100 μL Caspase-Glo 3/7试剂,300~500 r/min摇动30 min,生物发光仪检测荧光。每样品设3次以上重复。
1.7 流式细胞检测
胰酶消化经不同浓度C42处理的细胞,离心收集细胞,PBS洗涤 2次,加入 1×结合缓冲液(0.1 mol/L Hepes (pH 7.4),1.4 mol/L NaCl,25 mmol/L CaCl2) 重悬细胞,使其密度为1×106个细胞/mL。取出 1×105个细胞加入流式专用管中,并加入5 μL Annexin V-FITC,室温下避光孵育15 min,上机前1 min,再加入1.5 μL PI,并补加400 μL 1×结合缓冲液,混匀细胞后,流式细胞仪分析。
2 结果
2.1 C42处理可抑制PC3M细胞的增殖
通过MTS/PMS检测C42处理对PC3M细胞增殖的影响。结果表明,使用浓度分别为0.25 μmol/L、0.5 μmol/L的C42处理PC3M细胞12 h后,其相对细胞增殖抑制率分别为11% (P<0.05) 及44% (P<0.01) (图1A)。用浓度为0.25 μmol/L C42处理PC3M细胞,发现随着时间的延长,PC3M细胞相对细胞增殖抑制率显著增加 (图1B)。如图1B所示,PC3M细胞相对细胞增殖抑制率从无显著变化 (6 h) 增加至 36% (24 h),其中12 h组与6 h组相比,24 h组与12 h组相比均具有显著性差异 (P<0.01)。以上说明,C42具有抑制PC3M细胞生长的作用,并且对细胞生长的抑制作用同时间和浓度具有相关性。
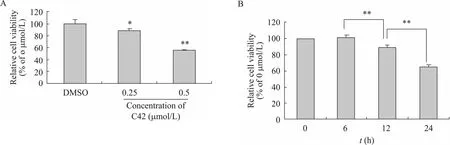
图1 C42诱导对PC3M细胞生长的影响Fig. 1 C42 inhibits the cell proliferation of prostate cancer cells. (A) Cell viability of PC3M cells treated with different concentrations of C42 for 12 h. (B) Cell viability of PC3M cells treated with C42 (0.25 μmol/L) for different time. The data is represented as from three independent experiments. *P<0.05; **P<0.01.
2.2 C42处理可诱导PC3M细胞凋亡的发生
细胞凋亡是细胞死亡的一条重要途径。为验证C42处理是否通过诱导PC3M细胞凋亡的发生,从而降低了其细胞增殖能力。我们利用细胞凋亡发生时膜内外翻的磷脂酰丝氨酸可与Annexin V特异性结合,及PI能穿透不完整细胞膜使凋亡晚期细胞和坏死细胞的细胞核着色的特征,通过Annexin V/PI双染,利用流式细胞术对其进行了分析。结果表明,经C42处理6 h后,细胞凋亡显著增强。0.25 μmol/L 和 0.5 μmol/L C42处理后,其早期凋亡细胞增加数量与对照相比分别增加了1.1倍和2.6倍,均达到了统计学上的显著差异 (图2A,2B)。而晚期凋亡细胞和/或坏死细胞的增加数量,仅0.5 μmol/L的处理达到了显著性差异 (图2A,2C)。
2.3 C42处理可增强PC3M细胞中 caspase-3/7的活性

图2 C42对PC3M细胞凋亡的流式细胞分析Fig. 2 The relationship between C42 and cell apoptosis of PC3M cells. (A) After treated with different concentrations of C42 for 6 h, PC3M cells were collected, incubated with FITC-Annexin V/PI and subjected to flow cytometry. (B) Quantities of early apoptotic cells: PI negative and Annexin V positive cells in all analyzed PC3M cells. (C) Quantities of end stage apoptotic and/ or necrotic cells: PI positive cells in all analyzed PC3M cells. The data is represented as from three independent experiments. *P<0.05; **P<0.01.

图3 C42对caspase-3/7的激活Fig. 3 Relationship between C42 and the activity of caspase-3/7 in PC3M cells. PC3M cells were pretreated with C42 for 6 h, then, cells were subjected to caspase-Glo 3/7 assay. The data represented is based on three independent experiments. **P<0.01.
Caspase-3/7在细胞发生凋亡过程中起到至关重要的作用,其酶活性随着细胞凋亡发生程度的增加而增加。为验证C42处理PC3M细胞后诱导的细胞凋亡,是否具有caspase依赖性。我们用caspase-Glo 3/7试剂盒对caspase-3/7的活性进行检测。如图 3所示,随着 C42处理浓度的增加,caspase-3/7切割的底物所发的荧光强度不断增加,当C42浓度分别为0.1、0.25、0.5 μmol/L时,其荧光强度与对照组相比均具有极显著的差异,分别是对照组的2倍、5倍和6.5倍。说明C42能够增强PC3M细胞的caspase-3/7的活性,诱导caspase依赖性细胞凋亡,且具有一定的浓度依赖性。
2.4 C42处理可诱导PC3M细胞中PARP的剪切
PARP的切割是 caspase依赖性细胞凋亡的一种特异性标志,当caspase依赖性细胞凋亡发生时,116 kDa的PARP会被caspase特异性切割为89 kDa和24 kDa[13-14]。因此为进一步阐明C42诱导的细胞凋亡为 caspase依赖的凋亡,我们在分析了caspase-3/7活性的基础上,对PARP的切割情况进行了分析。结果发现,当分别用浓度为0.1、0.25、0.5 μmol/L的C42处理PC3M细胞12 h后,随着C42浓度的增加,PARP蛋白的被剪切程度增强 (图 4A,4B)。当用 0.25 μmol/L的C42处理细胞0、3、6、12 h时,PARP的剪切量随着时间的延长而不断增加 (图4C,4D)。PARP的剪切对C42具有一定的浓度依赖性和时间依赖性。这进一步说明,C42对PC3M细胞诱导的细胞凋亡为caspase依赖的细胞凋亡。
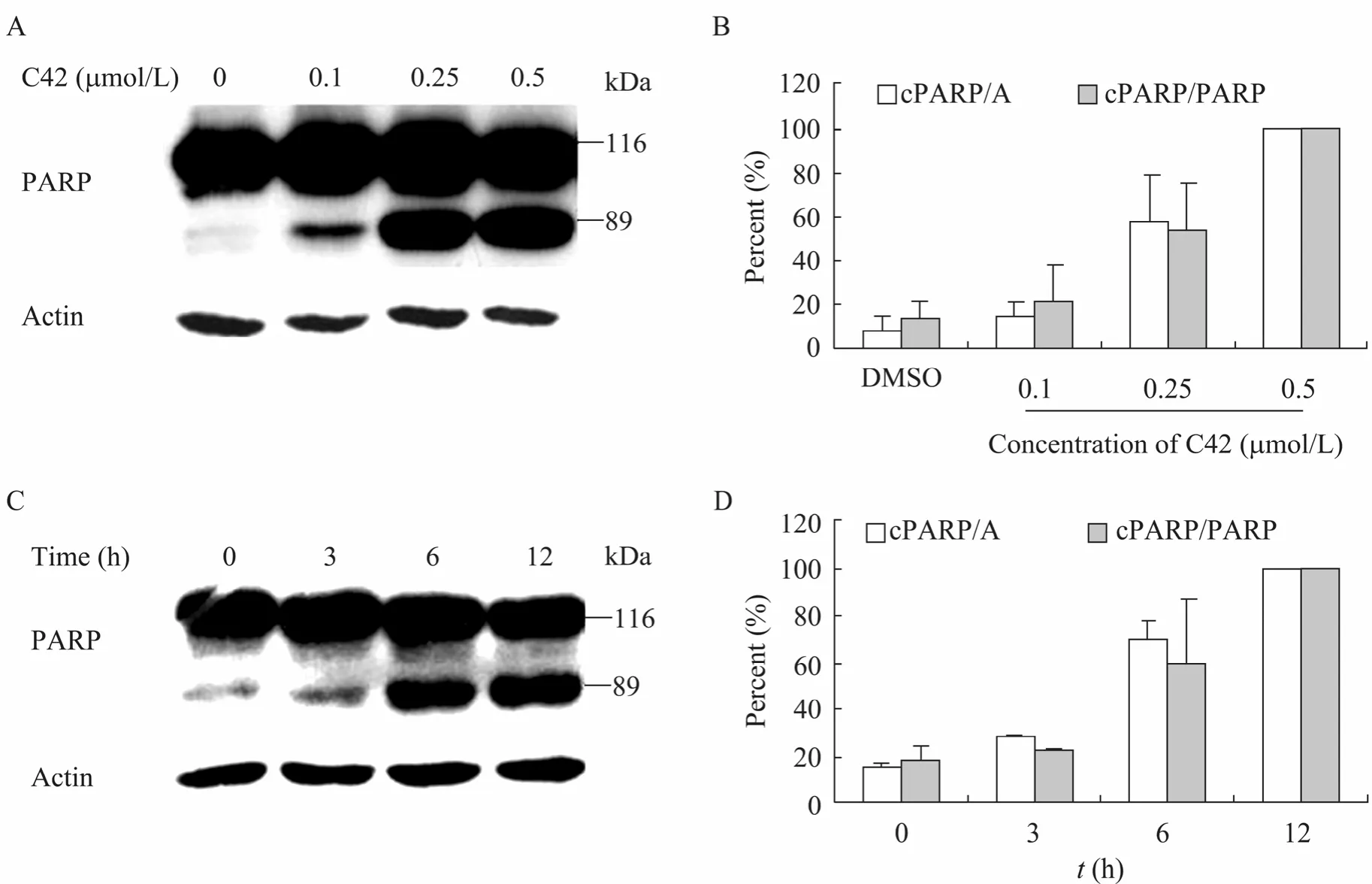
图4 C42对PC3M细胞PARP剪切的影响Fig. 4 Relationship between C42 and the expression levels of cleaved PARP in PC3M cells. (A) Western blotting analysis of the PARP expression levels in PC3M cells. PC3M cells were treated with different concentrations of C42 for 12 h, then cells were lysed and subjected to western blotting with antibody to PARP or β-actin. (B) Quantification of the cleaved PARP (cPARP) expression levels for A. The cPARP/A (%) and cPARP/PARP (%) in PC3M cells treated with 0.5 μmol/L C42 were defined as 100 respectively. The results were based on three independent experiments. (C) Western blotting analysis of the cPARP expression levels in PC3M cells. Treated with 0.25 μmol/L C42 for 0 h, 3 h, 6 h, and 12 h, PC3M cells were then lysed and subjected to Western blotting with the antibody to PARP or β-actin. (D) Quantification of the cPARP expression levels for C. The cPARP/A (%) and cPARP/PARP (%) in PC3M cells treated with C42 for 12 h were defined as 100 respectively. The results were based on three independent experiments. cPARP/A (%): Quantitation of the cPARP (89 kDa) expression levels normalized against β-actin. cPARP/PARP (%): Quantitation of the cPARP (89 kDa) expression levels normalized against the full-length PARP (116 kDa).
3 讨论
ETPs族化合物是来源于真菌的活性化合物,具有免疫抑制、抗炎症反应和抗菌、寄生虫、病毒等广泛的生物活性作用[15],是潜在的肿瘤治疗药物,其家族成员胶黏毒素、来普生苷均被证实对癌细胞产生毒性[16-18]。我们研究发现,从冬虫夏草共生菌中分离到的此类化合物C42,具有抑制前列腺癌雄激素非依赖性 PC3M细胞生长和诱导细胞凋亡的作用。进一步分析发现,其对PC3M诱导的细胞凋亡为caspase依赖性的凋亡,C42处理细胞后,细胞的caspase-3/7的活性增加,PARP的被剪切程度增强。这对利用C42类化合物作为肿瘤药物的临床应用所涉及的基础研究具有重要意义。
我们研究发现,在利用0.25 μmol/L C42处理PC3M细胞6 h后,即可显著增加caspase-3/7的活性,增加 PARP的被剪切量,显著诱导caspase依赖的细胞凋亡发生;处理12 h后,即可显著降低细胞增殖能力,抑制PC3M细胞的生长;24 h后,与对照相比,其细胞增殖抑制率可达至36%。当C42使用浓度提高至0.5 μmol/L时,处理6 h后,其不仅能显著地增加早期凋亡细胞的数量,且可显著提高晚期凋亡细胞和/或坏死细胞的比例;处理12 h后,其细胞增殖抑制率可达44%。
而目前筛选出的对 PC3M细胞具有杀伤作用的其他化合物,如金丝桃素在 1 μmol/L浓度下,处理48 h后,其细胞增殖抑制率为20%[7];羟基喜树碱在2.74 μmol/L浓度下,处理24 h后,其抑制率为26.57%[8];苦参碱在503 μmol/L浓度下,处理24 h后,其抑制率为1.68%[9];DIM在10 μmol/L浓度下,处理48 h后,其抑制率为35.6%[6]。由此可见,C42对PC3M细胞具有更好的杀伤作用,且具有更高的潜在应用价值。
目前研究认为,促使细胞导向死亡的途径主要有3种,即细胞凋亡 (Apoptosis)、自噬性死亡(Autophagic cell death) 和细胞坏死 (Necrosis)[19]。C42处理对PC3M细胞生长的抑制,除通过细胞凋亡途径使细胞导向死亡外,是否还通过引起自噬性细胞死亡、细胞坏死而使细胞导向死亡,C42是否可抑制实体瘤的生长等,这些对进一步开发利用ETPs类真菌来源的活性化合物和研究此类化合物的可能临床治疗前列腺癌均十分重要,有待进一步深入研究。
致谢 衷心感谢中国科学院微生物研究所姜学军研究员给予本文的指导与帮助!
[1] Hua LX, Qiao D, Xu B, et al. Clinical and pathological characteristics of screen-detected versus clinically diagnosed prostate cancer in Nanjing, China. Med Oncol, 2011, 28(1): 357−364. [2] Fang RK. The study of environment and cancer in China-with special reference to Shanghai. [2004-01-25]. http://www.geographie.uni-muenchen.de/ geomed/pdf_presentations/07_Sat_Rukang.pdf.
[3] Soriano-Hernández AD, Galvan-Salazar HR, Montes-Galindo DA, et al. Antitumor effect of meclofenamic acid on human androgenindependent prostate cancer: a preclinical evaluation. Int Urol Nephrol, 2011: 1−7.
[4] Miyamoto H, Messing E M, Chang C. Androgen deprivation therapy for prostate cancer: current status and future prospects. Prostate, 2004, 61(4): 332−353.
[5] Isaacs JT. New strategies for the medical treatment of prostate cancer. BJU Int, 2005, 96(S2): 35−40.
[6] Pan YZ, Li Y, Zhao YY, et al. Inhibitory effect of DIM on growth of human prostate cancer cell PC3M. J Jilin Univ: Med Ed, 2006, 32(6): 1034−1036.潘玉琢, 李扬, 赵燕颍, 等. DIM对人激素非依赖性前列腺癌细胞PC3M的生长抑制作用. 吉林大学学报: 医学版, 2006, 32(6): 1034−1036.
[7] Gao LF, Meng Y, Zhao XJ, et al. Inhibitory effect of photoactivated hypericin on growth of human prostate cancer cell PC3M. J Jilin Univ: Med Ed, 2004, 30(1): 97−99.高丽芳, 孟艳, 赵雪俭, 等. 光活化的金丝桃素对人前列腺癌细胞PC3M的生长抑制作用. 吉林大学学报: 医学版, 2004, 30(1): 97−99.
[8] Jin GH, Chen S, Yang L, et al. Hydroxycamptothecin induced human prostate cancer Line PC-3M cell apoptosis. Chin J Lab Diagn, 2010, 14(1): 12−13.金光虎, 陈爽, 杨丽, 等. 羟基喜树碱对人前列腺癌 PC-3M细胞凋亡的影响. 中国实验诊断学, 2010, 14(1): 12−13.
[9] Jin GH, Gao J, Mao XQ, et al. Matrine induced human prostate cancer Line PC-3M cell apoptosis and affected the Osteopontin levels. Chin J Gerontol, 2009, 29(21): 2758−2759.金光虎, 高吉, 毛小强, 等. 苦参碱诱导人前列腺癌 pc-3M 细胞凋亡及对骨桥蛋白表达的影响.中国老年学杂志, 2009, 29(21): 2758−2759.
[10] Mao XQ, Na W L, Zhao D, et al. Effects of tea polyphenol on proliferation inhibition and apoptosis in human prostate cancer PC-3M cells. Chin J Lab Diagn, 2010, 14(2): 170−173.毛小强, 那万里, 赵丹, 等. 茶多酚对前列腺癌PC-3M 细胞增殖与凋亡的影响. 中国实验诊断学, 2010, 14(2): 170−173.
[11] Dong JY, He HP, Shen YM, et al. Nematicidal epipolysulfanyldioxopiperazines from Gliocladium roseum. J Nat Prod, 2005, 68(10): 1510−1513.
[12] Zhang N, Chen YL, Jiang RX, et al. PARP and RIP 1 are required for autophagy induced by 11'-deoxyverticillin A, which precedes caspase-dependent apoptosis. Autophagy, 2011, 7(6): 598−612.
[13] Schlegel J, Peters I, Orrenius S, et al. CPP32/Apopain is a key interleukin 1β converting enzyme-like protease involved in Fas-mediated apoptosis. J Biol Chem, 1996, 271(4): 1841−1844. [14] Liu XS, Kim CN, Yang J, et al. Induction of apoptotic program in cell-free extracts: requirement for dATP and cytochrome c. Cell, 1996, 86(1): 147−157.
[15] Gardiner DM, Waring P, Howlett BJ. The epipolythiodioxopiperazine (ETP) class of fungal toxins: distribution, mode of action, functions and biosynthesis. Microbiology, 2005, 151(4): 1021−1032.
[16] Bernardo PH, Brasch N, Chai CLL, et al. A novel redox mechanism for the glutathione-dependent reversible uptake of a fungal toxin in cells. J Biol Chem, 2003, 278(47): 46549−46555.
[17] Beaver JP, Waring P. Lack of correlation between early intracellular calcium ion rises and the onset of apoptosis in thymocytes. Immunol Cell Biol, 1994, 72(6): 489−499.
[18] Yanagihara M, Sasaki-Takahashi N, Sugahara T, et al. Leptosins isolated from marine fungus Leptoshaeria species inhibit DNA topoisomerases I and/or II and induce apoptosis by inactivation of Akt/protein kinase B. Cancer Sci, 2005, 96(11): 816−824.
[19] Kroemer G, Galluzzi L, Vandenabeele P, et al. Classification of cell death: recommendations of the Nomenclature Committee on Cell Death 2009. Cell Death Differ, 2009, 16(1): 3−11.