蒙古沙冬青干旱胁迫全长cDNA文库构建及序列分析
2012-02-26林清芳王学峰李记园赵鸿彬王茅雁
林清芳,王学峰,李记园,赵鸿彬,王茅雁
内蒙古农业大学生命科学学院,内蒙古 呼和浩特 010018
从基因组水平分离和鉴定植物干旱诱导表达基因是挖掘关键抗旱基因、探讨植物抗旱性分子机理的重要前提,目前主要通过全长cDNA文库和EST文库技术开展此项工作。前者可高通量获得基因的全长cDNA,相对于EST文库技术,它在开展基因功能分析、正确进行基因功能注释和发现新基因等方面具有明显优势[1-2]。SMART (Switching mechanism at 5′-end of RNA transcript) 技术是目前国内外最常用的全长cDNA文库构建技术之一,因其具有实验程序简单、快速和成本较低等优点,已被成功应用于油菜和香蕉等多种植物全长cDNA文库的构建[3-4]。通过全长cDNA文库结合表达谱分析技术,国内外已对拟南芥和玉米等植物在干旱胁迫下的基因表达及其调控途径进行了研究,筛选出一批干旱诱导表达基因,为鉴定重要抗旱基因做出了贡献[5-6]。然而,这些植物的抗旱性都很有限,而利用典型抗旱植物为材料开展此类研究尚未见报道。
沙冬青 Ammopiptanthus (Maxim.) Cheng f.是我国西北荒漠区特有的唯一常绿旱生阔叶灌木和珍稀濒危植物,有蒙古沙冬青 (又名沙冬青,A. mongolicus) 和新疆沙冬青 (又名小/矮沙冬青,A. nanus) 两个种。由于生境地严酷的自然条件,沙冬青在进化中形成了极强的抗寒和抗旱等抗逆特性,可在−30 ℃和年降水量不足200 mm、年蒸发量在3 000 mm以上的严酷条件下生存,成为研究者关注的重要抗逆资源植物[7-8]。近年来,人们从沙冬青中分离出多个低温诱导表达基因,其中一些基因如AmLEA、AmPI和AmEBP1可提高转基因植物的抗寒性[9-10]。郭九峰等从构建的沙冬青冬季叶片 EST文库中获得360个UniEST序列[11]。这些工作为发掘沙冬青抗寒基因和探讨其抗寒性分子机理奠定了基础。然而,至今尚未见到有关沙冬青抗旱基因分离及其抗旱性分子机理的研究报道。本文以蒙古沙冬青为材料,利用SMART技术构建了其在干旱胁迫下的全长cDNA文库,并对文库进行了规模化测序和序列分析,为进一步开展表达谱分析和高通量筛选其抗旱基因奠定了基础。
1 材料与方法
1.1 材料
用沙培法将蒙古沙冬青培养至4个月,取出幼苗用水漂洗干净,置于25 ℃下进行自然干燥。分别在干燥0、1、3、6、12、24、48和72 h取叶片和根系。此外,在8月初取呼和浩特地区塑料大棚中连续6个月未浇水、已培育18个月的蒙古沙冬青幼叶作为自然干旱胁迫的样品。所有样品均在液氮中速冻后保存于−76 ℃,用于提取总RNA。
1.2 方法
1.2.1 总RNA提取与mRNA分离
采用改进的热酚法[12]提取总 RNA,取少量样品进行电泳并测定OD值,以检测其完整性、浓度和纯度。将不同样品总RNA各200 µg等量混合,按照试剂盒 (Promega公司) 说明分离mRNA,最后用DEPC水溶解。取少量样品进行电泳并测定OD值,以估测分子量和浓度。
1.2.2 SMART cDNA文库构建
按照SMARTTMcDNA Library Construction Kit (Clontech公司) 说明书进行操作:
1) cDNA合成:取1 µg mRNA做模板合成cDNA第一链。双链 cDNA合成采用 LD-PCR (Long-distance PCR) 方法,即在200 μL PCR管中加入10×Advantage 2 PCR缓冲液10 μL,第一链cDNA、50×dNTPs、5′PCR引物、CDSⅢ/3′PCR引物和50×Advantage 2聚合酶混合物各2 μL,ddH2O 80 μL,总体积100 μL。PCR反应程序为:95 ℃ 1 min;95 ℃ 15 s,68 ℃ 6 min,19个循环。取5 μL产物进行电泳检测。
2) cDNA纯化与分级回收:将LD-PCR产物用蛋白酶K消化,再用SfiⅠ酶切,过Chroma Spin-400层析柱进行分级分离,收集大于500 bp的片段合并为一管,沉淀后加去离子水7 μL溶解。
3) cDNA与载体连接和包装:取1 μL双链cDNA与1 μL λTriplEx2载体混合,用T4 DNA连接酶于16 ℃过夜连接。取50 μL λDNA包装蛋白 (Promega公司) 放于冰上融化,立即加入5 μL连接产物于22 ℃包装3 h,然后加入445 μL噬菌体缓冲液和25 μL氯仿,混匀,离心,取上清即为原始文库。
1.2.3 文库质量检测
将文库用稀释缓冲液按1∶5和1∶15的体积比稀释,各取1 μL转染大肠杆菌XL-Blue,与顶层琼脂混匀、铺平板,于37 ℃倒置培养。然后记数噬菌斑,按公式计算:
滴度 (PFU/mL) =噬菌斑数×稀释倍数×103(mL/L) /噬菌体铺板体积 (μL)。
重组率 (%) =白斑数/(白斑数+篮斑数) ×100。
库容量=文库滴度 (PFU/mL) ×文库体积(mL)。
根据载体多克隆位点两测序列设计 5′引物和3′引物 (序列见表1),随机挑取24个噬菌斑进行PCR反应,以检测插入片段长度。
1.2.4 文库环化及序列测定
取 20 μL原始文库转染大肠杆菌环化菌株BM25.8,使λTriplEx2重组噬菌体环化为质粒形式。将部分环化菌液铺平板,随机挑取单克隆进行菌液PCR检测,引物等同1.2.3。取阳性克隆送北京华大基因研究中心用Megabace 1 000和ABI3730xl测序仪进行5′端测序。
1.2.5 序列分析
由北京华大基因研究中心代理序列分析。基本步骤是:用phred和cross-match程序获取Clean EST序列;用phrap软件对Clean EST序列进行组装,获取 Unigene数据和冗余度 (冗余度=1−Unigenes数/组装的 ESTs数);将Unigene序列与Nt、Nr和 Swissprot等数据库进行Blast比对和功能注释,并用GO分类体系进行功能分类。
1.2.6 基因表达分析
取自然干燥处理0 (CK)、1、3、8和24 h的蒙古沙冬青幼苗提取总 RNA (方法同 1.1和1.2.1),然后反转录合成 cDNA。以蒙古沙冬青AmACTIN基因作为内参基因,用RT-PCR方法对文库中的6个基因,即AmCaM (Calmodulin,钙调素)、AmDREB (Dehydration-responsive elementbinding protein,脱水应答元件结合蛋白)、AmTI (Trypsin inhibitor,胰蛋白酶抑制剂)、AmDHN (Dehydrin,脱水素)、AmEREBP (Ethyleneresponsive element-binding protein,乙烯应答元件结合蛋白) 和AmCAT (Catalase,过氧化氢酶) 基因的表达变化进行分析,引物序列见表1。PCR反应体系为:10×PCR缓冲液1.5 μL、dNTPs (2.5 mmol/L) 1.2 μL、上下游引物 (10 μmol/L)各0.3 μL、cDNA模板X μL、rTaq DNA聚合酶(5 U/μL) 0.15 μL、ddH2O Y μL,总体积15 μL。PCR扩增程序为:94 ℃ 3 min;94 ℃ 30 s,60 ℃30 s,72 ℃ 45 s,24 (AmACTIN) 或30 (其他基因)个循环;72 ℃ 10 min;4 ℃保温。将扩增产物进行电泳检测。

表1 引物序列Table 1 The primer sequence
2 结果与分析
2.1 cDNA文库构建及质量检测
用改进的热酚法提取总RNA,经电泳检测其28 S和18 S rRNA条带清晰无拖尾,表明其完整性好,未降解 (图略)。用紫外分光光度法测得不同样品的OD260/280在1.9~2.1、OD260/230在1.9~2.3之间,表明蛋白质、酚类、糖和盐分等杂质基本去除干净,总RNA样品纯度较高,符合建库要求。将不同干旱胁迫处理时间点的总RNA样品等量混合分离 mRNA,经电泳检测其分布集中在500~3 000 bp之间,且看不到rRNA条带(图略),表明其纯度和完整性较好,可用于文库构建。
取mRNA作模板合成cDNA第一链,再经LD-PCR合成双链cDNA,经电泳检测其大小分布范围超出 500~5 000 bp,主要分布区在750~2 000 bp之间 (图1),表明cDNA第一链的合成及其PCR扩增反应正常。
将LD-PCR产物用蛋白酶K消化、SfiⅠ酶切,再经层析柱分级分离,回收大于500 bp的片段,以1∶1比例与λTriplEx2载体连接。将连接产物进行体外包装,得到500 μL原始文库。其滴度为1.6×107PFU/mL,重组率为97.7%,库容量为 7.8×106,随机克隆插入片段长度在600~2 300 bp之间,多数接近或超过1 000 bp (图2),表明所建文库质量较高。
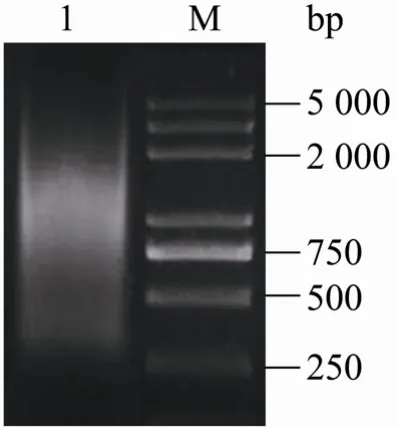
图1 LD-PCR产物电泳图谱Fig. 1 Electrophoresis pattern of LD-PCR product. 1: ds cDNA; M: Trans 2K plus DNA marker.
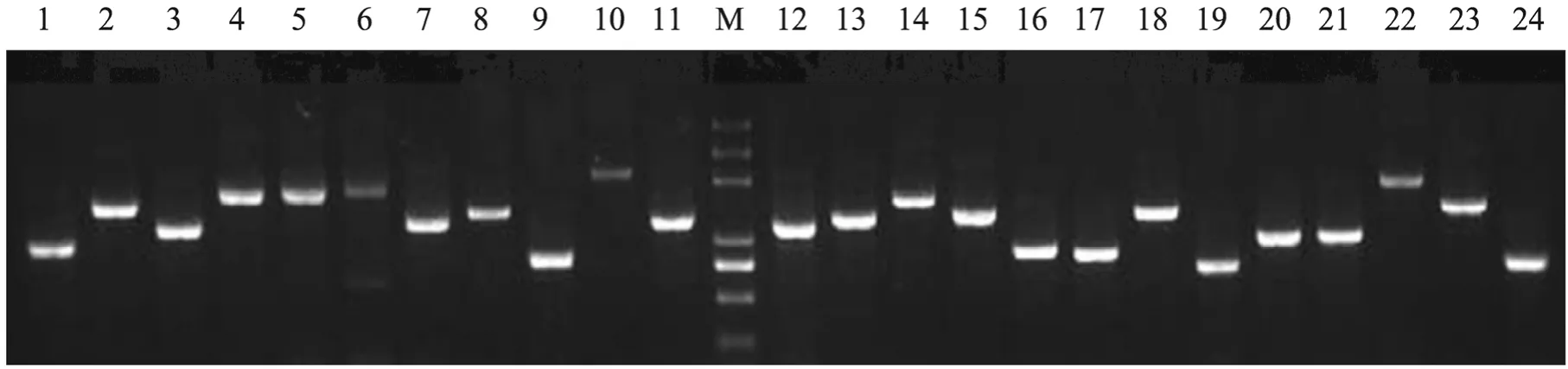
图2 24个随机克隆PCR产物电泳图谱Fig. 2 Electrophoresis pattern of PCR products from 24 random clones. 1−24: 24 clones; M: Trans 2K plus DNA marker as in Fig. 1.
2.2 文库测序及序列分析
利用大肠杆菌环化菌株BM25.8将原始文库进行环化,随机挑取部分单克隆进行菌液 PCR检测,得到3 000个阳性克隆并进行了5′端测序。共获得2 607条大于100 bp的有效序列,经组装得到327个Contig和1 123个Singleton,合计1 450个Unigene。其长度介于133~1 480 bp,平均为675 bp。这些Unigene中有1 123个 (占总数77.5%) 在文库中只出现1次,324个 (占总数22.3%) 出现2~38次,3个 (占总数0.2%)重复频次很高,分别出现61、88和112次。文库的冗余度为44.4%。
为了分析Unigene可能的生物学功能,将其在Nt、Nr和Swissprot等数据库中进行Blast比对,结果发现其中919条 (占总数63.4%) 与已知或推测功能的基因具有同源性,354条 (占总数24.4%) 具有功能未知的同源序列,其余177条 (占总数12.2%) 未获得任何序列信息。后两类基因合计531条 (占总数36.6%),代表着新基因。与数据库中沙冬青序列具有同源性或属于同一转录本的Unigene序列只有13条。在可进行功能注释的Unigene中有不少与逆境应答相关,包括脱水应答转录因子、蛋白激酶、蛋白磷酸酶、钙离子结合蛋白、抗氧化酶类、乙烯合成酶类、脯氨酸合成酶类、脱水保护蛋白、热激蛋白、冷诱导蛋白、水孔蛋白、泛素及其连接酶、胰蛋白酶抑制剂、几丁质酶和金属硫蛋白(Metallothionein,MT) 等编码基因,其中最后3种基因的EST出现频率很高,均在60次以上。
采用GO功能分类方法可将Unigene分为3大类,即细胞组分、生物学过程和分子功能,分别包含265、452和566个Unigene,占Unigene总数的18.3%、31.2%和39.0%,对应于424、693和1 007 (总计2 124) 个GO分类。在3大功能类型中共包含20个亚类 (Terms),其中与生理过程 (Physiological process)、细胞过程 (Cellular process)、结合 (Binding)、催化活性 (Catalytic activity) 和细胞 (Cell) 相关的基因所占比例最大 (占总数 16.4%~27.2%),其次是与细胞器(Organelle)、蛋白复合体 (Protein complex)、运输活性 (Transporter activity) 和结构分子活性(Structure molecule activity) 相关的基因 (占总数 5.2%~10.2%),与刺激应答 (Response to stimulus)、基因表达调节 (Transcription and translation regulator activities)、生理生化调节(Regulation of biological process and enzyme regulator activity)、胞外区域 (Extracellular region) 和信号转导 (Signal transducer activity)相关的基因也占相当比例 (占总数0.6%~3.0%),与发育 (Development)、抗氧化 (Antioxidant activity)、细胞运动 (Motor activity) 和营养库(Nutrient reservoir activity) 相关的基因最少 (占总数0.1%~0.5%)(图3)。
2.3 部分抗逆相关基因的表达分析
为了了解文库中的抗逆相关基因是否参与蒙古沙冬青对干旱胁迫的应答反应,用半定量RT-PCR方法分析了其中6个基因在干燥脱水过程中的表达变化。结果表明,除AmEREBP基因在处理1 h和8 h有一定程度的表达下调外,其余5个基因的表达水平在处理1~3 h后均有明显上调,尤其以AmTI和AmDHN上调幅度最大,并一直持续到处理结束 (24 h);AmCaM在处理24 h后表达量回落到接近对照水平;AmDREB在处理8~24 h后仍保持较高的表达量;而AmCAT在处理8~24 h后表达量有所降低,但仍明显高于对照水平 (图4)。这表明这些基因都不同程度地参与了蒙古沙冬青对干旱胁迫的应答反应,其具体的功能验证正在进行之中。

图3 Unigenes的GO功能分类与分布图Fig.3 Map of GO functional classification and distribution of the Unigenes. Any given sequence may have been assigned to more than one category. The Unigene number and percentage in each GO term were shown in the brackets.

图4 部分抗逆相关基因在干旱胁迫下的表达变化Fig. 4 Expression profiles of some stress-resistant related genes under drought stress.
3 讨论
SMART技术因具有操作简单和全长比例较高等优点,在全长cDNA文库的构建中得到广泛应用。本文应用该技术构建了蒙古沙冬青在干旱胁迫下的全长cDNA文库,其滴度和重组率分别高达1.6×107PFU/mL和97.7%,插入片段长度多数接近和超过1 kb,符合高质量cDNA文库的标准。从文库中随机挑选3 000个阳性克隆进行了 5′端测序和序列分析,共获得 1 450个Unigene,其中与抗逆相关的基因和功能未知的新基因至少占40%以上,为规模化筛选和鉴定蒙古沙冬青抗旱基因和探讨其抗旱性分子机理奠定了基础。
植物抗旱基因可分为调节基因和功能基因两大类,通常在遭受干旱胁迫时,先是抗旱调节基因被迅速诱导表达,然后通过一系列复杂的信号转导途径将胁迫信号向下游传递,最终激活抗旱功能基因表达,使植物通过多种机制产生适应或抗性[13]。已知的抗旱调节基因主要编码bZIP、MYB、MYC和DREB类转录因子以及参与信号转导的蛋白质或酶,而抗旱功能基因主要编码渗透调节与脱水保护和抗氧化类物质或者其合成酶类,以及在错误和损伤的修复、代谢途径与细胞结构的改变等过程中起直接作用的蛋白质或酶。在我们构建的文库中出现多个与抗旱调节基因同源的Unigene序列,如DREB和MYB等可激活重要抗旱功能基因表达的转录因子、磷脂酶C (Phospholipase C,PLC) 等与第二信使产生相关的酶、CaM 和钙依赖性蛋白激酶(Calcium-dependent protein kinase,CDPK) 等Ca2+信号传感蛋白、有丝分裂原活化蛋白激酶(Mitogen-activated protein kinase, MAPK) 和2C类蛋白磷酸酶 (Protein phosphatase type 2C,PP2C) 等参与信号级联传递的蛋白激酶和蛋白磷酸酶等编码序列。在文库中出现更多的是抗旱功能基因的同源序列,其中包括重要渗透调节物质脯氨酸合成的关键酶△`-吡咯啉-5-羧酸合成酶 (Delta`-pyrroline-5-carboxylate synthetase,P5CS)、脱水保护性蛋白DHN和胚胎发生晚期丰富蛋白 (Late embryogenesis-abundant protein,LEA)、抗氧化酶类超氧化物歧化酶 (Superoxide dismutase,SOD) 和CAT、与蛋白质修复和降解有关的热激蛋白 (Heat shock protein,HSP) 和泛素-蛋白连接酶 (Ubiquitin-protein ligase,UPL)、以及参与细胞壁木质化而减少水分散失的 S-腺苷甲硫氨酸合成酶 (S-adenosylmethionine synthetase,SAMS) 等编码基因。这些基因可能是构成蒙古沙冬青强抗旱性的重要遗传基础。
乙烯作为一种胁迫应答激素和次级信号分子,在植物响应淹水、干旱和低温等逆境中起重要作用。目前对其生化合成和信号传递的分子机制已比较清楚,其中氨基环丙烷羧酸合成酶 (1-Aminocyclopropane-1-carboxylic acid/ACC synthase,ACS) 和氧化酶 (ACC Oxidase,ACO) 是乙烯生化合成中的两种关键酶[14]。在我们构建的文库中出现1个ACS和3个ACO (ACO1、ACO2和ACO3) 的同源基因,此外还有 1个乙烯超形成蛋白 (Ethylene-overproduction protein) 和2个乙烯 应 答 转 录 因 子 (Ethylene-responsive transcription factor,ERTF) 的编码序列,而很少有脱落酸 (Abscisic acid,ABA) 等其他胁迫应答激素合成与信号途径的相关基因,表明乙烯信号途径可能在蒙古沙冬青适应干旱等逆境中起重要作用。
金属硫蛋白MT是生物体内广泛存在的一类低分子量、富含半胱氨酸的金属结合蛋白,具有强抗热和抗蛋白酶消化等特性,在重金属解毒、胁迫应答和细胞增殖与凋亡等活动中有重要功能,特别是其清除活性氧自由基的能力很强,在抗辐射、抗氧化和抗衰老方面有特殊作用,已成为近年来的一个研究热点[15]。寒冷、高温和机械损伤等均可诱导MT基因表达及其蛋白的积累。将MT基因转入烟草可提高其抗氧化酶类的活性和耐盐性[16]。在我们构建的文库中共含有165个编码MT (以MT2为主) 和类MT基因的EST序列,这是全部Unigene中EST出现频率最高的一类。推测大量的MT可能有助于清除蒙古沙冬青在干热逆境下产生的活性氧自由基,从而减轻其对核酸等生物大分子和膜系统的损伤。由于MT具有强抗热和抗蛋白酶降解等特性,它们也可能作为一种抗干热保护剂而对细胞起直接的保护作用。
几丁质酶是一类糖苷酶,在植物中可分为Ⅰ~Ⅶ类。它们可催化水解真菌和细菌细胞壁的重要成分,从而起到抑制病原菌生长和增殖的作用。将几丁质酶基因转入植物可提高其抗病性。因此,普遍认为这类酶主要在植物抗病防卫反应中发挥功能[17-18]。然而近年来发现,几丁质酶在植物抵抗干旱、寒冷、高盐和紫外辐射等逆境中也起重要作用,有些几丁质酶行使抗冻蛋白的功能,有些则具有热稳定性[18-20]。在我们构建的文库中出现编码Ⅰ类、Ⅲ类和Ⅴ类几丁质酶及类几丁质蛋白的Unigene序列,其中仅Ⅲ类几丁质酶基因的EST就出现58次。这表明几丁质酶可能在蒙古沙冬青抵抗干旱和冷冻等逆境中起重要作用,推测在其抵抗生物和非生物逆境中可能存在某些共同的分子机制。
植物抗旱性是由多基因多途径调控的复杂性状,本文对部分抗逆相关基因的表达分析结果支持这一观点。我们认为在蒙古沙冬青抵抗干旱等逆境的分子机制中不可能仅包含上述基因和信号途径,在本文获得的Unigene中还有531条(占总数36.6%) 功能未知,这些新基因以及上述具有已知或推测功能的同源基因在抗旱性中的作用尚待进一步鉴定。在后续研究中我们将对文库进行表达谱分析,拟筛选和克隆一批候选抗逆基因进行功能验证。
[1] Castelli V, Aury JM, Jaillon O, et al. Whole genome sequence comparisons and “full-length” cDNA sequences: a combined approach to evaluate and improve Arabidopsis genome annotation. Genome Res, 2004, 14(3): 406−413.
[2] Seki M, Kamiya A, Carninci P, et al. Generation of full-length cDNA libraries: focus on plants. Methods Mol Biol, 2009, 533: 49−68.
[3] Dong HB, Guan RZ. Construction of seedling cDNA library of canola variety Huashuang 3 in Brassica napus. J Nanjing Agric Univ, 2005, 28(3): 123−125.董海滨, 管荣展. 双低油菜华双 3号幼苗全长cDNA文库的构建. 南京农业大学学报, 2005, 28(3): 123−125.
[4] Xu BY, Su W, Zhang JB, et al. The Construction of SMART cDNA library from banana fruit and the screening of Actin2 gene by using PCR method. J Trop Subtrop Bot, 2005, 13(5): 375−380.徐碧玉, 苏伟, 张建斌, 等. 香蕉果实 SMART cDNA文库的构建及利用 PCR方法筛选香蕉Actin2基因. 热带亚热带植物学报, 2005, 13(5): 375−380.
[5] Seki M, Narusaka M, Ishida J et al. Monitoring the expression profiles of 7000 Arabidopsis genes under drought, cold and high-salinity stresses using a full-length cDNA microarray. Plant J, 2002, 31, 279–292.
[6] Jia JP, Fu JJ, Zheng J, et al. Annotation and expression profile analysis of 2073 full-length cDNAs from stress-induced maize (Zea mays L.) seedlings. Plant J, 2006, 48(5): 710−727.
[7] Liu MQ, Lu CF, Yin WL. Research progress of biological characteristics and abiotic stress tolerant mechanisms of rare & endangered plant Ammopiptanthus. Chin J Appl Environ Biol, 2004, 10(3): 384−388.刘美芹, 卢存福, 尹伟伦. 珍稀濒危植物沙冬青生物学特性及抗逆性研究进展. 应用与环境生物学报, 2004, 10(3): 384−388.
[8] Lin QF, Wang MY, Liu JJ, et al. Research progress of cell and molecular biology of Ammopiptanthus. J Plant Genet Resou, 2010,11(6):793−797.林清芳,王茅雁,刘佳杰,等. 沙冬青细胞与分子生物学研究进展. 植物遗传资源学报, 2010,11(6):793−797.
[9] Chen YY. Expression of the cold-induced genes of Ammopiptanthus mongolicus in tobacco and the cold tolerance of the transgenetic plants[D]. Beijing: Beijing Forestry University, 2007.陈奕吟. 沙冬青低温诱导基因转化烟草及转基因植物的抗寒性研究[D]. 北京: 北京林业大学, 2007.
[10] Cao P, Song J, Zhou C, et al. Characterization of multiple cold induced genes from Ammopiptanthus mongolicus and functional analyses of gene AmEBP1. Plant Mol Biol, 2009, 69(5): 529−539.
[11] Guo JF, Sun GQ, Shen CJ, et al. Construction of Ammopiptanthus mongolicus cDNA library and the primary analysis of expressed sequence tags (EST). Acta Agric Boreali-Sin, 2007, 22(4): 37−41.郭久峰, 孙国琴, 沈传进, 等. 沙冬青 cDNA文库的构建和EST分析. 华北农学报, 2007, 22(4): 37−41.
[12] Lin QF, Wang CF, Zhao HH, et al. Study on the methods for total RNA extraction and mRNA isolation from Ammopiptanthus mongolicus. J Plant Genet Resou, 2011,12(3) : 460−463.林清芳,王存芳,赵欢欢,等. 蒙古沙冬青总RNA提取与mRNA 的分离研究. 植物遗传资源学报,2011,12(3) : 460−463.
[13] Xiong LM, Schumaker KS, Zhu JK. Cell signaling during cold, drought, and salt stress. Plant Cell, 2002, 14: S165–S183.
[14] Rzewuski G, Sauter M. Ethylene biosynthesis and signaling in rice. Plant Sci, 2008, 175(12): 32−42.
[15] Hassinen VH, Tervahauta AI, Schat H, et al. Plant metallothioneins-metal chelators with ROS scavenging activity?Plant Biol, 2011, 13(2): 225−232.
[16] Zhou BR, Wang L, Wu LL, et al. Characterization of transgenic tobacco overexpressing metallothionein gene (MT1) on NaCl stress. Acta Ecol Sin, 2010, 30(15): 4103−4108.周博如, 王雷, 吴丽丽, 等. 转金属硫蛋白基因(MT1)烟草耐 NaCl 胁迫能力. 生态学报, 2010, 30(15): 4103−4108.
[17] Xu FH, Fan CM, He YQ. Chitinases in Oryza sativa ssp. japonica and Arabidopsis thaliana. J Genet Genomics, 2007, 34(2): 138−150.
[18] Chen AK, Zhuang WS, Chen DM. Advances in the research on genetic engineering of plant chitinase. J Guangdong Educ Inst, 2010, 30(3): 47−53.陈爱葵, 庄文宋, 陈冬梅. 植物几丁质酶及其基因工程研究进展. 广东教育学院学报, 2010, 30(3): 47−53.
[19] Yeh S, Moffatt BA, Griffith M, et al. Chitinase genes responsive to cold encode antifreeze proteins in winter cereals. Plant Physiol, 2000, 124:1251–1264.
[20] Wang J, Xu ZQ. Cloning and inducible expression of a class Ⅰ chitinase gene FaChit1 from Festuca arundinacea. Acta Bot Bor-Occid Sin, 2010, 30(5): 869−875.王健, 徐子勤. 高羊茅FaChit1基因cDNA克隆及诱导表达. 西北植物学报, 2010, 30(5): 869−875.