重组鱼腥藻脂肪氧合酶基因的克隆表达、分离纯化及活性分析
2012-02-26张充周孝伟吕凤霞别小妹陶婷婷应琦陆兆新
张充,周孝伟,吕凤霞,别小妹,陶婷婷,应琦,陆兆新
南京农业大学食品科技学院 酶工程研究室,江苏 南京 210095
脂肪氧合酶 (Lipoxygenase,LOX) 是一种含非血红素铁的蛋白,催化具有顺,顺-1,4-戊二烯结构的多元不饱和脂肪酸的双加氧反应,如亚油酸、亚麻酸。脂肪氧合酶广泛存在于植物、动物[1-2]中,在微生物中鲜有发现。LOX在食品加工中具有重要的应用价值。在面粉加工过程中可催化分子氧对面粉中的具有戊二烯1,4双键的油脂发生氧化,形成的不稳定的氢过氧化物能诱导面筋蛋白质分子聚合,从而起到增强面筋的作用,可以减少或替代强筋剂溴酸钾的使用[3]。欧美等国家在90年代就有添加大豆粉改善面粉品质的专利出现[4];同时,近年来,生物合成法外源催化合成风味物质成为一条经济可行的路线,逐渐被重视,而LOX可以催化生产天然清香味化合物,可以满足人们对绿色风味物质的追求。
尽管人们早已认识到LOX在食品加工中的潜在应用价值,且LOX在自然界中广泛存在,但从自然界中直接获得不仅得率低而且纯化难,获得LOX纯酶的成本很高;而使用富含LOX酶的植物材料,如大豆粉,则存在成分复杂、反应不易控制的缺陷,上述原因限制了脂肪氧合酶在食品、化工等领域中的广泛应用。
通过LOX基因的克隆与表达,经简单的纯化过程,获得高纯度的LOX酶是解决上述问题的极好策略。Casey等[5]提出,重组脂肪氧合酶将成为食品加工领域研究中的前沿。然而,至今为止,还未曾有高效表达脂肪氧合酶的报道[6]。究其原因,一是脂肪氧合酶基因多数来源于真核生物,在原核生物中极少发现,这些基因在原核中 (如大肠杆菌) 表达存在稀有密码子问题,在真核中 (如酵母) 表达存在糖基化问题;二是LOX基因过长 (2 500~3 000 bp),也是制约高效表达的一个重要因素。为此,本研究在数据库中搜索到原核生物鱼腥藻PCC 7120基因组中LOX基因以双功能酶形式存在,利用逐步缩短策略克隆得到其最短的功能基因,进行了定点突变研究,在大肠杆菌中实现高表达,并对重组酶进行了分离纯化和性质研究,为该酶在食品加工中的应用奠定了基础。
1 材料与方法
1.1 材料
Anabaena sp. PCC 7120菌株购自中国科学院水生生物研究所,Escherichia coli DH5α (△Lac U169 (Φ80 Lac Z △M15) 克隆宿主、E. coli BL21 (DE3) pLysS (F-ompT hsdSB(rB -mB-) gal dcm (DE3) pLysS Camr) 为本实验室保藏。Escherichia coli表达载体 pET-23a、pET-32a购自Novagen公司,pGS21a购自南京金斯特公司。
限制性内切酶XhoⅠ、SacⅠ、氨苄青霉素、DNA凝胶回收试剂盒、基因组提取试剂盒、DNA marker、琼脂糖、IPTG购自上海生工生物工程公司。pfu DNA聚合酶、T4 DNA连接酶购自大连宝生物公司;亚油酸购自Sigma公司;其他试剂为国产分析纯。
LB培养基:胰蛋白胨10 g,酵母提取物5 g,NaCl 10 g。加水溶解后,用5 mol/L NaOH将pH调到7.0。加水定容到1 000 mL。配制固体培养基时,按每100 mL加入琼脂粉1.5 g。
重组大肠杆菌的表达培养基:配制20%葡萄糖,0.075 MPa灭菌20 min,添加至上述LB中,终浓度为0.2%。
1.2 方法
1.2.1 Anabaena sp. PCC 7120脂肪氧合酶基因的搜索
NCBI数据库 (http://www.ncbi.nlm.nih.gov/)中输入“lipoxygenase”对数据库内的所有基因组信息进行检索;使用Clustalx软件进行序列比对分析;使用 http://www.ncbi.nlm.nih.gov/blast和http://pfam.sanger.ac.uk网站进行功能预测。
1.2.2 ana-LOX基因的定点突变
运用重叠延伸PCR (over-lap extension PCR,SOE-PCR) 技术[7],设计2个PCR反应以产生2个含突变位点的DNA片段,分别用引物L-F、L-R和R-F、R-R扩增含有突变位点的上游片段L和下游片段R,随后将上述两个PCR产物混合,二者通过末端互补区结合并在适宜的温度下互为引物延伸得到完整的含突变的基因。突变位点选择是根据序列分析预测出活性位点,分别为His197、His202、His369、Asn373和 Ile455,并且随机选择了His364、Asn419和Ile326作为活性中心位点的佐证。表1为ana-LOX基因定点突变引物及突变方向。
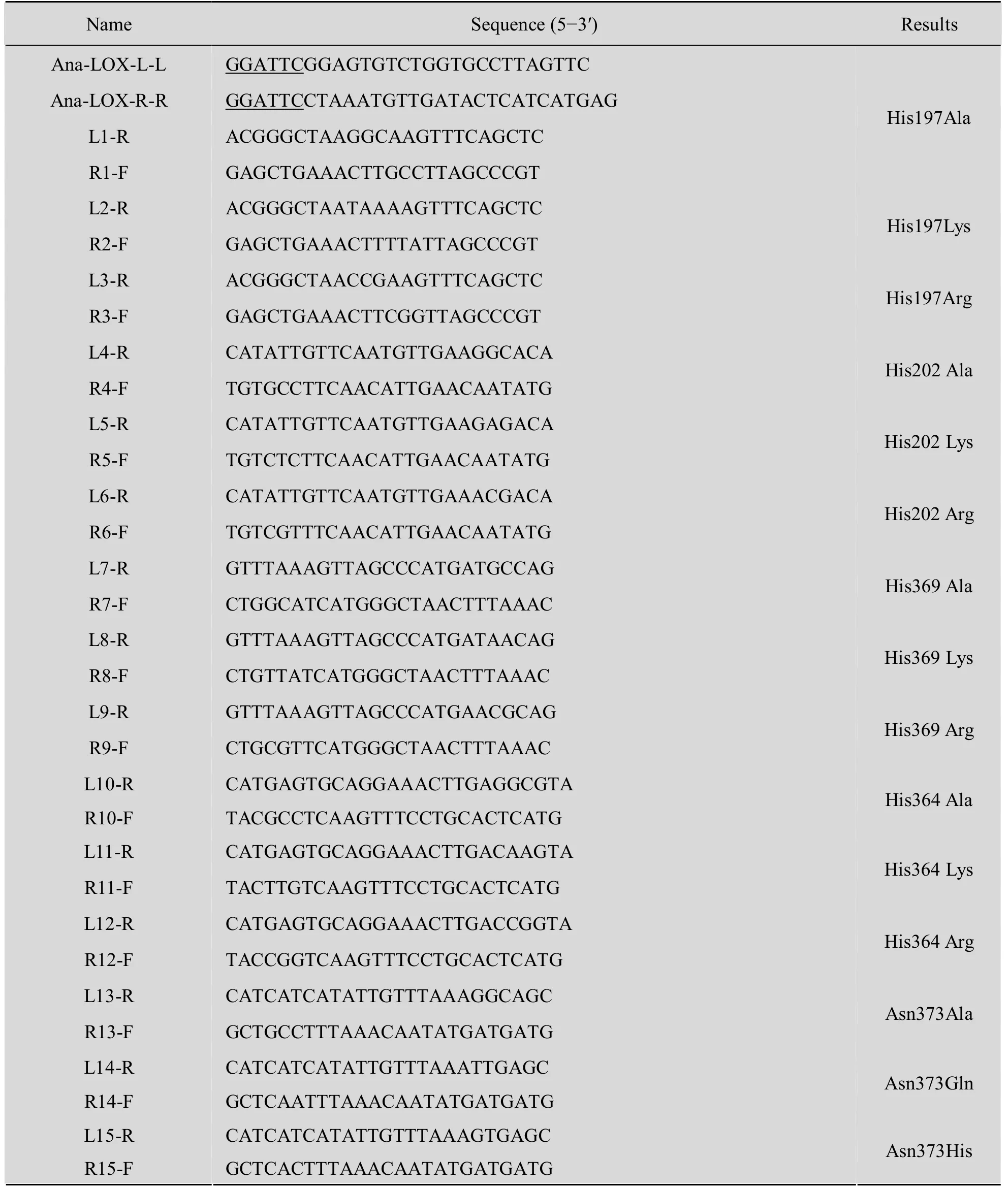
表1 定点突变用引物Table 1 Synthetic primers for site-direct mutation

?
1.2.3 Anabaena sp. PCC 7120脂肪氧合酶功能基因的克隆
参考GenBank中Anabaena sp. PCC 7120基因组序列[8](Accession No. NC_003267),利用DNAMAN软件设计只编码脂肪氧合酶功能序列的引物。
Ana-LOX含有 5个保守活性位点,只有 5个活性位点均存在才具有活性。因此,将当N端边缘氨基酸为保守残基时的基因长度设定为最短基因长度,将已经证明具有活性的ana-LOX基因长度设定为最长基因长度。采用分别截取,逐步测定基因活性,最终精确到一个三联体长度的差别,方案如图1所示。表2为鉴定ana-LOX基因功能基因长度的引物。
1.2.4 大肠杆菌ana-LOX基因重组表达载体的构建
凝胶回收的 PCR产物以及表达载体pET-23a、pET-32a和 pGS21a-ana-LOX分别用BamHⅠ酶切处理,再分别凝胶回收纯化,用T4 DNA连接酶置于16 ℃连接过夜后,全部转化大肠杆菌DH5α感受态细胞。涂布于含有氨苄青霉素的LB平板,倒置,37 ℃培养过夜。挑取单菌落于10 mL LB液体培养基,37 ℃、200 r/min振荡10 h,小量提取质粒。电泳鉴定重组子。送上海生工生物工程有限公司测序。获得重组表达载体 pET-23a-ana-LOX、 pET-32a-ana-LOX、pGS21a-ana-LOX。

图1 逐步缩短基因长度策略Fig. 1 Strategy for shortening the ana-LOX gene.

表2 Ana-LOX基因缩短用引物Table 2 Synthetic primers for shortening ana-LOX gene
1.2.5 目的基因在大肠杆菌中的诱导表达
分别挑取含有重组表达载体 pET-23aana-LOX、pET-32a-ana-LOX、pGS21a-ana-LOX的重组菌和对照菌E. coli BL-21 (DE3) 以及含空载体的对照菌体,接种于含有100 mg/L氨苄青霉素的液体 LB培养基中,37 ℃、180 r/min培养14 h。再分别取8 mL种子液到500 mL 三角瓶中,加入100 mL上述LB培养基液体培养基,37 ℃、180 r/min 培养至OD600为0.6左右,加IPTG至100 mg/L,37 ℃、180 r/min诱导5 h或者低温16 ℃诱导15 h,4℃、10 000×g离心5 min,收集菌体。
1.2.6 SDS-PAGE分析
SDS-PAGE电泳参照 Lorenzi等[1]报道的方法进行,浓缩胶浓度为5%,分离胶浓度为10%,胶厚 1.0 mm。电泳完毕后,取出凝胶,固定、考马斯亮蓝R-250染色、脱色后观察并拍照。
1.2.7 重组脂肪氧合酶的分离纯化
将诱导表达收集到的菌体,用磷酸缓冲液(50 mmol/L PBS+0.3 mol/L NaCl+0.5% Triton X-100) 重悬菌体,超声波破碎菌体 (400 W,超声5 s,间歇10 s,共超声15 min),4 ℃、10 000×g离心10 min,收集上清液作为粗酶液。
将处理得到的粗酶液按照 Ni-NTA His Tag Kit说明书依次用含不同浓度咪唑 (50 mmol/L、100 mmol/L、150 mmol/L、200 mmol/L) 的洗脱液洗脱Ni-NTA柱,收集洗脱峰,测定脂肪氧合酶活性。
1.2.8 酶活力测定
脂肪氧合酶活性分析用亚油酸钠作为底物。酶反应体系中含有:pH 6.0的磷酸缓冲液2.79 mL,酶液10 µL,亚油酸钠200 µL,混匀后放入35 ℃水浴中并开始计时,反应3 min后测定吸光度[9]。酶活单位定义:在上述条件下以1 min内3 mL反应体系在234 nm的吸光度增加0.001作为一个酶活力单位U[10]。
1.2.9 重组脂肪氧合酶酶学性质的研究
重组脂肪氧合酶的最适反应温度:将缓冲液分别在20 ℃、25 ℃、30 ℃、35 ℃、40 ℃、45 ℃、50 ℃、55 ℃水浴中保温10 min,加入10 µL待测酶液,在不同温度下反应3 min,在234 nm下测定吸光值,以不加酶的溶液作对照。以温度为横坐标,酶活力为纵坐标作图,得到该酶的最适反应温度。
重组脂肪氧合酶的热稳定性:将待测酶液(溶在0.2 mol/L pH 6.0 PBS缓冲液中) 分别在20 ℃、30 ℃、40 ℃、50 ℃水浴中保温1 h,每隔10 min取出一组样品,迅速置于冰水中,待保温结束后统一进行酶活力测定,以未处理酶液作为对照。以温度为横坐标,酶活力为纵坐标,得到温度对酶活力的影响曲线。
重组脂肪氧合酶的最适pH值:以亚油酸钠为底物,在pH分别为3.0、3.5、4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0的缓冲液中,按酶活力测定方法中所述,进行酶活测定。
重组脂肪氧合酶的pH稳定性:将重组脂肪氧合酶在不同pH值的缓冲液中,30 ℃保温1 h,测定剩余的酶活力。
重组金属离子对酶活性影响:将各种金属离子与酶液混合,使其最终浓度达到10 mmol/L,然后在30 ℃下测定酶活,均以不加金属离子的酶液为空白对照组,以未处理的酶液的酶活为100%。
2 结果与分析
2.1 Anabaena sp. PCC 7120脂肪氧合酶基因的序列分析
在 NCBI数据库 (http://www.ncbi.nlm.nih. gov/) 中搜索到了Anabaena sp. PCC 7120脂肪氧合酶酶基因与丙二烯氧合酶以双功能酶(AOS-LOX,NC_003267) 形式存在,LOX活性中心位于双功能酶C端。将AOS-LOX的C端覆盖 LOX活性位点的 455氨基酸输入http://www.ncbi.nlm.nih.gov/blast网站,发现该段序列属于脂肪氧合酶家族。将该段455氨基酸序列输入http://pfam.sanger.ac.uk网站,分析该段序列的二级结构的保守模块,发现该段序列中含有脂肪氧合酶保守功能模块。将该段序列与其他来源的LOX进行氨基酸序列比对[11-14],找到了LOX活性中心定位铁离子的5个保守氨基酸残基位点分别为His197、His202、His369、Asn373和Ile455。
2.2 Ana-LOX基因的克隆及其在大肠杆菌中的诱导表达
参考GenBank中Anabaena sp. PCC 7120基因组序列 (Accession No. NC_003267),利用DNAMAN软件设计了扩增双功能酶C端455氨基酸残基基因序列 (1 368 bp) 的引物:上游引物:5′-CGCGA GCTCGGAGTGTCTGGTGCC-3′;下游引物:5′-CCGCTCGAGCTAAATGTTGATA CTCATCAT-3′。PCR扩增产物经琼脂糖凝胶电泳后,可见1 368 bp处的片段。以构建的重组质粒 pET-23a- ana-LOX、pET-32a-ana-LOX、pGS21a-ana-LOX进行 BamHⅠ酶切后琼脂糖凝胶电泳鉴定,结果得到长约1 368 bp的片段,酶切结果与预期目标一致。测序结果与 GenBank公布的序列一致,证实重组质粒构建成功。
将3个重组表达载体转化E. coli BL21 (DE3) pLysS表达宿主菌,筛选获得的重组子通过IPTG的诱导作用,均获得了ana-LOX的活性表达,酶活测定结果如图 2所示。其中 pET-32aana-LOX的活性表达最高,并且16 ℃低温条件下诱导表达获得的酶活性均高于30 ℃条件下的表达结果。
因此,选取了带有分子伴侣 Trx的pET-32a-ana-LOX的重组表达载体进行下一步研究。当IPTG浓度为1 g/L,诱导时间16 h,诱导时机 OD600为 0.8,诱导温度为 16 ℃的培养条件下,重组脂肪氧合酶活力可达(6 750±40) U/mL。

图2 Ana-LOX E. coli工程菌在16 ℃和30 ℃条件下诱导表达酶活测定Fig. 2 Production of active recombinant ana-LOX in recombinant E. coli at 16 °C and 30 °C condition.
2.3 Ana-LOX基因的定点突变
定点突变酶基因的克隆采用SOE-PCR的方法,各个突变基因与表达载体连接酶切验证并测序正确后,采用热激法将重组表达载体转化入E. coli BL21 (DE3) pLysS,酶活测定结果见表3。 His197、His202、His369、Asn373、Ile455位点的所有突变基因均无活性,而随机选择His364、Asn419、Asn326位点的所有突变基因均维持原有活性,证明His197、His202、His369、Asn373、Ile4555个氨基酸残基位点为ana-LOX活性中心的保守位点。
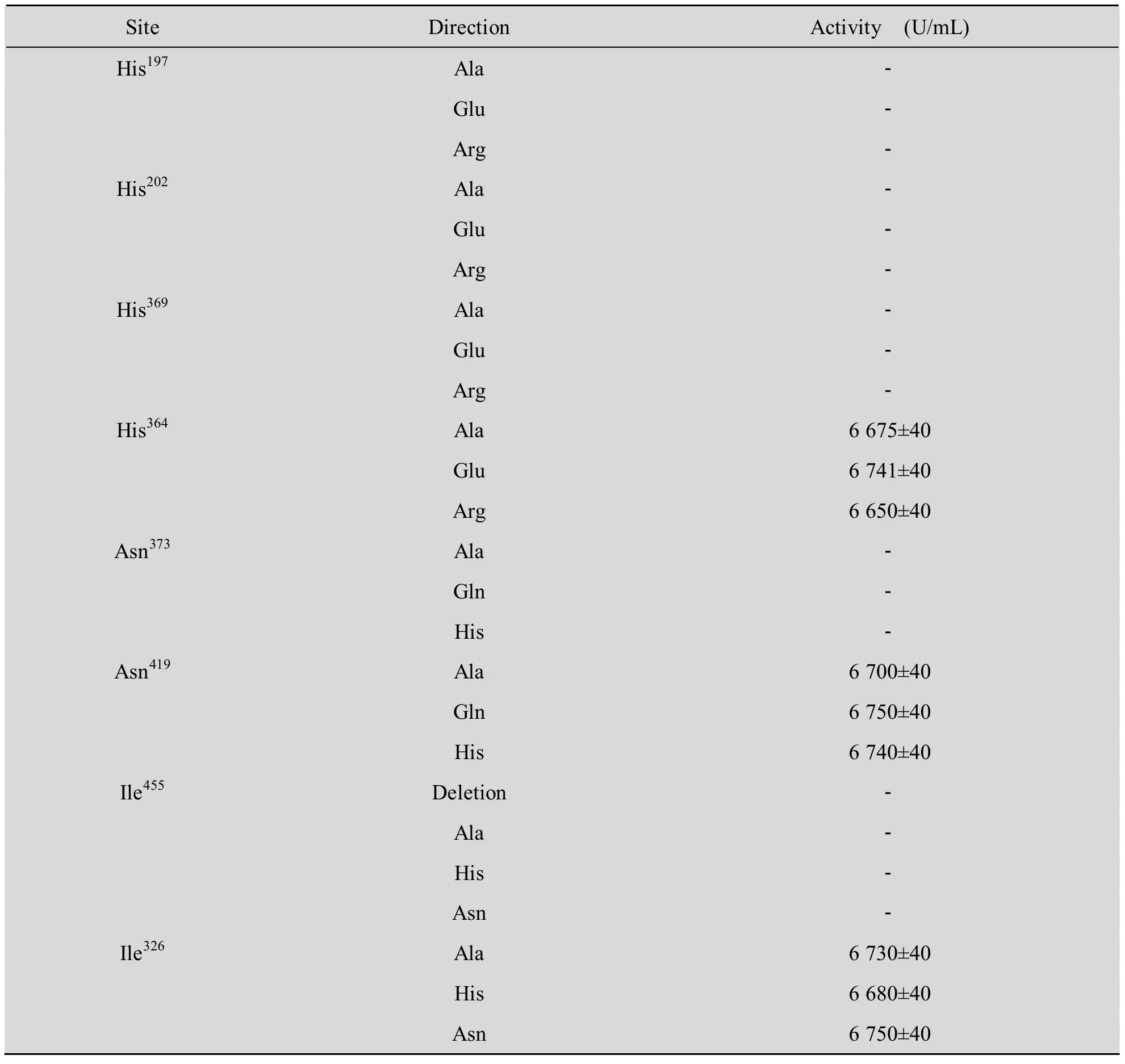
表3 定点突变基因活性测定Table 3 Activity of site-directed mutation
2.4 Ana-LOX功能基因的长度
不同长度的 ana-LOX基因与表达载体pET-32a连接,获得工程菌诱导发酵后,酶活结果见表4。1 368~1 254 bp长度的ana-LOX基因酶活基本一致,1 254~1 233 bp长度的ana-LOX基因酶活逐步开始降低,当ana-LOX基因长度缩短为 1 230 bp时,酶活完全丧失。因此,ana-LOX的最适基因片段长度为1 254 bp,重组脂肪氧合酶的分离纯化及性质研究选择均选择1 254 bp进行研究。
2.5 重组ana-LOX蛋白表达形式鉴定
分别取适量 pET-32a-ana-LOX工程菌及含空载体的对照菌体,诱导发酵超声波破碎菌并离心后,上清和沉淀进行SDS-PAGE电泳。结果如图3所示,重组蛋白全部以可溶性形式存在于细胞裂解物的上清中。
2.6 重组ana-LOX分离纯化
按照Ni-NTA His Tag Kit说明书,依次用含不同浓度咪唑 (50 mmol/L、100 mmol/L、150 mmol/L、200 mmol/L) 的洗脱液洗脱Ni-NTA柱,收集洗脱峰,测定脂肪氧合酶活性。结果如表 5所示,当咪唑为 150 mmol/L时,通过 Ni-NTA层析一步纯化,比活达到11.4×104U/mg蛋白,纯化倍数达到23倍,酶活回收率为 60.89%。如图 4所示,对纯化重组酶进行 SDS-PAGE检测,结果显示纯化效果较好。

表4 不同基因长度的ana-LOX活性测定Table 4 Activity of ana-LOX with different gene length

表5 Ni-NTA层析柱纯化重组蛋白Table 5 Purification of recombinant His6-ana-LOX
纯化后的融合蛋白在 SDS-PAGE中显示为一条带 (图 5)。泳道 1为重组的融合蛋白Trx-ana-LOX,用Bio-Rad Quantity One 4.6.2凝胶分析软件计算其分子量约为70 kDa左右,与理论值基本一致。
2.7 重组ana-LOX的性质研究
2.7.1 重组酶反应的最适pH
将纯化的重组酶在不同的pH条件下与底物反应后,测定各条件下的活力。不同pH值对重组脂肪氧合酶活力的影响。如图5所示,重组脂肪氧合酶反应的最适pH值为6.0。
2.7.2 重组酶反应的最适温度
将纯化的重组酶在不同的温度条件下与底物反应后,测定各条件下的活力。结果表明重组酶的最佳反应温度为45 ℃ (图6)。
2.7.3 重组酶的热稳定性
对重组ana-LOX的热稳定性进行了研究。如图7所示,在20 ℃条件下保温1 h,酶活降低到对照组的83%,30 ℃条件保温25 min,酶活降低为对照组的50%,40 ℃和50 ℃条件下酶的较易失活,保温10 min后酶活分别降低为对照组的50%和40%。

图3 SDS-PAGE鉴定重组蛋白的表达形式Fig. 3 SDS-PAGE analysis of the solubility of expressed protein. 1: the crude extracts from cells carrying pET-32a (control); 2: the supernatant of the disrupted cells carrying pET-32a-ana-LOX, recombinant Trx-ana-LOX is indicated by arrowhead; 3: inclusion bodies of cells carrying pET-32a-ana-LOX; M: protein marker.

图4 纯化后重组ana-LOX SDS-PAGE电泳Fig. 4 SDS-PAGE analysis of purified recombinant ana-LOX.
2.7.4 金属离子对重组酶活性的影响
金属离子对酶活的影响见表 6。其中 Fe2+对重组ana-LOX具有强烈的激活作用,与对照组相比,能提高到 181.91%,Fe3+和 Cu2+对重组 ana-LOX有强烈的抑制作用,能完全抑制ana-LOX活性。Mg2+和Ca2+对重组ana-LOX具有一定激活作用;Na+、Zn2+和 Mn2+对重组ana-LOX具有一定的抑制作用。

图5 pH对重组酶的活力的影响Fig. 5 Effect of pH on recombinant ana-LOX activity.

图6 温度对重组酶活力的影响Fig. 6 Effect of temperature on recombinant ana-LOX activity.

图7 Ana-LOX热稳定性Fig. 7 Thermal stability of recombinant ana-LOX.
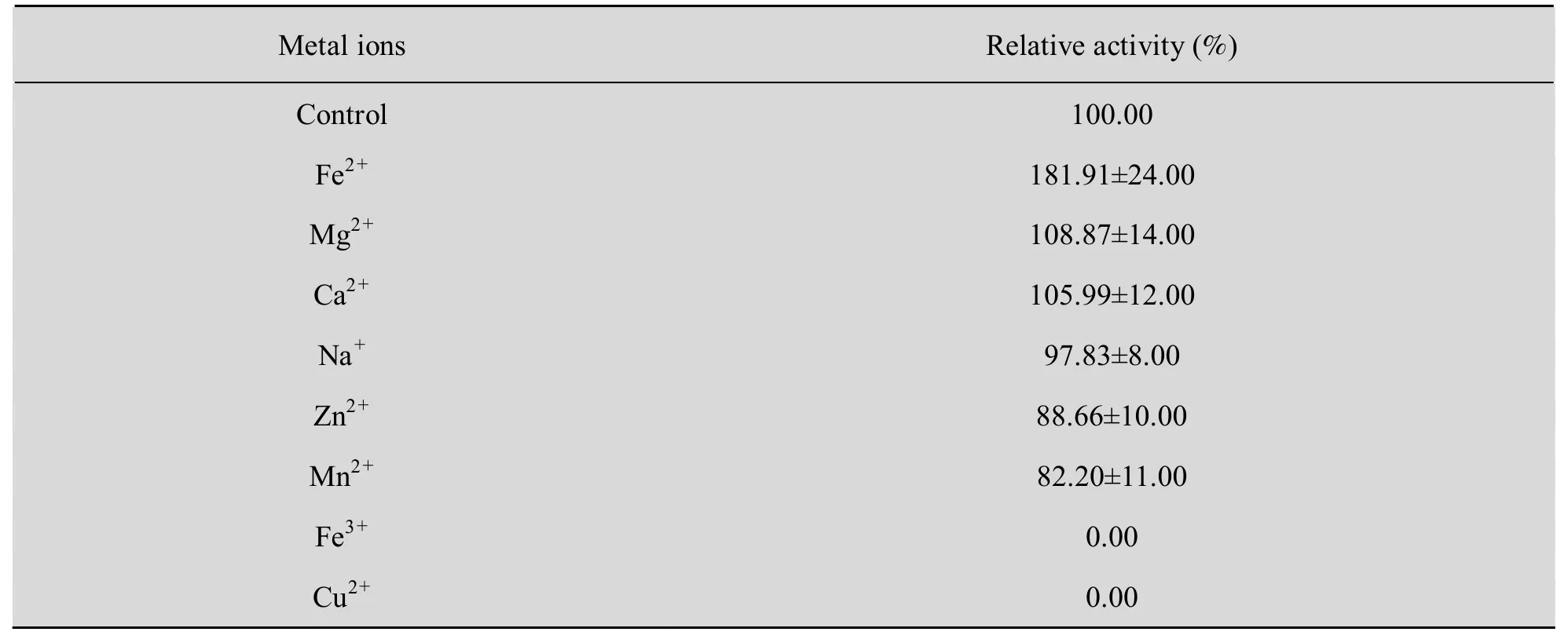
表6 金属离子对重组ana-LOX活性的影响Table 6 Effect of metal ions (10 mmol/L) on recombinant ana-LOX
2.8 重组Ana-LOX对面团微观结构的影响
图8分别为对照面团 (A)、每克面粉添加80 U (80 U/g) 重组 Ana-LOX处理的面团 (B)和每克面粉添加添加50 μg KBrO3(50 μg/g) (C)处理的面团在500倍放大倍数下的SEM显微结构图片。结果表明,与对照组比较 (A),经重组Ana-LOX处理后的面团结构的变化明显,可以清晰地看到少量丝状结构变成完整的网状结构,而淀粉颗粒则存在于交错的面筋网络之间 (B),与KBrO3处理所得结果基本相似 (C)。重组Ana-LOX在改善面团结构方面表现出了良好的效果,有待进一步研究。

图8 面团的SEM显微结构图Fig.8 SEM results of the dough with no enzyme treatment. (A) Control. (B) With 80 U/g dough ana-LOX treated. (C) With 50 μg/g dough KBrO3 treated.
3 讨论
关于脂肪氧合酶的异源表达早有学者开始研究。分别对氰细菌、水稻、大豆等多种[6,12-15]来源的LOX基因在大肠杆菌中进行了异源表达研究,但活性表达量都很低。LOX基因至今表达量不高主要由于多数来源于真核生物,异源表达过程中存在基因长度过长、稀有密码子以及翻译后加工修饰等问题。因此,寻找新型原核来源的LOX基因,对于开发LOX成为新型食品添加剂具有重要的意义。
本研究通过在 NCBI数据库中搜索,发现Anabaena sp. PCC 7120基因组中含有LOX基因,以双功能酶形式存在。通过氨基酸序列比对和活性位点的推测发现LOX活性中心为双功能酶的C端,并从C端扩增了一段只包含脂肪氧合酶活性中心的基因 (ana-LOX)。虽然与其他来源的LOX同源性很低 (表7),但是,保守区、二级结构域以及三维结构预测均发现扩增得到的ana-LOX基因属于LOX家族。由于ana-LOX基因具有原核来源、基因长度 (1 368 bp) 比其他来源的基因小许多,因此,具有实现LOX高效异源表达的潜力。
本研究结果表明,扩增的ana-LOX在E. coli中获得了活性表达,酶活达到 6 750 U/mL。Ana-LOX基因在不同的表达载体表现出不同的酶活产量,表明分子伴侣能够影响重组ana-LOX的活性表达量,分子伴侣Trx优于GST。低温发酵能够避免包涵体的形成[16],在16 ℃条件下,重组ana-LOX全部以可溶性形式出现,该结果属首次报道。通过Ni柱一步纯化过程,获得了电泳纯的重组蛋白条带,对重组ana-LOX酶学性质进行了研究的。金属离子能够影响酶活性,Fe2+能够显著提高重组ana-LOX酶活,而Cu2+和Fe3+能够完全抑制重组ana-LOX酶活。我们分析金属离子的氧化性质影响到重组ana-LOX Fe原子的价态变化从而影响到酶活。
大豆 LOX-1的空间结构已被解析,活性保守位点即Fe3+定位残基为His499、His504、His690、Asn694和 Ile839[13]。通过序列比对和空间结构模拟,我们预测到ana-LOX的保守位点为His197、His202、His369、Asn373和Ile455。LOX的氧化活性是通过的 Fe3+价态的变换实现的[15],因此定位Fe3+的氨基酸残基会通过电子间的竞争影响LOX的活性。为了提高LOX的活性,采用定点突变技术进行了定向进化研究。然而通过将保守位点分别突变为中性、碱性、酸性氨基酸,获得的突变基因在E. coli均为无活性表达。Mirela等在研究Mn脂肪氧合酶过程中,定点突变后发现突变基因表达出的重组酶丧失了活性,进一步研究发现突变重组酶检测不到 Mn离子[17]。因此,推测ana-LOX保守位点的突变也同样导致了Fe3+无法定位。通过大量的定点突变,没有得到活性提高的突变基因,但是,该结果证明了ana-LOX保守氨基酸位点确实与预测的一致。为了对该结论加以佐证,我们随机选择了其他位点的相同氨基酸进行突变,突变基因表达出的重组ana-LOX均具有活性。今后的工作可以在此基础上,对活性中心位点周边的残基进行突变,以期获得性能改良的突变酶。

表7 ana-LOX与其他来源LOX序列同源性Table 7 Identity of ana-LOX to other resource of LOX
通过信息学分析,以及定点突变研究,位于ana-LOX C末端的Ile是活性中心不可缺少的氨基酸残基。同理,我们考虑ana-LOX N端也应该存在一个过渡区域,决定了ana-LOX基因的最短长度。通过从ana-LOX基因5¢端逐步缩短基因长度,首次发现ana-LOX基因长度存在一个过渡区域,即当基因长度长于1 254 bp时,表达的重组LOX活性处于同一水平,当基因长度缩短为1 254 bp时,重组酶活逐步降低,至1 230 bp时,酶活消失。我们分析 C端的氨基酸在维持重组ana-LOX空间结构的稳定性发挥一定作用。当维持空间结构起主要作用的残基消失,活性结构处于不稳定状态,或者无法形成活性结构。
对不同来源的脂肪氧合酶的性质,国内外学者也有不少报道。Danield等[18]以酪梨为材料分离纯化LOX,发现其最适反应pH为6.5,最适反应温度为 40 ℃;Jin等[19]的研究结果表明,豌豆种子的最适反应pH为9.0,最适反应温度为39 ℃;陈书婷等[20]对大豆LOX进行了研究,发现其最适反应pH为9.0,在低温下 (低于40 ℃)保持较高酶活性。本研究中表达的重组ana-LOX最适反应pH为6.0,表明为一种偏酸性酶;最适反应温度为45 ℃,高于其他来源的LOX,有利于在实际生产加工过程中的应用。
本研究实现了ana-LOX的高效表达,显示出ana-LOX基因在食品酶制剂中的巨大应用潜力。但是作为宿主的E. coli属于致病菌,属于胞内表达,获得重组蛋白必须经过破壁,且需要严格的纯化过程以除去致病物质才能应用于人体。而对于附加值较低的食品添加剂用酶,高额的纯化成本必然会限制其应用。因此,需要寻找安全的表达系统,实现胞外分泌表达。有关ana-LOX食品级表达系统的构建是我们进一步研究的重点方向。
[1] Lorenzi V, Maury J, Casanova J, et al. Purification, product characterization and kinetic properties of lipoxygenase from olive fruit (Olea europaea L.). Plant Physiol Biochem, 2006, 44(7/9): 450−454.
[2] Kuo JM, Hwang A, Yeh DB, et al. Lipoxygenase from banana leaf: purification and characterization of an enzyme that catalyzes linoleic acid oxygenation at the 9-position. J Agric Food Chem, 2006, 54(8): 3151−3156.
[3] Zhang SW, Li D. Improve wheat flour quality by biological technology. J Chin Cereals Oils Assoc, 2002, 17(1): 16−21.张守文, 李丹. 应用混合酶制剂进行面粉品质改良的基础研究. 中国粮油学报, 2002, 17(1): 16−21.
[4] Addo K, Burton D, Stuart MR, et al. Soybean flour lipoxygenase isozyme mutant effects on bread dough volatiles. J Food Sci, 2006, 3(58): 583−585. [5] Casey R, West SI, Hardy D, Robinson DS, et al. New frontiers in food enzymology: recombinant lipoxygenases. Trends Food Sci Tech, 1999, 10(9): 297−302.
[6] Koeduka T, Kajiwara T, Matsui K. Cloning of lipoxygenase genes from a cyanobacterium, Nostoc punctiforme, and its expression in Eschelichia coli. Curr Microbiol, 2007, 54(4): 315−319.
[7] Nakamura A, Takakura Y, Kobayashi H, et al. In vivo directed evolution for thermostabilization of Escherichia coli hygromycin B phosphotransferase and the use of the gene as a selection marker in the host-vector system of Thermus thermophilus. J Biosci Bioeng, 2005, 100(2): 158−163.
[8] Kaneko T, Nakamura Y, Wolk CP, et al. Complete genomic sequence of the filamentous nitrogenfixing cyanobacterium Anabaena sp. strain PCC 7120. DNA Res, 2001, 8(5): 205−213.
[9] Hou ML, Miao HR, Chen J, et al. Measurement of peanut seeds lipoxygenase activity. J Anhui Agric Sci, 2008, 36(32): 14033−14035.侯美玲, 苗华荣, 陈静, 等. 花生种子脂肪氧化酶的活性测定研究. 安徽农业科学, 2008, 36(32): 14033−14035.
[10] Szymanowska U, Jakubczyk A, Baraniak B, et al. Characterisation of lipoxygenase from pea seeds (Pisum sativum var. Telephone L.). Food Chem, 2009, 116(4): 906−910.
[11] Oldham ML, Brash AR, Newcomer ME. Insights from the X-ray crystal structure of coral 8R-lipoxygenase. J Biol Chem, 2005, 280(47): 39545−39552.
[12] Wang R, Shen WB, Liu LL, et al. A novel lipoxygenase gene from developing rice seeds confers dual position specificity and responds to wounding and insect attack. Plant Mol Bio, 2008, 66(4): 401−414.
[13] Meyer MP, Tomchick DR, Klinman JP. Enzyme structure and dynamics affect hydrogen tunneling: The impact of a remote side chain (I553) in soybean lipoxygenase-1. Proc Natl Acad Sci USA, 2008, 105(4): 1146−1151.
[14] Shin JH, Van K, Kim DH, et al. The lipoxygenase gene family: a genomic fossil of shared polyploidy between Glycine max and Medicago truncatula. BMC Plant Biol, 2008, 8(1): 133.
[15] Sellhorn GE, Youn B, Webb B, et al. Biochemical characterization, kinetic analysis and molecular modeling of recombinant vegetative lipoxygenases from soybean. Int J Bio, 2011, 3(1): 44−62.
[16] Fang JJ, Ewald D. Expression cloned cDNA for 10-deacetylbaccatin III-10-O-acetyltransferase in Escherichia coli: a comparative study of three fusion systems. Protein Expr Purif, 2004, 35(1): 17−24.
[17] Cristea M, Engström Å, Su C, et al. Expression of manganese lipoxygenase in Pichia pastoris and site-directed mutagenesis of putative metal ligands. Arch Biochem Biophy, 2005, 434(1): 201−211.
[18] Jacobo-Velázquez DA, Hernández-Brenes C, Cisneros-Zevallos L, et al. Partial purification and enzymatic characterization of avocado (Persea americana Mill, cv. Hass) lipoxygenase. Food Res Int, 2010, 43(4): 1079−1085.
[19] Jin GF, Zhang JH, Yu X, et al. Crude lipoxygenase from pig muscle: partial characterization and interactions of temperature, NaCl and pH on its activity. Meat Sci, 2011, 87(3): 257−263.
[20] Chen ST, Kong XZ, Hua YF, et al. Study on purification and some properties of soybean lipoxygenase. Sci Technol Food Ind, 2011(5): 176−182.陈书婷, 孔祥珍, 华欲飞, 等. 大豆脂肪氧合酶的分离纯化及其性质研究. 食品工业科技, 2011(5): 176−182.
