蜡样芽胞杆菌GXBC-3三个普鲁兰酶基因的表达及其酶学特性
2012-02-26李美蓉汪小波黄英黄坚丽梁甲元黄日波杜丽琴韦宇拓
李美蓉,汪小波,黄英,黄坚丽,梁甲元,黄日波,3,杜丽琴,韦宇拓
1 广西大学生命科学与技术学院,广西 南宁 530004
2 亚热带农业生物资源保护与利用国家重点实验室,广西 南宁 530004
3 广西科学院,广西 南宁 530004
普鲁兰酶 (Pullulanase) (EC3.2.1.41) 是能专一性分解普鲁兰糖 (Pullulan)、淀粉、支链淀粉和相应的低聚糖中侧支分支点的 α-l,6糖苷键的一种异淀粉酶 (或称枝切淀粉酶),能使支链淀粉型多糖的分支链脱离主链形成一系列链长不一的直链淀粉[1]。而最近发现的新普鲁兰酶兼有糖苷水解酶和糖基转移酶催化活性,能水解α-l,6-和α-l,4-糖苷键,是一种多功能水解淀粉酶[2],将该酶与淀粉酶、糖化酶等配合使用,能加速淀粉充分糖化,提高淀粉质原料利用率、降低粮耗,在淀粉加工、制糖工业及啤酒和酒精生成行业中有着重要的用途和良好的市场前景。目前国内普鲁兰酶研究仅限于实验室,所筛选获得的菌种的性能还远不能满足工业需求,国内外工业用普鲁兰酶市场长期被国外大公司所垄断,且价格昂贵,因此探索获得优良的新型普鲁兰酶基因,为实现普鲁兰酶国产化具有重要的意义。本研究从一株产中温中性普鲁兰酶的菌株 Bacillus cereus GXBC-3 中克隆获得了pulA、pulB和 pulC 3个普鲁兰酶基因,利用pSE380表达系统实现了其在大肠杆菌中的表达,研究分析了重组酶的性质,为该酶下一步研究应用奠定基础。
1 材料与方法
1.1 材料
1.1.1 主要试剂
限制性内切酶NcoⅠ、PstⅠ、EcoRⅠ、Prime STAR HS DNA聚合酶、T4 DNA连接酶等购自TaKaRa公司;金属镍亲和层析介质购自Phamacia公司;麦芽糖、麦芽三糖为色谱纯,其他试剂均为国产分析纯。
1.1.2 菌株和质粒
蜡样芽胞杆菌Bacillus cereus GXBC-3、宿主大肠杆菌Escherichia coli XL10-Gold 菌株和表达载体pSE380由本实验室保藏。
1.2 方法
1.2.1 普鲁兰酶基因的克隆
根据 GenBank数据库中已公布的 Bacillus cereus假定的Ⅰ型和Ⅱ型普鲁兰酶基因序列,并进行了信号肽预测,设计引物 (表1),以Bacillus cereus GXBC-3总DNA为模板,用Prime STAR HS DNA聚合酶进行PCR扩增目的基因,PCR退火温度45 ℃,延伸2 min 40 s。
1.2.2 重组质粒的构建及目的蛋白的表达和纯化
将目的基因连接到表达载体 pSE380上,经测序验证后,转化到E. coliXL10-Gold进行IPTG诱导表达,收集菌体在冰浴条件下超声波破胞,收集上清,使用金属镍亲和层析法进行纯化,利用 SDS-PAGE凝胶电泳来检测纯化效果。
1.2.3 酶活的测定
酶活性的测定采用 3,5-二硝基水杨酸(DNS) 试剂显色法[3],取500 μL不同浓度的葡萄糖溶液,加入500 μL DNS,沸水浴5 min。置于冰上冷却至室温后,稀释3倍,测可见光OD520值来绘制葡萄糖标准曲线。酶活的测定完全依据制作葡萄糖标准曲线的方法进行。酶的活力单位定义为在最适温度及最适pH条件下,按上述反应,每min生成1 μmol还原糖所需的酶量为一个酶活单位(1 U)。
1.2.4 重组酶含量及比活力测定
按照《蛋白质技术手册》中的Bradford测定方法[4]来计算蛋白质浓度。根据国际酶学委员会规定比活力=活力U/mg蛋白。
1.2.5 HPLC分析条件
色谱柱:lltima Amino 100A 5u柱 (4.6 mm× 250 mm);检测器:Alltech 2000ES型蒸发光散射检测器;流动相∶水相=65∶35;流速:1 mL/min;柱温:28 ℃。

表1 普鲁兰基因引物序列Table 1 Primer sequences of pullulanase genes
2 结果与分析
2.1 普鲁兰酶基因的克隆
取5 μL PCR产物进行琼脂糖凝胶电泳,结果如图1所示,泳道1、2、3分别为基因pulA (2 124 bp)、pulB (2 478 bp) 和pulC (2 484 bp)。在Signal IP和TMpred serve进行进行信号肽和疏水跨膜区预测,发现3个基因均无信号肽,为胞内分泌表达。

图1 琼脂糖凝胶电泳分析普鲁兰酶基因 PCR扩增产物Fig. 1 PCR product of pullulanases gene. M: W2003 DNA marker; 1: pulA; 2: pulB; 3: pulC.
2.2 普鲁兰酶基因的表达与纯化
将构建好的基因工程菌按 2%接种量于 LB (含100 mg/L的Amp) 中,37 ℃摇瓶培养至菌体浓度 OD600约 0.6,用终浓度为 0.5 mmol/L的IPTG于37 ℃摇床诱导表达10 h后,收集菌体、破胞、收集上清,用金属镍亲和层析法纯化目的蛋白,取 20 μL蛋白样品进行SDS-PAGE凝胶电泳。结果如图2所示,图中泳道 3、5、7分别表示为纯化重组普鲁兰酶PulA、PulB和 PulC,其蛋白表达量和相对分子量见表2。
2.3 重组酶酶学性质研究
2.3.1 重组酶底物特异性分析
用pH 7.0的磷酸盐缓冲液配制1%浓度的不同底物溶液与重组酶反应,测绘底物-相对酶活力的曲线,分析重组酶底物特异性。比较重组酶PulA、PulB和PulC对不同底物相对水解速度,可得3种酶的最适底物均为普鲁兰糖,经HPLC分析只产生麦芽三糖;重组酶PulA还可水解可溶性淀粉产生麦芽糖和麦芽三糖的混合物;而重组酶PulB和PulC不水解可溶性淀粉。综上可得,重组酶PulA能水解α-l,6-和α-l,4-糖苷键,为Ⅱ型普鲁兰酶;重组酶PulB和PulC只水解α-l,6-糖苷键,为Ⅰ型普鲁兰酶。

图2 纯化后的重组普鲁兰酶SDS-PAGE分析Fig. 2 SDS-PAGE analysis of the purified reconbinant pullulanases. M: standard protein maker; 1: reconbinant E. coli XL10-Goldcontaining pSE380; 2: reconbinant E. coli XL10-Gold containing pSE380-pulA; 3: recombinant pullulanase PulA purified on nickel column; 4: reconbinant E. coli XL10-Gold containing pSE380-pulB; 5: recombinant pullulanase PulB purified on nickel column; 6: reconbinant E. coli XL10-Gold containing pSE380-pulC; 7: recombinant pullulanase PulC purified on nickel column.
2.3.2 重组酶最适温度及热稳定性
取50 μL稀释酶液与450 μL 1%普鲁兰糖/可溶性淀粉溶液在15 ℃~70 ℃下每隔5 ℃反应10 min后测定酶活,以酶活最高者作为100%,绘制温度-酶活力的影响曲线。重组酶PulA的普鲁兰酶和淀粉酶 (Amy A) 最适温度分别为40 ℃、50 ℃,重组普鲁兰酶PulB和PulC的最适温度均为45 ℃ (图3)。
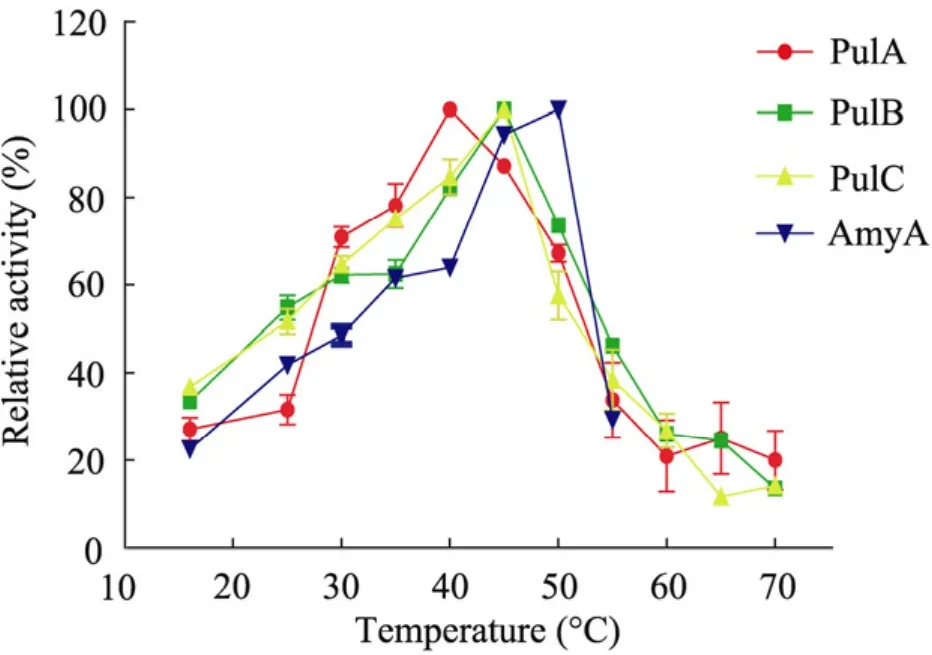
图3 重组酶的最适温度Fig. 3 Optimal temperature of recombinant enzymes.
在各温度梯度下,将稀释酶液分别保温处理30 min,于最适温度下反应10 min后测定残余酶活力,以未保温处理的酶活为100%,绘制温度-相对残余酶活力曲线。低于40 ℃时,3种重组酶相对残余活力均高于80%,热稳定性较好;高于40 ℃时,3种重组酶相对残余活力均急剧下降,热稳定性差 (图4)。
2.3.3 重组酶最适pH及pH稳定性
取50 μL稀释酶液与450 μL 1%的普鲁兰糖/可溶性淀粉溶液在pH 4.5~9.0内,每隔0.5个梯度,于最适温度反应10 min后测定酶活,以酶活最高者作为100%,绘制pH-酶活力的影响曲线。重组酶 PulA的普鲁兰酶和淀粉酶 (AmyA)最适pH分别为6.5、7.0,重组酶PulB和PulC的普鲁兰酶最适pH分别为7.0、6.5 (图5)。
用不同pH缓冲液稀释纯化重组酶,于4 ℃处理4 h,于最适条件下反应测定残余酶活力,以未经酸处理的酶活为100%,绘制pH-相对残余酶活力曲线。3种重组酶在pH 5.5~8.0范围内相对残余活力较高,pH稳定性较好,其中适度的pH条件对PulC有较弱激活作用 (图6)。

图4 重组酶的热稳定性Fig. 4 Thermal stability of recombinant enzymes.

图5 重组酶的最适pHFig. 5 Optimal pH of recombinant enzymes.
2.3.4 Ca2+对重组酶热稳定性的影响
将Ca2+终浓度分别为0~10 mmol/L的稀释酶液液于4 ℃处理12 h,于40 ℃保温30 min,在最适条件下反应后测绘 Ca2+浓度-相对酶活力曲线。在2~10 mmol/L范围内,Ca2+对重组酶PulA、PulC普鲁兰酶热稳定性有较明显抑制作用;在0~10 mmol/L范围内,Ca2+对重组酶PulA淀粉酶(AmyA) 与 PulB普鲁兰酶热稳定性有较明显激活作用,且分别在2、4 mmol/L时激活作用最强(图7)。

图7 Ca2+对重组酶热稳定性的影响Fig. 7 Effect of Ca2+ on thermal stability of recombinant enzymes.
2.3.5 EDTA对重组酶活性的影响
将EDTA终浓度分别为0~500 mmol/L的稀释酶液于4 ℃处理12 h,在最适条件下与底物反应后分别测绘EDTA浓度-相对酶活力曲线。在10~40 mmol/L内对重组酶PulA普鲁兰酶活性有较显著激活作用,且激活作用随EDTA浓度增大而减弱;在50~500 mmol/L内对重组酶PulA普鲁兰酶活性有较显著抑制作用,且抑制作用随其浓度增大而增强。在50~500 mmol/L内对重组酶PulB普鲁兰酶活性有较显著抑制作用,且抑制作用随其浓度增大而增强。在10~500 mmol/L内对重组酶 PulB普鲁兰酶活性有显著抑制作用,且抑制作用随浓度增大而增强。在10~500 mmol/L内对重组酶PulA淀粉酶 (AmyA) 活性有较显著抑制作用,且其抑制作用随浓度增大无明显改变(图8)。
2.3.6 金属离子对重组酶活性的影响
用终浓度为2 mmol/L的不同金属氯化物稀释酶液,于4 ℃处理12 h,在最适条件下与底物反应后分别测绘金属离子-相对酶活力曲线。Mg2+、Mn2+对重组酶PulA普鲁兰酶活性有显著激活作用,而Cu2+、Zn2+、Fe2+对其有显著抑制作用;Cu2+、Zn2+、Mg2+、Mn2+、Ba2+对重组酶PulB普鲁兰酶活性有显著激活作用,而 Fe2+对其有显著抑制作用;Zn2+、Mg2+、Mn2+、Ba2+对重组酶 PulC普鲁兰酶活性有显著激活作用,而Ca2+、Cu2+、Fe2+、Fe3+对其有显著抑制作用;Ca2+、Mg2+、Ba2+、 Fe3+对重组酶PulA淀粉酶(AmyA) 活性有显著激活作用,而Zn2+对其有微弱抑制作用 (图9)。
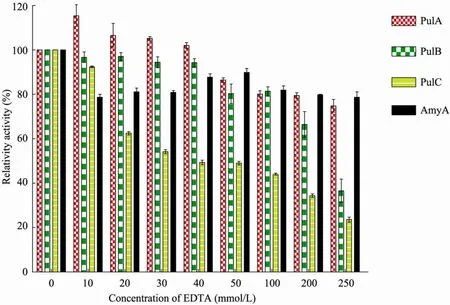
图8 EDTA对重组酶活性的影响Fig. 8 Effect of EDTA on recombinant enzyme activities.

图9 金属离子对重组酶活性的影响Fig. 9 Effect of metal ions on recombinant enzyme activities.
2.4 重组酶比活力及Km、Vmax测定
按照1.2.4方法测定各重组酶比活力。在最适条件下取不同浓度的普鲁兰糖/可溶性淀粉[S],测得反应速度V,计算出1/V与1/[S],通过Lineweaver-Burk双倒数作图法求得各重组酶对普鲁兰糖/可溶性淀粉的Km值和Vmax,结果见表2。
3 讨论
普鲁兰酶根据对底物的特异性一般可分为Ⅰ型和Ⅱ型普鲁兰酶,Ⅰ型普鲁兰酶又称脱支酶,特异性水解α-1,6-糖苷键,形成麦芽三糖和线性的以α-1,4-糖苷键连接的多聚物;Ⅱ型普鲁兰酶又称amylo-pullulanse,既能水解α-1,6-糖苷键,又能水解α-1,4-糖苷键。不同来源的普鲁兰酶的分子量有很大差异,从76~150 kDa不等;但它们都含有几个保守区,包括细菌普鲁兰酶相关区域、普鲁兰酶N-端区域及α-淀粉酶亚家族等,使之形成特定的空间结构以行使其水解功能[5]。本研究首次实现了在同一株Bacillus cereus GXBC-3中克隆并成功表达了3个、两种不同类型的普鲁兰酶基因pulA、pulB和pulC。其中pulA为Ⅱ型普鲁兰酶基因,其表达的酶PulA能同时水解α-l,6-和α-l,4-糖苷键,它可能与来源于环状芽胞杆菌Bacillus circulans F-2的Ⅱ型普鲁兰酶相似,其酶中心结构域含两个不同活性位点[6]。pulB和pulC为Ⅰ型普鲁兰酶基因,其表达的酶PulB和PulC只水解α-l,6-糖苷键。目前发现的大多数普鲁兰酶比活力较低,如比较来源其他Bacillus cereus的普鲁兰酶性质见表3[7-9],这些普鲁兰酶活力较低;其他如来源环状芽胞杆菌Bacillus circulans F-2[6]、 嗜 碱 芽 胞 杆 菌alkalophilic Bacillus sp. KSM-1378[10]和嗜热芽胞杆菌thermophilic Bacillus sp. AN-7[11]的Ⅱ型普鲁兰酶比活力分别为133.6 U/mg、83.1 U/mg和151.5 U/mg。而本研究中Ⅱ型普鲁兰酶 PulB和PulC的比活力均接近230 U/mg,明显优于其他同类研究中发现的Ⅱ型普鲁兰酶。
将3个普鲁兰酶在SMART serve进行功能结构域预测分析,发现其均隶属于淀粉酶13家族 (GH 13) 普鲁兰酶亚科,除含中心结构域Aamy外,均含一具脱枝功能的N端结构域pfmCBM-48;而普鲁兰酶PulB和PulC还含一普鲁兰糖-蛋白互作N端结构域Pfm PUD,具有普鲁兰糖绑定功能,与底物特异性有关。Martin Machovič和Štefan Janeček研究表明,最近新建立的GH13普鲁兰酶亚科CBMs家族同时具有α-淀粉酶、普鲁兰酶活性,或单具普鲁兰酶活性;而且所有这些酶均是多域蛋白质,至少具有一个代表酶的特异性的结构域[12]。推测在具有Aamy和pfm CBM-48而无pfm PUD时,普鲁兰酶不单只与普鲁兰糖绑定,水解 α-l,6-糖苷键;还可作用于可溶性淀粉,水解 α-l,4-糖苷键。而在同时具有Aamy、pfm CB M-48和pfm PUD时,普鲁兰酶只与普鲁兰糖绑定,水解α-l,6-糖苷键。另外普鲁兰酶 PulC还含有一个与酶热稳定性有关的C端结构域pfm Alpha-amyC。Kim等删除来源植物乳杆菌 Lacto-bacillus plantarum L137的amylo-pullulanase的结构域C,酶活力虽然减弱,但pH稳定性、热稳定性和对底物亲和力都明显增强[13]。而Lin等发现把来源嗜热厌氧乙醇杆菌Thermoanaerobacter ethanolicus 39E的普鲁兰酶C-端的100个氨基酸残基删除,酶的空间结构和酶活性没有变化[14]。所以不同普鲁兰酶的C端结构域的功能还不能确定,需要进一步研究。
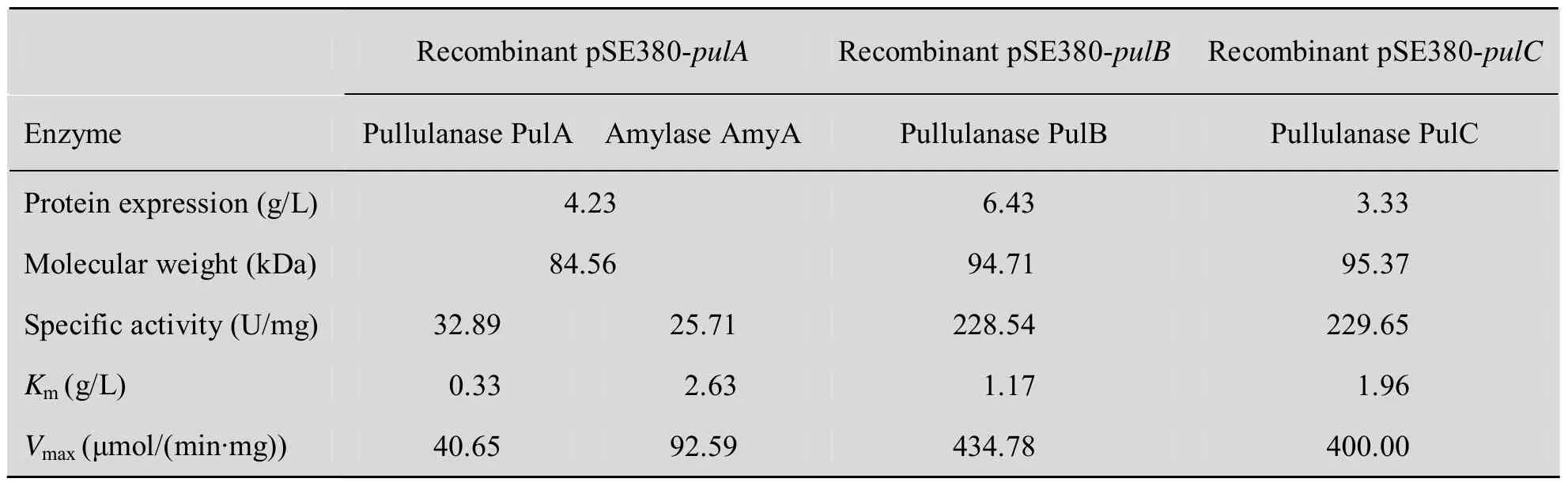
表2 重组酶活力测定Table 2 Activities of recombinant enzymes
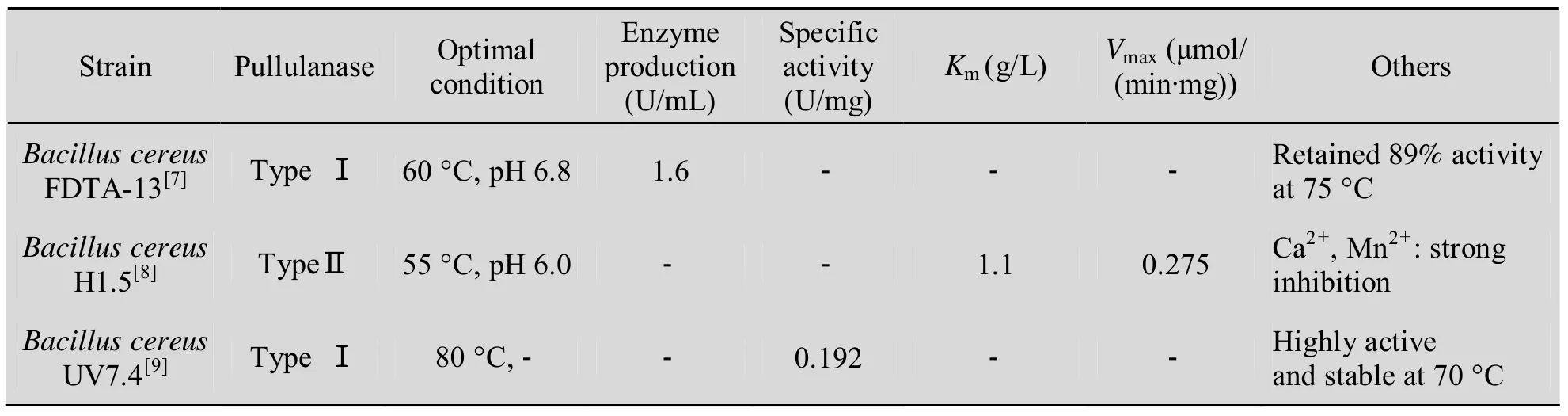
表3 其他Bacillus cereus的普鲁兰酶性质Table 3 Pullulanase properties from other Bacillus cereus
相信随着更多的Ⅰ、Ⅱ型普鲁兰酶的发现[15-16],和其分子结构和结构域功能的深入研究,就可以通过表达系统的优化和对普鲁兰酶进行分子改造,提高酶表达量,增强酶活力,改造酶的底物特异性和温度、pH耐受性,使酶学特性更适合工业应用。
[1] Saha B C, Zeikus J G. Novel highly thermostable pullulanase from thermophiles. Trends Biotechnol, 1989, 7(9): 234−239.
[2] Takata H, Kuriki T, Okada S, et al. Action of neopullulanase catalyzes both hydrolysis and transglycosylation at alpha-(1,4)-and alpha-(1,6)-glucosidic linkages. J Biol Chem, 1992, 267(26): 18447−18452.
[3] Yang H, Wang ZH, Pang KC, et al. Study on amylase activity of Bacillus spp. Mod Agri Sci Technol, 2007(2): 90–93.杨慧, 王振华, 潘康成, 等. 芽孢杆菌产淀粉酶活性的研究. 现代农业科技, 2007(2): 90−93.
[4] Wang JZ, Fang M. Handbook of Protein Technology. Beijing: Science Press, 2000: 42−47.汪家政, 范明. 蛋白质技术手册. 北京: 科学出版社, 2000: 42−47.
[5] Marchler-Bauer A, Anderson JB, Chitsaz F, et al. CDD: specific functional annotation with the Conserved Domain Database. Nucleic Acids Res, 2009, 37: D205−D210.
[6] Kim CH , Kim YS. Substrate specificity and detailed characterization of a bifunctional amylase-pullulanase enzyme from Bacillus circulans F-2 having two different active sites on one polypeptide. Eur J Biochem, 1995, 227(3): 687−693.
[7] Nair SU, Singhal RS, Kamat MY. Induction of pullulanase production in Bacillus cereus FDTA-13. Bioresour Technol, 2007, 98(4): 856−859.
[8] Ling HS, Ling TC, Mohamad R, et al. Characterization of pullulanase type Ⅱ from Bacillus cereus H1.5. Am J Biochem Biotechl, 2009, 5(4): 170−179.
[9] Bakshi A, Patnaik PR, Gupta JK. Thermostable pullulanase from a mesophilic Bacillus cereus isolate and its mutant UV7.4. Biotechl Lett, 1992, 14(8): 689−694.
[10] Ara, K, Saeki K, Igarashi K, et al. Purification and characterization of an alkaline amylo-pullulanase with both α-1, 4 and α-1, 6 hydrolytic activity from alkalophilic Bacillus sp. KSM-1378. Biochim Biophys Acta, 1995, 1243(3): 315−324.
[11] Kunamneni A, Singh S. Improved high thermal stability of pullulanase from a newly isolated thermophilic Bacillus sp. AN-7. Enzyme Microb Technol, 2006, 39(7): 1399−1404.
[12] Machovič M, Janeček S. Domain evolution in the GH13 pullulanase subfamily with focus on the carbohydrate-binding module family 48. Biologia, 2008, 63(6): 1057−1068.
[13] Kim JH, Sunako M, Ono H, et al. Characterization of the C-terminal truncated form of amylopullulanase from Lactobacillus plantarum L137. J Biosci Bioeng, 2009, 107(2): 124−129.
[14] Lin HY, Chuang HH, Lin FP. Biochemical characterization of engineered amylopullulanasefrom Thermoanaerobacter ethanolicus 39E-implicating the nonnecessity of its 100 C-terminal amino acid residues. Extremophiles, 2008, 12(5): 641−650.
[15] Ara K, Saeki K, Igarashi K, et al. Purification and characterization of an alkaline amylo-pullulanase with both α-1, 4 and α-1, 6 hydrolytic activity from alkalophilic Bacillus sp. KSM−1378. Biochim Biophy Acta, 1995, 12434(3): 315−324.
[16] Jiao Y L, Wang S J, Lji M S, et al. A GH57 family amylopullulanase from deep-sea Thermococcus siculi: expression of the gene and characterization of the recombinant enzyme. Curr Microbiol, 2011, 62(1): 222−228.
