孕中期羊水干细胞的生物学特性的研究
2012-02-24王欢欢刘松岩
常 颖,高 垚,李 欢,王欢欢,刘松岩*
(1.吉林大学中日联谊医院 神经内一科,吉林 长春 130033;2.长春市中心医院 神经内科,吉林 长春 130051)
近20年来,生命科学领域对干细胞的研究一直没有中断。胚胎干细胞由于既受伦理道德宗教的影响;又有导致畸胎瘤发生的风险,因此其研究遇到阻力[1]。神经干细胞的缺陷一是组织来源受限;二是中枢神经系统的微环境决定着移植细胞的分化方向[2],因此其基础及临床研究也受到限制。骨髓间充质干细胞(MSCs)取材容易,能迅速培养、增殖,便于自体移植,且遗传背景相对稳定,体内植入反应较弱,弥补了胚胎干细胞、神经干细胞的缺点[3],但成人骨髓源MSC的数量及其增殖分化潜能,会随着人的年龄增加而下降,且病毒感染率较高。由于采集骨髓MSC须对供者行骨髓穿刺术,因此其来源受到一定限制,难以产业化。因此羊水干细胞(amniotic fluid-derived stem cells,AFCs)做为一种新的干细胞来源,成为国内外研究的热点。本研究从人孕中期羊水(h AFC)中分离、提纯、扩增羊水干细胞,并分析其生物学特性。
1 材料与方法
1.1 主要器材与试剂 Amnio MAX-Ⅱ培养基,α-MEM(Gibco公司);胎牛血清、HEPES缓冲液(Hyclone公司);胰蛋白酶(Sigma公司);荧光素标记小鼠抗人CD44、CD45抗体;倒置相差显微镜(O-lympus);YJ-2操净台(苏州净化设备厂),CO2孵箱(SANYO日本)
1.2 h AFC的原代培养 10例羊水标本来自怀孕16-22周行产前检查或自愿引产的孕妇,在超声引导下行羊膜腔穿刺取得20 ml羊水。取标本前均征得孕妇本人同意,并得到医院伦理委员会批准。羊水标本在室温下1 000/min离心5 min,弃上清,加入Amnio MAX-Ⅱ培养基,置37℃、5%CO2饱和湿度培养箱培养箱,出现梭形细胞为主、类成纤维细胞的细胞集落且达70%汇合后,0.25%胰蛋白酶1 mmol·L-1EDTA消化后,改用α-MEM+10%胎牛血清+4μg/Lb FGF培养基,接种培养,记为第1代(P1)。细胞生长达到 融合时按 的比例传代。原代培养时每天随机抽取3个培养孔的AFC作细胞生长动力学分析,绘制原代细胞培养的生长曲线分析。
1.3 h AFC的传代培养 原代培养一旦铺满整个培养板的底部,即可用0.25% 胰酶1 mmol·L-1EDT A液消化、分离,然后按3×104/cm2密度传代接种于6孔培养板中,并记为P1;传代培养直至贴壁细胞彼此融合,铺满整个培养板的底面。再重复以上操作,并记为P2,以此类推,传代培养直至细胞出现衰老征相。传代培养的接种密度严格控制在与原代培养接种密度相同的水平以便于对照。每天随机抽取3个培养孔的AFC作细胞生长动力学分析,绘制传代细胞培养的生长曲线分析。
1.4 h AFC细胞表面分子测定 第10代细胞80%~90%融合后,用0.25%胰酶1 mmol·L-1EDTA液消化细胞,制成2×105/ml的单细胞悬液,分别加入3个Eppendof管中。A管为标准对照,加入5μl IgG1-FITC的单克隆抗体;B管加入5μl CD44-FITC单克隆抗体;C管加入5μl CD45-FITC单克隆抗体,室温反应30 min,流式细胞仪检测。
1.5 羊水细胞核型分析 取生长良好的细胞第10代、20代羊水干细胞进行核型分析。细胞培养液中加入秋水仙素,培养4 h后胰蛋白酶消化收集细胞,然后固定、制片、Gimsa染色后镜下观察并分析结果。
2 结果
2.1 h AFC的分离、纯化、扩增 实验收集的10例孕中期羊水标本原代培养成功9例。原代培养4 d可见有细胞贴壁,平均7 d左右散在的梭形细胞为主、类成纤维细胞的细胞集落。平均14天左右可达80%融合(图1A)。传代培养后,12 h即可贴壁,细胞呈较均一的长梭形,7 d左右细胞可铺满整个培养瓶底面,可继续传代扩增。经扩增5代后可获得3×109个细胞。传代后的细胞形态无明显变化(图1B),性质稳定。
2.2 h AFC原代和传代培养的生长曲线分析 原代培养细胞生长潜伏期4-6 d,此期主要为细胞贴壁生长阶段,有丝分裂活动不活跃;第7天倒置相差显微镜下观察到细胞形成大小不一的多个细胞克隆,有丝分裂开始变得活跃;第7-13天,细胞克隆进一步扩大,许多克隆彼此相连,此阶段细胞数目呈指数递增,此期为h AFC原代培养的对数增殖期;第14~18天,细胞克隆彼此相连并铺满整个培养孔底面,细胞生长曲线显示h AFC生长进入平台期;第18天,贴壁生长的h AFC铺满整个培养孔底面,原代培养结束。传代细胞比原代细胞的生长要快些,一般12 h即开始贴壁,多于一周左右即可铺满整个培养孔底面。本实验选择P5、P15、P20传代培养的生长曲线(见图2)进行观察比较,发现传代培养具有以下共性特征:传代培养的生长潜伏期1-2 d,对数增长期3-6 d,生长平台期7-10 d。传代培养细胞在P25代以后开始出现衰老征相。
2.3 h AFC表型 h MSC均一表达CD44,但CD45阴性(见图3)。
2.4 第10代、20代羊水干细胞检测干细胞核型正常,为46XX和46XY。

3 讨论
羊水干细胞做为一种新的干细胞来源,最早是在2003年被 Prusa[4]等发现;2007年,Paolo[5]等将由羊水中分离获得的干细胞命名为羊水干细胞(AFC),这种细胞表达 MSC(Mesenchymal stem cell)、不表达造血细胞系标记,90%的细胞表达Oct-4;这一发现引发了羊水干细胞研究的热潮,羊水干细胞有望成为新的干细胞种子来源,应用于细胞及基因治疗。目前对干细胞的体外分离纯化技术大多建立在对细胞表面标记识别的基础之上,具体的方法有流式细胞分离法、免疫磁珠分选法;另外还有依据分选细胞的物理性质所采用的梯度离心法和组织消化法;还有也可运用特定的培养基的选择作用和机械分离方法分离纯化干细胞。本实验即采用羊水专用培养基(美国 Hyclone公司 Aminio MAX-Ⅱcomplete培养基,结合机械分离方法从羊水中分离出间充质干细胞。
hFSC原代细胞培养生长曲线显示,h FSC在体外培养条件下的生长与其他细胞一样经历了生长滞缓期、对数增殖期、生长平台期。原代培养的细胞一般4 d左右细胞开始贴壁,并形成散在的细胞集落。细胞长满培养瓶需大约2周(14 d)的时间。h FSC传代细胞培养生长曲线显示,细胞生长的潜伏期缩短,一般4 h即开始贴壁,12 h完全贴壁,1周左右即可长满整个培养瓶。经扩增5代后可获得3×109个细胞。传代后的细胞形态无明显变化,性质稳定,传代到第20代细胞核型仍保持正常。因此,通过离体培养,使羊水中低峰度的MSC在体外实现扩增是可行的。羊水干细胞的这些特性使其成为组织工程中进行细胞治疗的理想的种子细胞,有很大的临床应用前景。经历了25代传代培养,h FSC开始出现衰老征相:即细胞生长速度缓慢,多数细胞出现核固缩、核碎裂和从培养板底脱落等。此结果和Kim[6]等的研究结果一致。
虽然目前国内外的科学家都致力于羊水干细胞的研究,但尚未发现AFC特征性的表面标记。AFC在细胞表型上类似于胚胎干细胞和成人骨髓间充质干细胞,即SH2、CD44和CD90阳性,CD34、CD45和CD117 HLADR阴性[7];在AFSC表面标记中引人注意的是POU转录因子4(Oct-4)等胚胎特异性标记的表达[8],提示羊水中存在比间充质干细胞发育更原始、增殖和分化能力更强、更接近于胚胎干细胞的细胞。本实验流式细胞仪检测其表达MSC细胞表面标记CD44,不表达造血干细胞标记CD45,因此证明我们培养的羊水细胞是具有MSC特性的干细胞。
本实验对孕中期羊水来源的干细胞的生物学特性进行了研究,为羊水干细胞的分离、培养提供了简便易行的操作方法。但此研究还只处于初级阶段,进一步的深入研究羊水干细胞的生物学特性对应用于基因疾病的临床治疗具有重要意义。
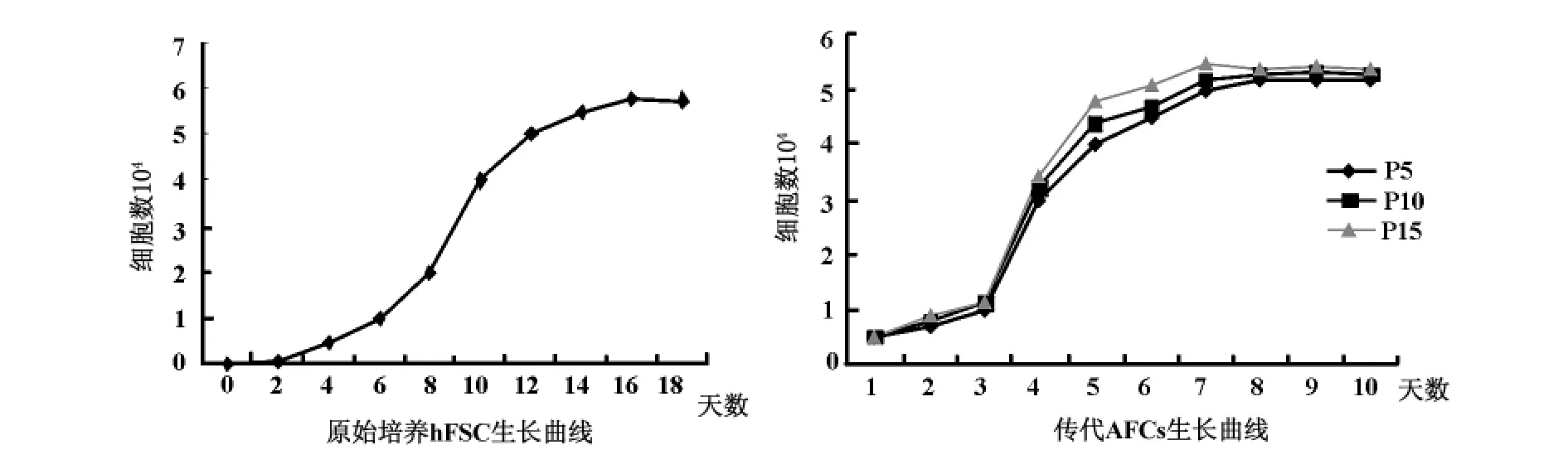
图2 原代、传代hFSC生长曲线
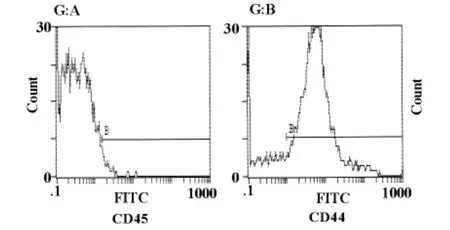
图3 hFSC细胞表型
[1]Thomson JA,Kalishman J,Golos TG,et al.Isolation of a primate embryonic stem cell line[J].Proc Nat Acad Sci USA,1995,92:7844.
[2]Bjorklund A,Lindvall O.Cell replacement for central nervous system disorders.Nature[J].Neurosci,2000,3:537.
[3]Jaiswal N,Haynesworth SE,Caplan AI,et al.Osteogenic differentiation of purified,culture-expanded human mesenchymal stem cells in vivo[J].J Cell Biochem,1997,64(2):295.
[4]Prusa AR,Marton E,Rosner M,et al.Oct-4 expressing cells in human amniotic fluid:a new source for stem cell research[J]?Hum Reprud,2003,18(7):1489.
[5]Paolo DC,Georg B,Minhaj S,Tao X,et al.Isolation of amniotic stem cell lines with potential for therapy[J].Nature Biotechnology,2007,25(1):100.
[6]Kim J,Lee Y,You J,et al.Human amniotic fluid-derived stem cells have characteristics of multi otent stem cells[J].Cell Pro lif,2007,40(1):75.
[7]Sartore S,Maddalena L,Annalisa A,et al.Amniotic mesenchymal cells autotransplanted in a porcine model of cardiac ischemia do not differentiate to cardiogenic phenotypes[J].Europ J Card Surg 2005,28:677.
[8]Bossolasco P,Montemurro T,Cova L.et al.Molecular and phenotypic characterization of human amniotic fluid cells and their differentiation potential[J].Cell Res,2006;16(4):329.
