海马神经元α7型烟碱样乙酰胆碱受体的失敏特征
2012-02-10崔文玉陈汝筑
沈 磊,崔文玉,陈汝筑,汪 海
(1.军事医学科学院卫生学环境医学研究所,北京 100850;2.中山大学中山医学院药理学系,广东广州 510080)
失敏(desensitization)是指在反复或长时间激动剂刺激下,生物学反应降低或消失的一种可逆现象,被认为是一种暂时性失活[1]。作为第1个被发现具有失敏过程的受体,烟碱样乙酰胆碱受体(nicotinic acetylcholine receptor,nAChR)是一类含半胱氨酸环的配体门控离子通道受体,由5个亚基构成[2]。在中枢神经系统广泛分布的1个N受体亚型是α7型烟碱样乙酰胆碱受体(α7-nAChR),它由5个相同的α亚单位组成,以快失敏和对钙离子的高通透性而有别于其他类型的N受体[3-4]。快失敏这个特征具有很重要的作用,在生理状态下参与了细胞保护,避免细胞受激动剂作用后的过度兴奋,也参与了神经递质释放的调节,并参与了突触可塑性对其他受体功能的调节。病理条件下参与了长期吸烟后的成瘾症状和有机磷中毒症状[5-6]。所以研究 α7-nAChR的失敏特征有助于理解失敏态N受体的特殊功能。本文使用膜片钳全细胞记录方式来探讨α7-nAChR的特异激动剂——胆碱对海马神经元中含α7-nAChR失敏过程的影响。
1 材料与方法
1.1 新生大鼠海马神经元培养 取12 h内出生的Sprague-Dawley大鼠,经75%乙醇浸泡消毒后,取全脑放入0℃的高糖DMEM培养液中冲洗,在解剖显微镜下分离出海马组织,并仔细剥离附着血管膜和皮层组织,然后用小镊子将海马捣碎,放入含2 g· L-1木瓜蛋白酶的DMEM培养液中,于37℃、5%二氧化碳孵箱中消化20 min,用含血清的DMEM/F12培养液中止消化,然后以1 000 r·min-1离心5 min,弃上清,重悬于DMEM/F12培养液,用不同口径的滴管分批次轻轻吹打分散细胞,将分散好的细胞悬液加入预先涂了多聚赖氨酸的35 mm培养皿中(在4℃放置过夜后吸出备用),于37℃、5%二氧化碳孵箱中培养1 d后将含血清培养液全部换为无血清并含2%B-27的Neurobasal-A培养液(该无血清培养液可以抑制胶质细胞的生长,而加入B-27可保证神经元的正常生长),以后每3天用无血清培养液半量换液1次。膜片钳实验采用培养10~15 d,有明显的胞体和神经突触的神经元。
1.2 全细胞膜片钳实验 使用MultiClamp 700B放大器和pClamp9.2软件采集和分析数据。记录电极用硬质有芯玻璃经电极拉制仪拉制而成,电阻为2~4 MΩ。用细胞外液替换培养液,记录电极与细胞表面形成高阻封接后电击破膜形成全细胞记录模式。补偿膜电容和串联电阻后将细胞膜电位钳制于-80 mV,被动记录受体介导电流。采样频率为5 kHz,低通滤波频率为2 kHz。给药方式有两种,激动剂由微量注射仪(PicospritzerⅢ)向细胞表面喷射给予,给药后立即移出培养皿,阻断剂由蠕动泵灌流给予(2 ml·min-1)。细胞外液的组成为(mmol ·L-1):NaCl 140,KCl 5,MgCl21,CaCl22,D-glucose 10,HEPES 10,用NaOH调pH 7.4。加入0.5 μmol ·L-1TTX阻断自发性动作电位产生。电极内液的组成为(mmol·L-1):CsCH3SO3130,CsCl 6,MgCl22,MgATP 4,EGTA 2,HEPES 10,用 CsOH调 pH 7.2。所有实验在室温(22℃ ~25℃)下进行。记录全过程均用正常外液进行灌流。
1.3 试剂 Choline、Methyllycaconitine(MLA)、αbungarotoxin(α-BGT)、Tetrodotoxin(TTX)、Mg-ATP、HEPES、多聚赖氨酸均为Sigma公司产品。DMEM、DMEM/F12、B-27、胎牛血清为Gibco公司产品。
1.4 数据分析 诱发电流用pClamp9.2软件测量分析,电流衰减部分用单指数方程拟合。数据用¯x ±s表示,n表示细胞数,用SPSS软件进行方差分析,组间比较采用LSD法。使用Origin 8.1软件进行作图,用Boltzmann拟合失敏恢复曲线。
2 结果
2.1 α7-nAChR介导电流的电生理学特征 将细胞膜电位钳制在-80 mV,向形成全细胞模式的海马神经元表面局部喷射10 mmol·L-1胆碱1s可诱发出一内向电流,该电流具有快激活和快失活的动力学过程。在所记录的117个细胞中,有90个细胞对胆碱有反应,舍弃电流峰值<100 pA的数值(8个)后,电流的峰值为(875±51)pA、10%~90%上升时间(反应激活过程)为(21±2)ms、对失活过程进行单指数拟合后得到失敏时间常数tau为(77± 5)ms(n=82)。胆碱诱发电流可以被MLA完全可逆阻断,持续灌流含10 nmol·L-1MLA的外液5 min可以使电流峰值降为0,而换为正常外液洗脱20 min后,电流峰值恢复到正常水平的68.3% ± 3.4%(n=4);该电流也可以被α-BGT完全不可逆阻断,持续灌流含100 nmol·L-1α-BGT的外液5 min使电流峰值降为正常水平的5.3% ±2.7%,而换为正常外液洗脱30 min后仍然无胆碱诱发电流出现(n=3),两种阻断剂的特异性阻断进一步证明胆碱诱发电流为α7-nAChR介导电流。有些胆碱诱发电流在结束给药后会出现rebound电流(反跳电流),这是因为在暴露于高浓度激动剂时,一部分开放的通道被激动剂所阻断,而在移除激动剂后恢复开放的现象[7]。(Fig 1)
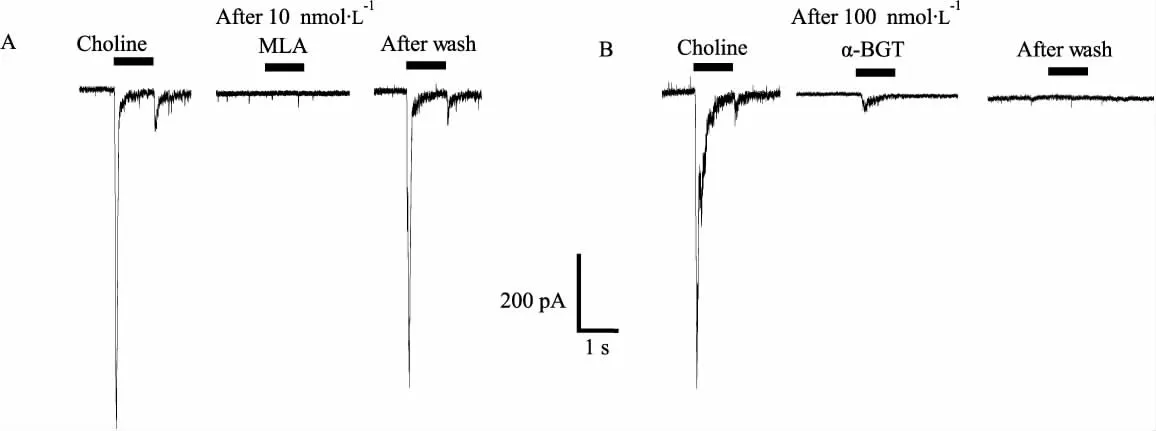
Fig 1 Characteristics of choline-evoked currents in cultured hippocampal neurons
2.2 高浓度胆碱诱导α7-nAChR的失敏特征
2.2.1 高浓度胆碱对受体激活和失敏的时-效关系影响 将细胞膜电位钳制在-80 mV,向形成全细胞模式的海马神经元表面局部喷射不同时间的10 mmol·L-1胆碱可以得到一系列胆碱诱发电流。10、20、50、100、200、500、1 000和10 000 ms的胆碱诱发电流的标准化电流幅度(以1 000 ms胆碱诱发电流幅度为100%)分别为:7.0%±3.5%、31.0% ±8.4%、93.9% ±6.4%、100.0% ±4.4%、100.5%±8.8%、93.7% ±3.9%、100.0% ±0.0 %和99.9%±4.0%(n=5);20、50、100、200、500、1 000和10 000 ms的胆碱诱发电流的10%~90%上升时间分别为:(38±8)、(23±4)、(15±3)、(16± 1)、(18±3)、(15±2)和(17±2)ms(n=5);20、50、100、200、500、1 000和10 000 ms的胆碱诱发电流的失敏时间常数(tau)分别为:(167±33)、(78± 25)、(59±13)、(57±14)、(42±11)、(49±13)和(72±22)ms(n=5)。这些数据说明当给胆碱的时间≥100 ms时,不同给药时间对α7-nAChR的激活和失敏过程基本无影响(Fig 2)。
2.2.2 高浓度胆碱刺激时间对受体失敏恢复的影响 将细胞膜电位钳制在-80 mV,采用配对刺激研究给胆碱不同时间对α7-nAChR失敏恢复的影响。配对刺激含有一个条件刺激(给予不同时间的胆碱)和间隔一定时间后的一个测试刺激(给100 ms的胆碱),每对刺激间隔120 s以保证受体功能完全恢复。结果为:当给予100 ms的胆碱作为条件刺激时,受体完全失敏的时间≤5 s,受体从失敏态恢复一半所需时间为(28.6±5.7)s(n=4);当给予1 s的胆碱作为条件刺激时,受体完全失敏的时间≤10 s,受体从失敏态恢复一半所需时间为(32.4± 2.4)s(n=6);而当给予10 s的胆碱作为条件刺激时,受体完全失敏的时间≤20 s,受体从失敏态恢复一半所需时间为(31.1±1.1)s(n=4),3种条件刺激下受体从失敏恢复的半数恢复时间两两比较差异无显著性。这些数据说明延长高浓度胆碱的作用时间不影响α7-nAChR从失敏态的恢复,但可以延长α7-nAChR的完全失敏时间(Fig 3)。

Fig 2 Effects of choline at the concentration of 10 mmol·L-1on activation and desensitization of choline-evoked currents in cultured hippocampal neurons
2.3 低浓度胆碱诱导的α7-nAChR的失敏特征将细胞膜电位钳制在-80 mV,加入100、50和10 μmol·L-1胆碱持续灌流海马神经元诱导 α7-nAChR失敏,之后用正常外液洗脱观察受体从失敏态的恢复。于正常期、失敏期和洗脱期用10 mmol ·L-1胆碱给100 ms测试受体功能。结果为:用含100 μmol·L-1胆碱的细胞外液作用神经元1、3、6和10 min后可使10 mmol·L-1胆碱诱发电流下降到正常对照电流水平的75.2%±12.1%、47.0%± 16.2%、15.7%±3.5%和8.1% ±0.6%,用正常外液洗脱后的1、3、6和10 min使电流恢复到正常对照电流水平的35.0% ±11.4%、61.0% ±8.2 %、68.8%±9.3%和80.3%±4.8%(n=5);用含50 μmol·L-1胆碱的细胞外液作用神经元1、3、6和10 min后使10 mmol·L-1胆碱诱发电流下降到正常对照电流水平的92.8% ±1.3%、70.8% ±4.3 %、46.4%±5.1%和41.6%±4.1%,用正常外液洗脱后的1、3、6和10 min使电流恢复到正常对照电流水平的 49.9% ±5.1%、68.0% ±1.8%、69.8%±1.8%和74.7% ±0.6%(n=4);而用含10 μmol·L-1胆碱的细胞外液作用神经元1、3、6和10 min后,10 mmol·L-1胆碱诱发电流水平为正常对照电流水平的97.4% ±2.6%、104.2% ±5.2 %、96.9%±5.9%和94.1%±8.4%,用正常外液洗脱后的1、3、6和10 min诱发电流为正常对照电流水平的94.5%±7.2%、92.8%±4.1%、96.4% ±3.2%和95.9%±2.2%(n=4)。这说明尽管低浓度胆碱激动α7-nAChR的能力不够(100 μmol· L-1胆碱诱发电流幅度为 10 mmol·L-1胆碱的19%,数据未列出),但足以使受体失敏,失敏程度随激动剂浓度和作用时间的增加而加深(Fig 4)。

Fig 3 Effects of choline at the concentration of 10 mmol·L-1 on recovery from desensitization of choline-evoked currents in cultured hippocampal neurons
3 讨论
作为记忆和认知功能形成的中枢,海马含有丰富的神经元型nAChR,接受内源性神经递质—ACh后调控其他神经递质的释放或者直接产生突触后效应。海马中的 N受体有多种亚型,如 α4β2、α4α5β2、α3β4、α7等,其中α7型受体介导的电流对MLA和α-BGT敏感[8]。胆碱是α7-nAChR的选择性激动剂,本实验中用10 mmol·L-1胆碱诱发电流为快激活和快失活电流,且能被10 nmol·L-1的MLA和100 nmol·L-1的α-BGT完全阻断,说明该电流为胆碱激活α7-nAChR引起。
以胆碱为工具药研究海马神经元α7-nAChR的失敏特征,发现:(1)10 mmol·L-1胆碱(高浓度)诱导的α7-nAChR的失敏速度很快;(2)10 mmol·L-1胆碱诱导的α7-nAChR从失敏态恢复的速度也很快(3)当给药时间≥100 ms时,延长高浓度胆碱的作用时间并不影响α7-nAChR的失敏速度;延长作用时间也不影响受体从失敏态的恢复;但是延长作用时间延长了受体处在完全失敏态的时间。这说明只要给药时间足够诱发完整电流,α7-nAChR的失敏及其恢复就与给药时间无关,暴露于激动剂更长时间可能仅仅只是增加了受体对下一场刺激的绝对不应期;(4)低浓度胆碱(≤100 μmol·L-1)持续灌流也可以使受体缓慢失敏,失敏程度与胆碱的浓度有关;而失敏恢复的程度未观察到与胆碱的浓度有关,这可能是由于洗脱时间不够长(约10 min),100和50 μmol·L-1胆碱诱发的受体失敏还未完全恢复。

Fig 4 Desensitization of choline-evoked currentsto choline at the concentration of 100,50 and 10 μmol·L-1in cultured hippocampal neurons
自从Katz和Thesleff从骨骼肌N受体发现受体失敏现象后[9],经典的失敏就是继发于受体的激活,即静息态受体被激动剂诱发为激活态后马上变构为失敏态。之后这种理论又补充了低浓度激动剂(无明显诱发电流产生的浓度)慢性孵育也可以诱发受体失敏的内容,这是由于失敏态受体对于激动剂的亲和力远高于激活态受体,因此低浓度激动剂使受体越过激活态而直接进入失敏态,这种失敏也被称为“高亲和力失敏”(high-affinity desensitization,HAD)[10-11]。HAD对于胆碱的生理作用可能更为重要,因为相比较ACh在突触间隙的瞬间高浓度激动受体的作用,作为ACh水解产物的胆碱在生理条件下的细胞外液浓度为4~10 μmol·L-1[12],该浓度很难激活大量α7-nAChR,然而在反复的冲动传递过程中,胆碱浓度有可能累计,从而产生HAD来限制ACh对突触后细胞的过度兴奋来保护细胞。
总的来说,随着失敏态α7-nAChR的功能越来越被重视,本实验为应用胆碱来研究α7-nAChR的失敏功能提供了依据。
[1] Quick M W,Lester R A.Desensitization of neuronal nicotinic receptors[J].J Neurobiol,2002,53(4):457-78.
[2] Gotti C,Zoil M,Clementi F.Brain nicotinic acetylcholine receptors:native subtypes and their relevance[J].Trends Pharmacol Sci,2006,27(9):482-91.
[3] Albuquerque E X,Pereira E F,Alkondon M,et al.Mammalian nicotinic acetylcholine receptors:from structure to function[J].Physiol Rev,2009,89(1):73-120.
[4] 殷晓峰,崔文玉,胡 刚,等.培养大鼠颈上神经节细胞胆碱诱发电流的特征[J].中国药理学通报,2004,20(1):89-94.
[4] Yin X F,Cui W Y,Hu G,et al.The characteristics of choline-evoked current in cultured rat superior cervical ganglia neurons[J].Chin Pharmacol Bull,2004,20(1):89-94.
[5] Giniatullin R,Nistri A,Yakel J L.Desensitization of nicotinic ACh receptors:shaping cholinergic signaling[J].Trends Neurosci,2005,28(7):371-8.
[6] 张 捷,崔文玉,汪 海.神经元N受体功能失敏对M受体拮抗剂药理作用的影响[J].中国药理学通报,2010,26(8):997-1001.
[6] Zhang J,Cui W Y,Wang H.Effect on antagonism of muscarinic acetylcholine receptors antagonists by desensitization of nicotinic acetylcholine receptors[J].Chin Pharmacol Bull,2010,26(8): 997-1001.
[7] Sokolova E,Matteoni C,Nistri A.Desensitization of neuronal nicotinic receptors of human neuroblastoma SH-SY5Y cells during short or long exposure to nicotine[J].Br J Pharmacol,2005,146 (8):1087-95.
[8] Albuquerque E X,Pereira E F,Castro N G,et al.Neuronal nicotinic receptors:function,modulation and structure[J].Seminars Neurosci,1995,7(2):91-101.
[9] Katz B,Thesleff S.A study of the“desensitization”produced by acetylcholine at thr motor end-plate[J].J Physiol,1957,138 (1):63-80.
[10]Paradiso K G,Steinbach J H.Nicotine is highly effective at producing desensitization of rat α4β2 neuronal nicotinic receptors[J].J Physiol,2003,553(3):857-71.
[11]Allison A F,Susmita C,Selena E B.Neuronal nicotinic acetylcholine receptors:neuroplastic changes underlying alcohol and nicotine addictions[J].Front Mol Neurosci,2012,83(5):1-18.
[12]Alkondon M,Pereira E F,Cortes W S,et al.Choline is a selective agonist of alpha7 nicotinic acetylcholine receptors in the rat brain neurons[J].Eur J Neurosci,1997,9(12):2734-42.
