牛磺酸镁对缺氧/复氧致大鼠心肌细胞内向整流钾通道异常的影响
2012-02-10何海燕尹永强李宏杰丛恬駪娄建石
何海燕,尹永强,李宏杰,丛恬駪,康 毅,娄建石
(天津医科大学药理学教研室,天津 300070)
心律失常(cardiac arrhythmia)是心血管系统疾病常见的临床表现形式,也是最为严重的病症之一,有较高的发病率和致死率,严重威胁人类健康。缺血/再灌注常可引起心肌梗死、心肌细胞凋亡及心律失常。目前,临床常规使用的抗心律失常药物疗效不突出,有文献报道抗心律失常药物总有效率仅为30% ~60%,远期疗效也不甚理想[1-2]。很多药物虽有一定疗效,但有加重或致心律失常的危险[3]。因此,揭示心律失常发生的深层机制,寻找疗效确切、无明显不良反应的抗心律失常药物成为该研究领域的重点。牛磺酸镁配合物(taurine magnesium coordination compound,TMCC)是本研究室合成的配合物,既往实验研究证实该配合物对多种因素诱导的实验性心律失常与触发活动有确切的防治效果[4-6],且其对缺血/再灌注心律失常的治疗效果明显优于单用牛磺酸或镁离子。细胞水平的研究证明该配合物不仅对正常状态的钠、钾、钙离子通道有影响[7-8],而且对药物诱发的异常钠电流及异常钙电流亦有作用[9-11]。提示该配合物可能具有广泛的抗心律失常作用,但作用机制尚未被充分阐明。内向整流钾通道Ik1的异常与心律失常的关系深入研究的报道甚少,鉴于Ik1通道特殊的结构和电生理特性,有学者认为Ik1通道与抗心律失常的关系研究意义重大[12]。诸多疾病或病理情况下发生的心律失常与Ik1下降有关,如LQT综合征、尖端扭转性室速、心肌缺血性心律失常等。但未见有报道TMCC对Ik1作用的相关文献,因此,本研究拟建立大鼠心肌细胞的缺氧/复氧模型,观察TMCC对大鼠心室肌细胞内向整流钾通道的影响,探讨其抗心律失常的电生理及离子通道机制。
1 材料与方法
1.1 材料
1.1.1 实验动物 健康成年Wistar大鼠,♂,体质量220~250 g,合格证号:SCXK(军)2009-003。
1.1.2 药品与试剂 HEPES、EGTA、Mg-ATP、胶原酶Ⅱ等购自Sigma公司。TMCC由天津医科大学化学教研室合成。
1.1.3 仪器 膜片钳仪,MultiClamp 700B,USA;数-模转换器,DigiData1440A,USA;倒置显微镜,IX51,Japan;三维操纵仪,MP-225,USA;微电极拉制仪,P-97,USA;恒流泵,Peri-Star,台湾;酸度计,PHS-3C,上海精密科学仪器有限公司;Millipore纯水系统,USA。
1.1.4 液体的制备 无钙台式液(mmol·L-1): NaCl 136,KCl 5.4,NaH2PO40.33,MgCl21.0,HEPES 10,Glucose 10;用NaOH调pH至7.45。细胞保存液(KB液,mmol·L-1):L-谷氨酸70,牛磺酸15,KCl 30,KH2PO410,MgCl20.5,HEPES 10,EGTA 0.5,Glucose 10;用KOH调pH至7.4。记录内向整流钾电流(Ik1)的细胞外液(mmol·L-1): NaCl 132,CaCl21.8,KC1 4,MgCl21.2,HEPES 10,Glucose 10,CdC120.1;用NaOH调pH至7.4。记录内向整流钾电流(Ik1)的缺氧细胞外液:去除Glucose,其余同记录内向整流钾电流(Ik1)的细胞外液,通氮气20 min,用NaOH调pH到6.80。记录Ik1的电极内液(mmol·L-1):KCl 140,MgCl21,MgATP 4,EGTA 5,HEPES 10;用KOH调pH至7.3。
1.2 方法
1.2.1 单个大鼠心肌细胞的分离 用25%乌拉坦将大鼠麻醉,仰位固定于鼠台上,迅速剪开胸腔暴露心脏,从主动脉根部离断取出心脏放入4℃无钙台式液中,去除脂肪及结缔组织。将主动脉逆行插管连接于Langendorff灌流装置(恒温37℃)上,以无钙台式液8 ml·min-1连续灌流5 min,洗去心脏残血后改用50 ml含10mg胶原酶Ⅱ与15 mg牛血清白蛋白的无钙台式液进行循环灌流。随着灌流的进行,流出液变得黏稠,心肌的颜色逐渐变浅、透明,心脏体积逐渐变大、松软。此时将心脏自左心室分段剪取心肌组织,置于装有KB液的试管中,用吸管轻轻吹打使之分散成单个细胞,分装,置4℃冰箱中稳定2 h待用。
1.2.2 内向整流钾通道电流(Ik1)的记录 应用全细胞膜片钳技术记录单细胞离子电流。所用微电极用两步拉制仪拉制而成,微电极充电极液后电阻在2~4 MΩ之间。电流信号经MultiClamp 700B膜片钳 放 大 器、DigiData1440A 数-模 转 换 器 及Pclamp10.1采集储存及分析。将细胞悬液置于倒置显微镜工作平台容积为1 ml的浴槽中,待细胞贴壁后,用钾外液进行灌流,流速1 ml·min-1。选用大小相近、纹理清晰的杆状细胞进行实验。待高阻封接后,进行电极电容补偿。负压或高电压脉冲破膜,进行膜电容、串联电阻及漏电流补偿,平衡5 min,待电极内钾内液与细胞内液交换充分后,进行膜电流记录。膜电流的大小以电流密度及单位膜电容的膜电流表示。
1.2.3 实验分组和造模 实验分为正常对照组、正常+100 μmol·L-1TMCC组、正常+200 μmol· L-1TMCC组、正常+400 μmol·L-1TMCC组、缺氧/复氧模型组(H/R组)、H/R+24.24 μmol·L-1胺碘酮组、H/R+100 μmol·L-1TMCC组、H/R+ 200 μmol·L-1TMCC组、H/R+400 μmol·L-1TMCC组。将分离的细胞置于浴槽中,待贴壁后,先用记录内向整流钾电流(Ik1)的细胞外液进行灌流,封接形成全细胞记录模式后,平衡5 min,待电极内钾内液与细胞内液充分交换后,进行膜电流记录,定义为正常细胞Ik1,正常+TMCC组即在以上条件下加入不同浓度的TMCC进行记录;然后用缺氧钾外液冲洗替换浴槽中的正常钾外液,15 min后再以正常有氧钾外液冲洗替换缺氧钾外液,5 min后记录即为缺氧/复氧组Ik1;H/R+TMCC组和H/R+胺碘酮组分别在有氧钾外液中加入不同浓度的TMCC和胺碘酮。记录Ik1时细胞外液中加入CdCl2以阻断L-钙电流。形成全细胞构型后,在电压钳模式下记录电流。保持电压为-50 mV,指令电压从-100 mV开始,以10 mV步阶跃至 -10 mV,脉冲持续300 ms,刺激频率为0.2 Hz,可记录到大鼠心肌细胞的Ik1电流。在细胞外液中加入0.l mmol·L-1CdCl2使钙通道电流失活,钳制电压-50 mV以阻断INa的影响。测定从0时开始到刺激结束时的300 ms电流稳态值,除以该细胞的电容标化为Ik1的电流密度(pA·pF-1)。
1.3 统计学分析 在Clampfit 10.0软件中将记录的原始数据进行处理分析,结果以±s表示。根据给药前后不同电压水平下的最大激活电流绘制Ik1的I-V曲线。采用SPSS 17.0软件对资料进行统计分析,单因素方差分析给药组与对照组间的差异显著性。
2 结果
2.1 TMCC对正常大鼠心肌细胞Ik1的影响 记录Ik1电流,保持电压为-50 mV,指令电压从-100 mV开始,以10 mV步阶跃至 -10 mV,脉冲持续300 ms,刺激频率为0.2 Hz,可记录到大鼠心肌细胞的Ik1电流(Fig 1)。在细胞外液中加入0.1 mmol· L-1CdCl2使钙通道电流失活,钳制电压-50 mV以阻断INa的影响。测定从0时开始到刺激结束时的300 ms电流稳态值,Ik1电流为电流峰值与基线之差,除以该细胞的电容标化为Ik1的电流密度(pA· pF-1)。Ik1内向电流以刺激电压-100 mV峰值电流密度作为观察指标,Ik1内向电流以刺激电压-30 mV峰值电流密度作为观察指标。正常对照组和各浓度TMCC对正常细胞作用的Ik1电流峰值及I-U曲线变化见Tab 1,Fig 2,实验结果表明,正常组细胞的Ik1内向及外向电流峰值与正常+TMCC(100、200、400 μmol·L-1)组相比,差异无显著性(P均 >0.05);I-V曲线无明显变化。不同浓度TMCC对正常大鼠心肌细胞内向整流钾通道电流没有作用。
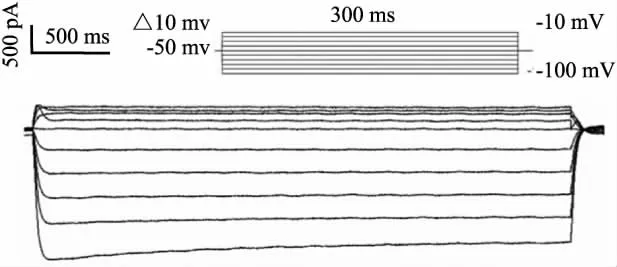
Fig 1 Current of Ik1in rat ventricular myocardiocytes
Tab 1 Effects of TMCC(100,200,400 μmol·L-1) on Ik1current density in normal rat ventricular myocardiocytes(±s,n=6)
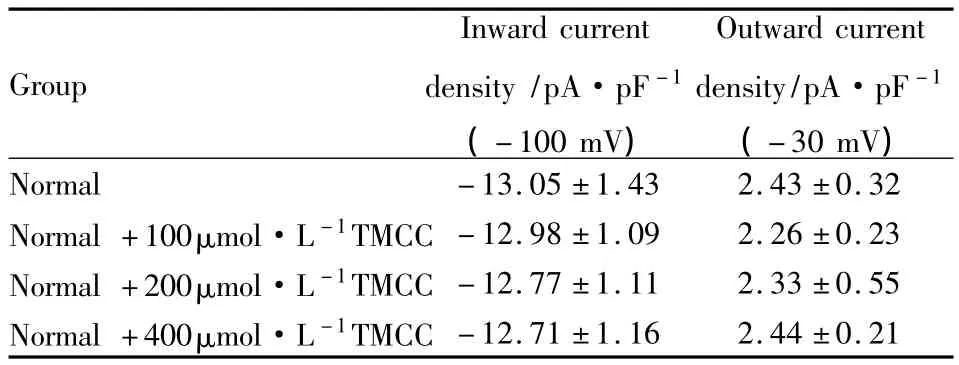
Tab 1 Effects of TMCC(100,200,400 μmol·L-1) on Ik1current density in normal rat ventricular myocardiocytes(±s,n=6)
Group Inward current density/pA·pF-1 (-100 mV) Outward current density/pA·pF-1 (-30 mV) Normal -13.05±1.43 2.43±0.32 Normal+100μmol·L-1TMCC -12.98±1.09 2.26±0.23 Normal+200μmol·L-1TMCC -12.77±1.11 2.33±0.55 Normal+400μmol·L-1TMCC -12.71±1.16 2.44±0.21
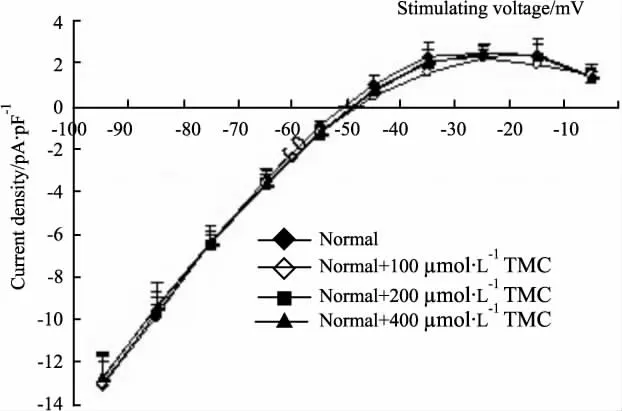
Fig 2 Effects of TMCC(100,200,400 μmol·L-1)on I-U curves of Ik1in normal rat ventricular myocardiocytes(n=6)
2.2 TMCC和胺碘酮对大鼠心肌细胞缺氧/复氧损伤模型Ik1的影响 记录Ik1电流,保持电压为-50 mV,指令电压从-100 mV开始,以10 mV步阶跃至-10 mV,脉冲持续300 ms,刺激频率为0.2 Hz,可记录到大鼠心肌细胞的Ik1。在细胞外液中加入0.l mmol·L-1CdCl2可使钙通道电流失活,钳制电压-50 mV以阻断INa的影响。测定从0时开始到刺激结束时的300 ms电流稳态值,Ik1电流为电流峰值与基线之差,除以该细胞的电容标化为Ik1的电流密度(pA·pF-1)。Ik1内向电流以刺激电压-100 mV峰值电流密度作为观察指标,Ik1内向电流以刺激电压-30 mV峰值电流密度作为观察指标。胺碘酮及各浓度TMCC对正常细胞作用的Ik1电流峰值及I-V曲线变化见Tab 2,Fig 3,实验结果表明,缺氧/复氧能使Ik1内向电流峰值从(-13.05±1.43)pA·pF-1降至(-6.94±0.59)pA·pF-1(n=6,P<0.01),内向电流曲线上移,使Ik1外向电流峰值从(2.43± 0.32)pA·pF-1降到(1.31±0.28)pA·pF-1,外向电流曲线下移。提示缺氧/复氧损伤引起大鼠心室肌细胞内向整流钾通道异常,实验模型制备成功。与缺氧/复氧组相比,TMCC(100、200、400 μmol· L-1)可使减小的内向电流峰值分别恢复为(-7.21 ±0.79)pA·pF-1、(-7.28±0.22)pA·pF-1、(-10.96±0.78)pA·pF-1(n=6,P<0.01),24.24 μmol·L-1胺碘酮使其恢复为(-8.80±0.97)pA· pF-1。TMCC(100、200、400 μmol·L-1)和胺碘酮均可使上移的内向电流曲线下移。使减小的外向电流分别恢复为(0.90±0.14)pA·pF-1、(1.84± 0.46)pA·pF-1、(2.36±0.40)pA·pF-1,24.24 μmol·L-1胺碘酮使其恢复为(2.16±0.69)pA· pF-1,TMCC(100、200、400 μmol·L-1)和胺碘酮均可使下移的外向电流曲线上移。翻转电位均在-50 mV到-60 mV之间,无明显变化。
Tab 2 Effects of TMCC(100,200,400 μmol·L-1),amiodarone(24.24 μmol·L-1)on Ik1current density in rat ventricular cardiomyocytes suffered from hypoxia/ reoxygenation(H/R)(±s,n=6)

Tab 2 Effects of TMCC(100,200,400 μmol·L-1),amiodarone(24.24 μmol·L-1)on Ik1current density in rat ventricular cardiomyocytes suffered from hypoxia/ reoxygenation(H/R)(±s,n=6)
**P<0.01 vs normal;##P<0.01 vs H/R;▲P<0.05▲▲P<0.01 vs amiodarone;★★P<0.01 vs 100 μmol·L-1TMCC;▼▼P<0.01 vs 200 μmol·L-1TMCC
Group Inward current density /pA·pF-1 (-100 mV) Outward current density /pA·pF-1 (-30 mV) Normal -13.05±1.43 2.43±0.32 H/R -6.94±0.59 1.31±0.28 H/R+24.24μmol·L-1 amiodarone -8.80±0.97**## 2.16±0.69## H/R+100μmol·L-1TMCC -7.21±0.79**▲ 0.90±0.14**▲▲H/R+200μmol·L-1TMCC -7.28±0.22**▲ 1.84±0.46★★H/R+400μmol·L-1 TMCC -10.96±0.78**##▲▲★★▼▼ 2.36±0.40##★★
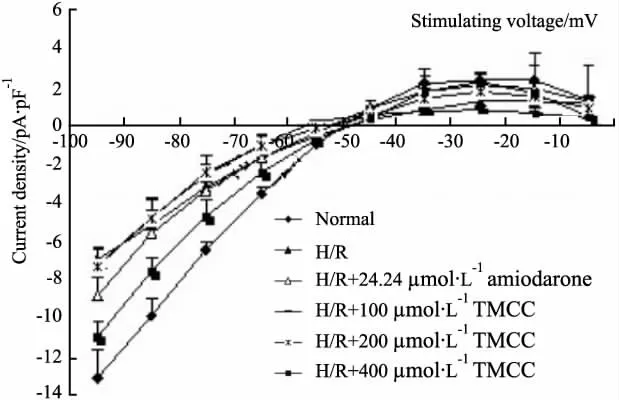
Fig 3 Effects of TMCC(100,200,400 μmol·L-1)and amiodarone(24.24 μmol·L-1)on I-V curves of Ik1 in normal rat ventricular myocardiocytes suffered from hypoxia/reoxygenation(H/R)(n=6)
3 讨论
内向整流钾通道(inward rectifier potassium channel)于1949年由Katz首先在钾去极化肌细胞中发现,其为一大类钾离子通道,在各种组织中广泛分布,其中心肌细胞中主要有 Kir2.1、Kir2.2、Kir2.3,心脏中的内向整流钾通道主要分布在心房肌和心室肌,其在心肌细胞动作电位的各时相均有开放,但在动作电位3相复极和静息电位相电导性最大。其在超极化时表现为明显的内向电流,钾离子大量内流,膜电位靠近钾的平衡电位,防止过度超极化[13],轻度去极化时表现为外向电流,借此维持静息电位的稳定。当进一步去极化时外向电流反而减小,表现出内向整流特性[14],主要功能是参与动作电位的3期复极,维持心肌细胞静息电位的正常水平和正常兴奋节律。大量临床及实验研究表明,Ik1参与了许多病理性心律失常。Junichiro等[15]在Kir2.1过表达的转基因小鼠中观察到多种心律失常,如缓慢心率、室性早搏、房室传导阻滞和心房颤动(AF)等;相反地,kir2.1抑制性突变体表达的小鼠则表现为Ik1电流的抑制,静息膜电位正向移动,动作电位时程延长,以及心肌兴奋性变化如QRS波及QT间期的延长。心肌缺血和心肌梗死时心律失常发生也与Ik1下降有关。Almond等[16]报道,大鼠心肌梗死区Ik1减小20%。Adeniran等[17]指出Ik1通道异常会引起伴有Andersen’s综合征、LQT综合征、SQTS等的心律失常。
本实验中的缺氧/复氧模型旨在模拟心肌细胞的缺血/再灌注过程,有研究表明组织缺血缺氧时,无氧代谢增强,细胞内乳酸堆积,pH值降低,细胞外的钾离子浓度升高[18]。再灌注时,发生钠-钙离子交换,细胞内钙超载的同时,细胞外的钠离子浓度升高,产生大量自由基,进而引起线粒体和细胞内膜性结构的损伤,造成心肌细胞严重损伤。Ik1的整流作用减弱,或诱发早期后除极电位,而形成异常心律[19]。另有研究发现肥厚型心肌病及心力衰竭时心肌的Ik1电流密度减小,线粒体功能障碍会导致细胞的pH下降及Kir2.1电流的pH依赖性的上调,从而导致Ik1电流的抑制,部分解释缺血缺氧时心肌的兴奋性异常[20]。这与本实验Ik1电流变化相符。
本实验结果显示缺氧/复氧过程可使大鼠心肌细胞Ik1内向电流和外向电流峰值均减小,动作电位时程增大,复极缓慢,静息电位减少,复极异常和早后除极改变细胞兴奋性易引起心律失常。TMCC可恢复Ik1电流异常,从而抑制因缺氧/复氧诱发的Ik1电流变化,使其恢复至正常水平,其作用与胺碘酮相当。这一结果提示,TMCC对缺氧/复氧造成的快速性心律失常有治疗作用。此外,本实验结果中TMCC(100、200、400 μmol·L-1)对正常心肌细胞Ik1无影响,但可部分恢复缺氧/复氧减小的Ik1值,表明TMCC对心肌细胞Ik1的作用与该通道的状态有关,可使异常的电流趋向恢复正常。TMCC对正常Ik1无明显影响,提示该化合物不易出现因对单个通道作用过强而导致心律失常等副作用。
[1] Sang M C,Bennett P B.Antiarrhythmic drug target choices and sereening[J].Cire Res,2003,93(6):491-9.
[2] Lee K L,Tai Y T.Long-term low-dose amiodarone therapy in the management of ventricular and supraventricular tachyarrhythmias: efficacy and safety[J].Clin Cardiol,1997,20(4):372-7.
[3] Lu Z,Kamiya K,Opthof T,et al.Density and kinetics of IKrand IKsin guinea pig and rabbit ventricular myocytes explain different efficacy of IKsblockade at high heart rate in guinea pig and rabbit: implications for arrhythmogenesis in humans[J].Circulation,2001,104(8):951-6.
[4] 孙 涛,康 毅,娄建石,等.牛磺酸镁的合成及对乌头碱诱发心律失常的作用[J].中国心血管杂志,2003,8(4):238-9.
[4] Sun T,Kang Y,Lou J S,et al.Synthesis and effect of arrhythmia induced by aconitine on taurine-magnesium coordination compound[J].Chin J Cardiovasc Med,2003,8(4):238-9.
[5] 刘 欣,汪 涛,周宝宽,等.牛磺酸镁对哇巴因诱发心律失常的实验研究[J].中国心血管杂志,2004,9(2):79-82.
[5] Liu X,Wang T,Zhou B K,et al.Antiarrhythmic effects of taurinemagnesium coordination compound in ouabaine-induced arrhythmias of guinea pig in vovo[J].Chin J Cardiovasc Med,2004,9(2): 79-82.
[6] Yin Y,Wen K,Wu Y,et al.Inhibition of sodium current by taurine magnesium coordination compound prevents cesium chlorideinduced arrhythmias[J].Biol Trace Elem Res,2012,146(2):192 -8.
[7] 于 雷,尹永强,李 欣,等.牛磺酸镁对豚鼠心室肌细胞钾离子通道的影响[J].中国药理学通报,2008,24(2):203-5.
[7] Yu L,Yin Y Q,Li X,et al.Effect of taurine magnesium coordination compound on potassium current in guinea pig ventricular cardiomyocytes[J].Chin Pharmacol Bull,2008,24(2):203-5.
[8] 于 雷,尹永强,李 欣,等.牛磺酸镁配合物对豚鼠心室肌细胞钠离子和钙离子通道的影响[J].中国药理学与毒理学杂志,2009,23(1):17-22.
[8] Yu L,Yin Y Q,Li X,et al.Effect of taurine magnesium coordination compound on sodium and calcium channels in guinea pig ventricular cardiomyocytes[J].Chin J Pharmacol Toxicol,2009,23 (1):17-22.
[9] 汪玲芳,尹永强,赵 临,等.牛磺酸镁对乌头碱致大鼠心肌细胞心律失常模型钠离子通道的影响[J].中国药理学通报,2010,26(5):611-5.
[9] Wang L F,Yin Y Q,Zhao L,et al.Effect of taurine magnesium coordination compound on sodium channel in rat cardiomyocytes of arrhythmia induced by aconitine[J].Chin Pharmacol Bull,2010,26(5):611-5.
[10]汪玲芳,尹永强,赵 临,等.牛磺酸镁对乌头碱致大鼠心肌细胞心律失常模型钙离子通道的影响[J].中国新药与临床杂志,2011,30(1):39-42.
[10]Wang L F,Yin Y Q,Zhao L,et al.Effect of taurine magnesium coordination compound on calcium channel in rat cardiomyocytes of arrhythmia induced by aconitine[J].Chin J New Drugs Clin Rem,2011,30(1):39-42.
[11]Zhao L,Lou J,Wu H,et al.Effects of taurine magnesium coordination compound on ionic channel in rat ventricular myocytes of arrhythmia induced by ouabain[J].Biol Trace Elem Res,2012,147 (1-3):275-84.
[12]Niehols C G,Makhina E N,Pearson W L,et al.Inward rectification and implicateons for cardiac excitability[J].American Heart,1996,78(1):1-7.
[13]Kubo Y,Baldwin T J,Jan Y N,et al.Primary structure and functional expression of a mouse inward rectifier potassium channel[J].Nature,1993,362(3):127-31.
[14]张志敏,陈义汉.心肌细胞内向整流钾通道研究进展[J].中国分子心脏病学杂志,2006,6(3):173-5.
[14]Zhang Z M,Chen Y H.Adances in the study of inward rectifier potassium channel in cardiomyocytes of rat[J].Molecul Cardiol China,2006,6(3):173-5.
[15]Miake J,Marban E,Nuss H B.Functional role of inward rectifier current in heart probed by Kir2.1 overexpression and dominantnegative suppression[J].J Clin Invest,2003,111(10):1529-36.
[16]Almond F,Alvarez J L,Gauzier H M,et al.Ionic basis of ventricular arrhythmias in remodeled rat heart during longterm myocardial infarction[J].Cardiovasc Res,1999,42(2):402-15.
[17]Adeniran I,El Harchi A,Hancox J C,Zhang H.Proarrhythmia in KCNJ2-linked short QT syndrome:insights from modelling[J].Cardiovasc Res,2012,94(1):66-76.
[18]Hirche H,Franz C,Bös L,et al.Myocardial extracelluar K+and H+increase and noradrenaline release as possible cause of early arrhythmias following acute coronary artery occlusion in pigs[J].J Mol Cell Cardiol,1980,12(6):579-93.
[19]邹路芸,蒋文平.缺血/再灌注对心室肌细胞膜离子通道的影响[J].中国心脏起搏与心电生理杂志,1999,13(4):230-3.
[19]Zou L Y,Jiang W P.Effect of ischemia/reperfusion on membrane ionic channels of guinea pig ventricular myocytes[J].Chin J Card Pacing Electrophys,1999,13(4):230-3.
[20]Collins A,Larson M.Regulation of inward rectifier K+channels by shift of intracellular pH dependence[J].Cell Physiol,2005,202(1):76-86
