盐酸阿比朵尔在大鼠体内的药代动力学
2012-02-10周其冈蔡宝昌陈晓辉毕开顺
刘 晓,周其冈,李 嬛,蔡宝昌,陈晓辉,毕开顺
(1.南京中医药大学药学院,江苏南京 210029;2.沈阳药科大学药学院,辽宁沈阳 110016; 3.南京医科大学药学院,江苏南京 210029)
盐酸阿比朵尔收载于《俄国药典》XI第1卷,2003年经SFDA批准开始进行第2类新药临床前和临床研究。自1993年在俄罗斯上市以来,该药物在俄罗斯、乌克兰等俄联邦国家已有10余年的临床应用历史,其良好的疗效和安全性已得到肯定,并被俄罗斯国家药典委员会推荐给老人[1]和儿童[2-3]作为对抗甲型和乙型流感病毒感染的治疗和预防药物。目前,国内对该药物相关剂型的研制与开发不断增加,作为新药研究与开发的一部分重要内容,本项工作报道盐酸阿比朵尔在大鼠体内的药代动力学研究结果,以揭示其在大鼠体内的变化规律,为其新药研究与开发提供科学依据。
1 材料
1.1 药品与试剂 盐酸阿比朵尔原料药(HPLC法测定纯度>98.5%)与阿比朵尔对照品(HPLC法测定纯度>99.5%)均由沈阳中海科技开发有限公司提供(化学结构如Fig 1A)。内标物(6-溴-4-吡咯基甲基-5-羟基-1-甲基-2-苯硫基甲基-吲哚-3-羧酸乙酯,纯度>98.0%,化学结构如Fig 1B)由沈阳药科大学药物化学实验室合成。甲醇(色谱纯)购自加拿大Calepure公司;乙腈(色谱纯)、氢氧化钠(分析纯)、甲酸(分析纯)均购自天津大茂化学试剂厂。实验用水为实验室自制三重蒸馏水。

Fig 1 Chemical structures of arbidol(A)and internal standard(B)
1.2 实验仪器 液相色谱-质谱联用仪为Shimadzu 2010 A系统,包括 LC-10ATvp液相色谱输液泵,2010EV型单重四极杆质谱仪,LC-MS Solution 3.0数据采集工作站(岛津公司,日本);Kromasil C18色谱柱(4.6 mm×150 mm,5 μm;大连中汇达公司,中国),偶联Kromasil C18保护柱(10 mm ×4.6 mm,5 μm;大连中汇达公司,中国)。AB135-S电子天平(METTLER TOLEDO公司,瑞典)、CAY-1液体快速混合器(北京长安仪器厂)、DK-98-1电热恒温水浴锅(天津市泰斯特仪器有限公司)、超声波发生器(浙江象山石浦海天电子仪器厂)、TGL-16C离心机(上海安亭科学仪器厂)。
1.3 实验动物 健康♂Wistar系大鼠,体质量200~220 g,由沈阳药科大学实验动物中心提供,给药前禁食12 h,自由饮水。
2 方法与结果
2.1 方法
2.1.1 色谱条件 以甲醇-0.1%甲酸水溶液(78∶22,V/V)为流动相,恒速洗脱,流速为0.8 ml· min-1,柱温为室温,进样体积为20 μl。
2.1.2 质谱条件 离子源为ESI源;检测方式为选择正离子监测(SIM+);CDL温度250℃;加热块温度200℃;雾化气(N2)流速1.51·min-1;干燥气(N2)流速21·min-1;检测电压1.6 kV;用于定量分析的离子分别为 m/z 479.0+(阿比朵尔)和 m/z 504.9+(内标)。
2.1.3 血浆样品预处理 在避光条件下,取大鼠血浆样品200 μl置于10 ml带塞离心试管中,加入甲醇20 μl,内标液50 μl,振摇,再加入0.1 mol·L-1的NaOH溶液200 μl和乙醚3 ml,涡旋混合3 min,4 000 r·min-1离心5 min,上清液转移至另一干燥试管中,40℃水浴中氮气吹干,残留物以100 μl甲醇溶解,超声30 s,涡旋2 min,转移至200 μl EP管中,12 000 r·min-1高速离心10 min后,上清液20 μl进样HPLC-MS系统分析。
2.1.4 受试药物的配制 分别精密称取盐酸阿比朵尔原料药0.018、0.036、0.108 g,先加无水乙醇0.2 ml使其完全溶解,再用氯化钠注射液稀释至20 ml,摇匀,得浓度分别为0.9、1.8、5.4 g·L-1的盐酸阿比朵尔混悬液,新鲜配制,用于灌胃给药。
2.1.5 药代动力学研究 18只♂ Wistar大鼠,随机分成3组,每组6只,分别以9、18、54 mg·kg-1剂量灌胃方式给药,并于给药前(0 h)和给药后0.033、0.083、0.17、0.25、0.5、0.75、1、2、4、6、8、9、12 h由眼眶静脉丛取血0.5 ml于肝素预处理过的离心试管中,4 000 r·min-1离心5 min,分离上层血浆,-20℃保存待测。
2.2 结果
2.2.1 色谱质谱行为 取大鼠空白血浆200 μl,按“1.2.3”项下操作(不加入内标)进样20 μl,得色谱图Fig 2A;将一定浓度的标准溶液和内标溶液加入空白血浆中,同法操作,得色谱图Fig 2B。阿比朵尔和内标物的保留时间分别为3.4 min和3.7 min。取大鼠灌胃给药后的血浆样品,同法操作,得色谱图Fig 2C。结果表明,血浆中的内源性物质和药物的代谢产物对血浆中阿比朵尔和内标的测定均无干扰。
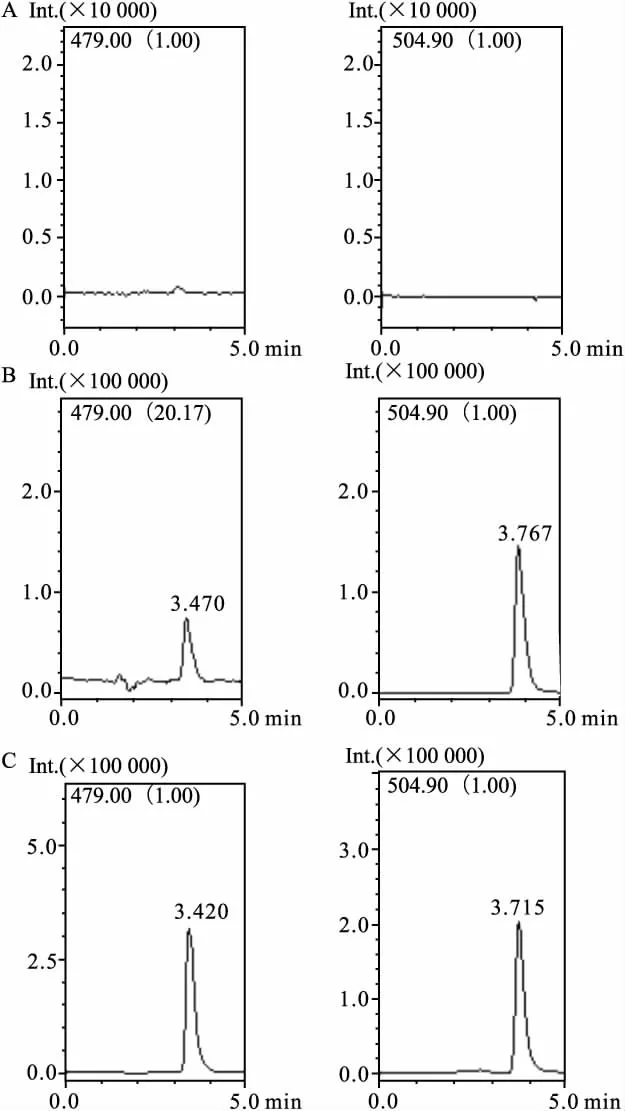
Fig 2 Typical SIM chromatograms of arbidol and IS in plasma samples
2.2.2 标准曲线与定量下限 取大鼠空白血浆200 μl,分别加入阿比朵尔标准系列溶液20 μl,制成相当于阿比朵尔浓度为1、2.5、10、100、500、1 000 μg·L-1的模拟血浆样品,除不加入甲醇外按“1.2.3”项下操作,进样20 μl,记录色谱图,以阿比朵尔浓度(X)为横坐标,阿比朵尔与内标物的峰面积比值(Y)为纵坐标,用加权最小二乘法进行回归运算,求得的直线回归方程为:^Y=1.88 X ×10-3+1.08×10-2(r=0.9973,n=3)。阿比朵尔在1~1 000 μg·L-1范围内呈现良好线性关系,定量下限为1 μg·L-1。
2.2.3 精密度和准确度 取大鼠空白血浆200 μl,按“1.2.3”项下操作制成低、中、高3个浓度(2.5、100、800 μg·L-1)的质量控制(QC)样品,每个浓度6样本分析,连续测定3 d,根据当日的标准曲线,计算QC样品的测得浓度。对测定结果进行方差分析,考察方法的日内与日间精密度,结果见Tab 1,方法的准确度和精密度均符合生物样品测定的相关要求。
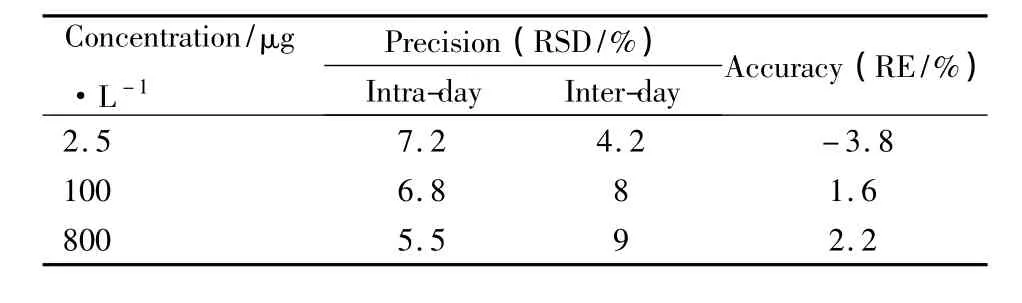
Tab 1 Intra-and inter-day precision and accuracy(n=6)
2.2.4 提取回收率 取大鼠空白血浆200 μl,按“2.2”项下操作制成低、中、高3个浓度(2.5、100、800 μg·L-1)的模拟血浆样品,进样分析,每个浓度6样本,以提取后的阿比朵尔峰面积与未经提取的标准液直接进样获得的相应浓度色谱峰面积之比,考察方法的绝对提取回收率。3种浓度下药物的平均提取回收率分别为87%、74.2%、72.1%;RSD分别为7.7%、9%、8%。同法测定内标的提取回收率为80%,RSD为8%。结果表明,方法回收率良好。
2.2.5 稳定性实验 取大鼠空白血浆200 μl,按2.2项下操作制成低、中、高3个浓度(2.5、100、800 μg·L-1)的模拟血浆样品,进样分析,每个浓度3样本,考察血浆样品室温放置4 h,-20℃冻藏30 d和经历3次冻融循环周期后的稳定性。结果表明,含有阿比朵尔的血浆样品在上述条件下稳定性良好。结果见Tab 2。
2.2.6 药代动力学 采用上述已建立的分析方法测定9、18 mg·kg-1剂量组的血浆样品;54 mg· kg-1剂量组的血浆样品依照课题组前期建立方法测定[4]。得到的药动学数据经DAS 2.0软件处理,单剂量灌胃(9、18、54 mg·kg-1)给予大鼠盐酸阿比朵尔后,药物在大鼠体内的主要药动学参数如Tab 3所示,平均血药浓度–时间曲线如Fig 3。

Fig 3 Mean plasma concentration-time curves for arbidol in rat plasma(n=6)
低、中、高3个剂量组分别灌胃给予大鼠盐酸阿比朵尔后,各个剂量组的平均Cmax分别为(644.1± 543.9)、(1002±298)、(4711±2361)μg·L-1。将得到的Cmax数据对剂量作相关分析,结果表明:药物的Cmax在实验剂量范围内具有线性动力学特征(r= 0.814 2,P<0.001);以梯形法计算0到t时刻的AUC0-t,将上述3个剂量组的药物AUC0-t数据对剂量作相关分析,结果表明:药物的AUC0-t在实验剂量范围内具有线性动力学特征(r=0.8397,P< 0.001);各剂量组的数据经秩和检验分析差异无显著性(P>0.05)。
Tab 2 Stability of arbidol in rat plasma(±s,n=3)

Tab 2 Stability of arbidol in rat plasma(±s,n=3)
Concentration spiked/μg·L-1thaw stability Bias(RE%) Short-term room temperature stability(4 h) Freeze and Bias(RE%) Long-term cold storage stability(30 d) Bias(RE%) 2.5 2.5±0.3 0.58 2.3±0.1 -7.9 2.4±0.1 -5.7 100 91.3±1.3 -8 110.5±0.5 10 109.4±1.9 -9 800 737.7±26.3 -7.8 789.8±1.5 -1.3 901±14 12
Tab 3 Pharmacokinetic data of arbidol in rats following oral administration of single dose(±s,n=6)
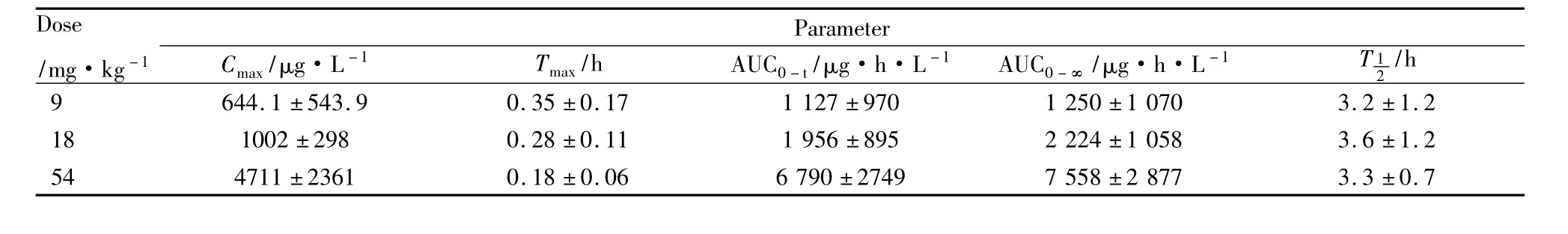
Tab 3 Pharmacokinetic data of arbidol in rats following oral administration of single dose(±s,n=6)
Dose /mg·kg-1 /h 9 644.1±543.9 0.35±0.17 1 127±970 1 250±1 070 3 Parameter Cmax/μg·L-1 Tmax/h AUC0-t/μg·h·L-1 AUC0-∞/μg·h·L-1 T 1 2.2±1.2 18 1002±298 0.28±0.11 1 956±895 2 224±1 058 3.6±1.2 54 4711±2361 0.18±0.06 6 790±2749 7 558±2 877 3.3±0.7
3 讨论
据报道,阿比朵尔溶液对光线敏感[5]。实验中考察了光线对盐酸阿比朵尔甲醇溶液稳定性的影响。将浓度为100 g·L-1的盐酸阿比朵尔甲醇溶液置于室温日光下照射6 h后测定,其药物含量仅为初始的12%,其降解过程符合一级动力学规律(r= 0.991 8),半衰期为2 h。但是,盐酸阿比朵尔溶液只对日光敏感,而室内照明光线对其稳定性却无明显影响,故推测该降解过程主要系紫外线导致,并提示在其相关剂型开发过程中应采取避光材料包装。
考察拟开发的新药是否有发展前途,优良的药代动力学参数是重要的指标之一[6]。盐酸阿比朵尔在大鼠体内吸收迅速,灌胃给药20 min后血药浓度即出现最大值。分别单次灌胃给予大鼠低、中、高(9、18、54 mg·kg-1)3个剂量的盐酸阿比朵尔后,其在动物体内的药物动力学行为具有线性特征,在实验的剂量范围内Cmax和AUC0-t均呈现剂量依赖式的增长趋势。各剂量组间的经非参数检验差异没有显著性,说明在实验的剂量范围内药物可以在大鼠体内正常的代谢并顺利消除,即使在高剂量时仍未发现明显的蓄积和饱和现象,暗示其临床使用安全性良好。
[1] Semenenko T A,Selkova E P,Gotvianskaia T P,et al.Characteristics of the immune ststus in specific and nonspecific prophylaxis of influenza in elderly persons[J].Zh Mikrobiol Epidemiol Immunobiol,2005(6):24-8.
[2] Beliaev A L,Burtseva E I,Slepushkin A N,et al.Arbidol-a new drug for prevention of influenza and acute viral respiratory infections in children[J].Vestn Ross Akad Med Nauk,1996,9(8): 34-7.
[3] 洪丽萍,陈云飞.预防和治疗儿童流感、急性病毒性呼吸道感染的化学药物–阿比朵尔[J].上海医药,2007,28(9):409-11.
[3] Hong L P,Chen Y F.Prevention and treatment of influenza in children,acute viral respiratory infections of chemical drugs-arbidol[J].Shanghai Med Pharm J,2007,28(9):409-11.
[4] Liu X,Chen X H,Zhang Y Y,et al.Determination of arbidol in rat plasma by HPLC-UV using cloud-point extraction[J].J Chromatogr B,2007,856:273-7.
[5] Metz R,Muth P,Ferger M,et al.Sensitive high-performance liquid chromatographic determination of arbidol,a new antiviral compound,in human plasma[J].J Chromatogr A,1998,810:63-9.
[6] 杨昭毅,魏 伟.药代动力学药效动力学结合模型研究进展[J].中国药理学通报,2005,21(8):918-22.
[6] Yang S Y,Wei W.Advance in pharmacokinetics/pharmacodynamics modeling[J].Chin Pharmacol Bull,2005,21(8):918-22.
