HPLC-MS法测定大鼠血浆中双-O-甲基四氢呋喃愈创木素B的浓度及药代动力学参数
2012-02-10徐春蕾刘史佳居文政
徐春蕾,刘史佳,居文政,陈 勇,张 芳,李 祥
(1.南京中医药大学药学院,江苏南京 210023;2.南京中医药大学附属医院临床药理科,江苏南京 210029)
中药三白草(Saururus chinensis)具有利尿消肿,清热解毒的功效,临床主要用于治疗水肿、小便不利,外治疮疡肿毒,湿疹[1]。植物化学和药理学研究表明黄酮和木脂素类是三白草中主要生物活性物质,具有广泛的药理和生物化学活性[2-3],如抗癌[4]、抗炎[5]、抗氧化[6]等。双-O-甲基四氢呋喃愈创木素B(DiB,Fig 1)是三白草根中含量最高的四氢呋喃型倍半木脂素,具有较好的抗氧化活性[6]。
有关DiB的药代动力学研究文献尚未见报道。本研究首次采用HPLC-MS联用技术,建立简便、快速、高效的体内分析方法,研究DiB在大鼠体内的药代动力学过程,为其在体内的吸收和代谢等进一步研究提供参考。
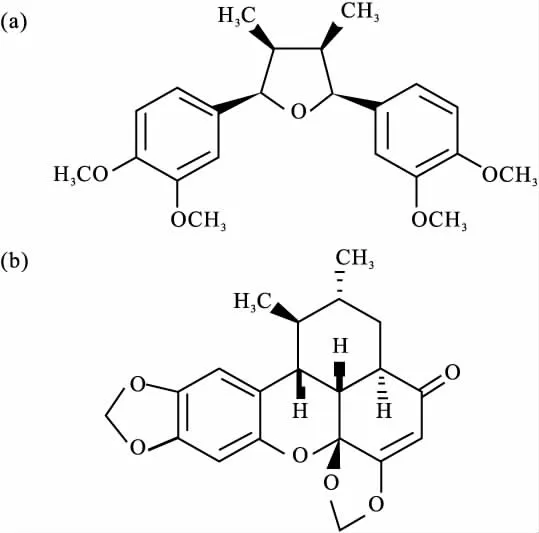
Fig 1 Chemical structures of DiB(a) and intetnal stardand sauchinone(b)
1 材料
1.1 试药 DiB和三白草酮对照品(纯度﹥98.0%,本实验室从三白草中分离得到,经1H-NMR,13C-NMR确定结构,HPLC测定纯度),甲醇、乙酸乙酯为色谱纯,水为超纯水。其余试剂为分析纯。
1.2 仪器 Waters 2695液质联用仪(美国Waters公司),色谱工作站:Mass Lynx 4.1;梅特勒-托利多 AE240电子天平(上海梅特勒-托利多有限公司);Thermo Micro 17冷冻高速离心机(美国Thermo公司);Millipore Drict-Q5超纯水机(法国Millipore公司);WH-2微型漩涡混合仪(上海沪西分析仪器厂);LABCONCOC真空离心浓缩机(美国Thermo公司)。
1.3 动物 Sprague-Dawley(SD)大鼠6只(♂),体质量(210±10)g,由南京中医药大学动物中心提供,合格证号: SCXK(苏)2008-0004。
2 方法与结果
2.1 给药方案
2.1.1 静脉给药溶液的配制 用甘油-乙醇-水(体积比为5∶5∶90)配制成2.5 g·L-1的DiB溶液,临用前配制。
2.1.2 给药与样品采集 SD大鼠6只,给药前12 h禁食不禁水,分别尾静脉注射DiB溶液10 mg·kg-1,于给药前及给药后0.08、0.17、0.25、0.33、0.67、1、1.5、2、3、5、7、10 h,眼眶静脉丛采血约0.3 ml于肝素化的1.5 ml离心管中,2 400×g离心5 min,取上层血浆,置-20℃保存待测。
2.2 对照品溶液的配制
2.2.1 DiB对照品溶液的配制 精密称取适量DiB,用甲醇配制成1.0 g·L-1的储备液。精密吸取适量,用甲醇分别稀释成0.25、0.5、1.0、2.5、5.0、10、25和50 mg·L-1的标准系列溶液,于4℃保存,备用。
2.2.2 内标溶液的配制 精密称取适量三白草酮对照品,用甲醇溶解并稀释至1.5 mg·L-1,于4℃保存,备用。
2.3 血浆样品预处理 在1.5 ml离心管中加入室温解冻后的血浆样品90 μl,内标溶液10 μl,0.5 ml乙酸乙酯,混悬3 min后于13 800×g离心5 min,取上清液于35℃真空离心浓缩至干,再加入100 μl甲醇复溶,混旋2 min后,13 800×g离心5 min,取上清液进样。
2.4 色谱及质谱检测条件 色谱柱:Agilent Zorbax SB-C18 (150 mm×2.1 mm,5 μm),保护柱Agilent Zorbax SB-C18 (12.5 mm×2.1 mm,5 μm),流动相:甲醇-水(80∶20,V/ V),流速:0.2 ml·min-1,柱温:35℃。离子化方式为电喷雾(ESI),选择性离子检测(SIR),检测离子为正离子。DiB和三白草酮均为[M+Na]+,m/z分别为395.4和379.4。毛细管电压:3.2 kV,锥孔电压:50 V,离子源温度:110℃,脱溶剂温度:350℃,脱溶剂气体(N2)流速:450 L·h-1。
2.5 方法学验证
2.5.1 方法专属性 本色谱条件下,DiB和三白草酮的保留时间约为4.63和5.90 min(Fig 2)。采用选择性离子检测方式,其专属性强,灵敏度高,血浆中杂质不干扰样品的测定。
2.5.2 标准曲线的制作与最低定量限(LLQD)考察 分别吸取“2.2.1”项下的系列标准溶液和“2.2.2”项下的内标溶液10 μl,加入到80 μl空白血浆中,配制成相当于DiB浓度分别为0.025、0.05、0.10、0.25、0.50、1.0、2.5和5.0 mg· L-1,内标浓度为0.15 mg·L-1的血浆样品。按“2.3”项下操作,以血浆中DiB的浓度为横坐标(X),以DiB和内标峰面积的比值为纵坐标(Y),用最小二乘法回归运算,得直线回归方程:Y=3.4750X+0.0065,r=0.998 5。结果表明DiB浓度在0.025~5.0 mg·L-1间线性关系良好。按以上条件测得血浆中DiB的最低定量限为0.025 mg·L-1。
2.5.3 准确度、精密度考察 分别吸取“2.2.1”项下的相应浓度标准溶液和“2.2.2”项下的内标溶液10 μl,加入到80 μl空白血浆中,配制成相当于DiB浓度分别为0.025、0.25、2.5 mg·L-1,内标浓度为0.15 mg·L-1的低、中、高3个浓度的质量控制样品(Quality control,QC),按“2.3”项下操作,以当日标准曲线计算QC样品的测得浓度,以测得浓度平均值/配制浓度×100%表示准确度,以相对标准偏差表示精密度。结果表明,日内、日间准确度分别为98.7% ~105.8%(RSD≤6.6%,n=5)和93.2% ~101.9%(RSD≤10.0%,n=3),实验数据表明,测定大鼠血浆中DiB的分析方法符合“guidance for Industry:Bioanalytical Method Validation(FDA,May 2001)”的相关规定。

Fig 2 Chromatograms of DiB 1 and IS 2
2.5.4 稳定性考察 经考察低、中、高3个浓度(0.025、0.25、2.5 mg·L-1)的QC样品在反复冻融3次,-20℃贮存2周,室温放置24 h条件下测定结果见Tab 1,说明在测定条件下样品稳定。2.5.5 提取回收率和介质效应[7,8]配制含 DiB浓度为0.025、0.25、2.5 mg·L-1的 QC样品,不加内标,其余按“2.3”项下操作测定,得峰面积A1。取空白血浆,不加内标,其余按“2.3”项下处理后,再分别加入相应浓度(0.025、0.25、 2.5 mg·L-1)的DiB标准液进行测定,得峰面积A2。提取回收率=A1/A2×100%。取与空白血浆等量的水,加入相应浓度的DiB标准液进行测定,得峰面积A3。介质效应= A2/A3×100%。3个浓度平行5份测定,取平均值。结果表明,3个浓度的提取回收率介于91.1%~97.4%,介质效应介于62.5%~68.2%,离子抑制强度基本一致。内标的提取回收率和介质效应分别为93.8%、64.3%
2.6 大鼠体内的药代动力学 大鼠单剂量(10 mg·kg-1)注射DiB后的浓度-时间曲线见Fig 3。用DAS 2.0软件对所测数据进行处理,主要药动学参数见Tab 2。由分析结果可知,大鼠静脉注射DiB后的药动学符合二室开放模型,0-t时的表观分布容积为(11.44±2.44)mg·h·L-1,消除半衰期为(3.73±1.30)h、血浆清除率为(0.65±0.14)L·h-1· kg-1、中央室分布容积为(3.36±3.19)L·kg-1。
Tab 1 Stability data for DiB(±s,n=5)

Tab 1 Stability data for DiB(±s,n=5)
Added concentration/mg·L -1 0.025 0.25 2.5 Freeze-thaw stability/% 92.56±10.81 97.78±4.48 99.31±2.75 At room temperature for 24 h/% 96.27±7.06 99.87±4.81 100.91±2.49 At-20℃for 2 weeks/% 92.43±13.68 94.76±6.03 98.70±2.01
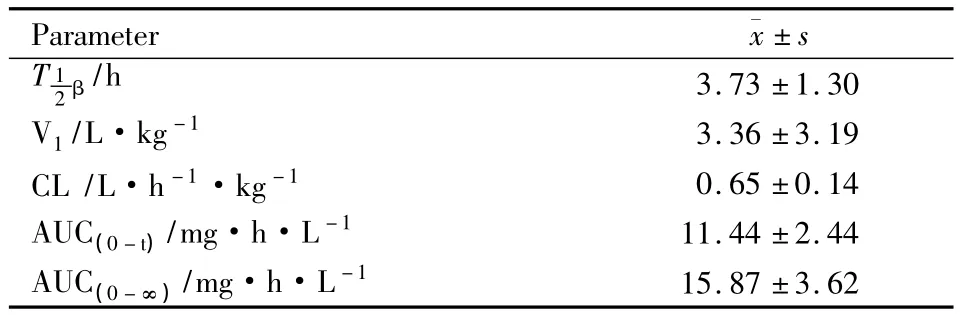
Tab 2 Main pharmacokinetic parameters of DiB following single dose of 10 mg·kg-1to rats(n=6)
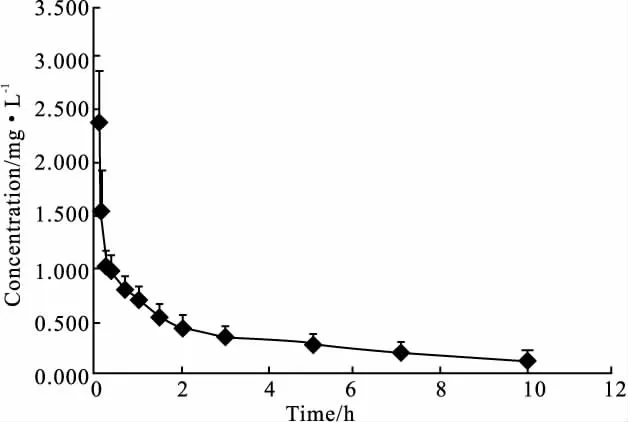
Fig 3 Mean plasma concentration versus time curve of DiB after an i.v.dose of 10 mg·kg-1to rats(n=6).
3 讨论
在优化HPLC-MS条件时,比较了不同比例的甲醇-水作流动相,结果甲醇-水为80∶20(V/V)时内标物和DiB的峰形良好,无其他物质的干扰,保留时间恰当。内标选择三白草酮,该化合物与DiB都从三白草药材的乙酸乙酯部位分离得到,两者色谱行为相近,在相同溶剂中的溶解度相近,提取回收率相近。实验中曾在正、负离子检测下分别全扫描样品和内标,发现两者在正离子模式下的加钠峰响应最高,测定结果稳定,由此确定两者的[M+Na]+为检测离子。
本实验用乙酸乙酯液液萃取法处理血浆样品,比较了甲醇、乙腈沉淀蛋白法,结果表明乙酸乙酯萃取法无内源性物质干扰,回收率高,重现性好。而沉淀法处理的样品颜色较深,杂质多,干扰重。故选用前者。
DiB是三白草中的一种重要的具有药理活性的木脂素,目前尚未有药代动力学的研究,因此建立合适的体内分析方法十分重要。HPLC-MS在对DiB血药浓度的检测显示出较强的优越性,分析时间短,灵敏度高,需用血浆量少,便于大鼠连续取血,得到稳定的数据,为DiB的进一步体内研究提供了可靠的分析方法。
[1] 国家药典委员会.中华人名共和国药典[M].一部,北京:中国医药科技出版社,2010:12.
[1] Pharmacopoeia Commission of PRC.Pharmacopoeia of the People’s Republic of China[M].Vol.1,Beijing:China Medicine Science and Technology Press,2010:12.
[2] Hwang B Y,Lee J H,Nam J B,et al.Lignans from Saururus chinensis inhibiting the transcription factor NF-kappaB[J].Phytochemistry,2003,64(3):765-71.
[3] Kang T H,Cho H,Oh H,et al.Flavonol glycosides with free radical-scavenging activity of Saururus chinensis[J].Fitoterapia,2005,76(1):115-7.
[4] Hahm J C,Lee I k,Kang W K,et al.Cytotoxicity of neolignans identified in Saururus chinensis towards human cancer cell lines[J].Planta Med,2005,71(5):464-9.
[5] Kim R G,Shin K M,Kim Y K,et al.Inhibition of methanol extract from the aerial parts of Saururus chinensis on lipopolysaccharide-induced nitric oxide and prostagladin E2 production from murine macrophage RAW 264.7 cells[J].Biol Pharm Bull,2003,26(4):481-6.
[6] 陈宏降.三白草质量标准及药效物质基础研究[D].南京中医药大学硕士学位论文,2010:134,209.
[6] Chen H J.Study on Quality Standard and Therapeutic Basis of Saururus chinensis[D].Master degree thesis of Nanjing University of Chinese Medicine,2010:134,209.
[7] Matuszewski B K,Constanzer M L,Chavez-Eng C M.Strategies for the assessment of matrix effect in quantitative bioanalytical methods based on HPLC-MS/MS[J].Anal Chem,2003,75 (13):3019-30.
[8] 刘子修,刘史佳,居文政,等.UPLC-MS法测定大鼠血浆中积雪草苷的浓度及其药代动力学研究[J].中国药理学通报,2010,26(4):543-6.
[8] Liu Z X,Liu S J,Ju W Z,et al.Pharmacokinetic study of asiaticoside in rat plasma by UPLC-MS[J].Chin Pharmacol Bull,2010,26(4):543-6.
