雌孕激素序贯性干预治疗对雷公藤多苷卵巢功能损害的保护作用
2012-02-10张丹凤徐星铭闫军放
张丹凤,郝 丽,徐星铭,闫军放,丁 楠
(1.安徽医科大学第二附属医院肾脏内科,安徽合肥 230601;2.安徽医科大学第一附属医院肾脏内科,安徽合肥 230022)
雷公藤多苷(tripteryium wilfordii polyglycosidium,TWP)是植物雷公藤的根提取物,广泛应用于肾小球疾病、风湿性疾病、肿瘤及移植等[1]。长期应用会产生肝功能受损和白细胞减少等不良反应,对性腺的损伤尤为突出,可引起月经紊乱,甚至卵巢早衰[1]。如何在充分发挥TWP疗效的同时,最大限度地降低其副作用是临床亟待解决的问题。研究发现HPT能够改善TWP所致育龄期女性卵巢功能减退或衰竭引起的围绝经期症候群,维持血清中雌激素(E2)、卵泡刺激素(FSH)和黄体生成素(LH)的正常水平,减少TWP对女性生殖系统的毒副作用[4]。
FOXL2基因是目前发现的决定卵巢分化最早的标志性启动基因,其通过转录调控作用调节靶基因转录、蛋白表达,参与颗粒细胞增殖分化。本文通过动物实验,从基因转录水平探讨HPT对TWP所致卵巢早衰的影响。
1 材料和方法
1.1 实验动物 昆明♀小鼠30只,8周龄,体质量25~28 g,清洁级,由安徽医科大学实验动物中心提供。
1.2 主要材料与仪器 TWP为上海复旦复华药业有限公司产品,批号110201;戊酸雌二醇(补佳乐)为法国先灵公司生产,广州先灵药业有限公司分装,批号20110501;醋酸甲羟孕酮片为上海华联制药有限公司产品,批号:20110701;孕马血清促性腺激素(PMSG)购自内蒙古赤峰博恩药业有限公司;人绒毛膜促性腺激素(HCG)购于宁波激素二厂(每支1000IU);性激素测定药盒由天津九鼎生物工程公司提供;逆转录试剂盒、PCR试剂和Taq DNA聚合酶均产自美国Fermentas公司。ABI7500型荧光定量PCR仪为美国ABI公司产品;GSM凝胶图像分析管理系统为美国Sim公司Bio-pro CN-UV型产品。
1.3 方法
1.3.1 分组 选取30只♀昆明系小鼠适应性饲养1周后,按体重随机分3组(每组10只),灌胃给药。
1.3.2 给药 Control组:每天给予等量生理盐水;TWP组: TWP 20mg·kg-1·d-1;TWP+HPT组:TWP 20 mg·kg-1· d-1+HPT(给予戊酸雌二醇0.2 mg·kg-1·d-1,至d 4,再加用醋酸甲羟孕酮片1.5 mg·kg-11次,两药同时停用1 d后重复下一疗程),5 d/每疗程,共17疗程。每周按体重调整给药量[3-4]。
1.3.3 促排卵处理 17个疗程后,对3组小鼠均进行促排卵处理:腹腔注射孕马血清促性腺激素(PMSG)10 U,48 h后腹腔注射人绒毛膜促性腺激素(HCG)10U,16~18 h后处死,取卵巢称重及颗粒细胞的收集,采用眼球摘除取血法取血,静置2 h后,2 500 r·min-1离心5 min,留取血清待检。
1.3.4 血清性激素的测定 ELISA法测定血清中雌激素(E2)、黄体生成素(LH)和卵泡刺激素(FSH)的水平。
1.3.5 卵巢称重及颗粒细胞的收集 将取出的卵巢剥离周围脂肪和被膜后,用滤纸吸干,万分之一天平称湿重,按公式计算卵巢指数:卵巢指数/%=卵巢湿重(mg)/体重(g)× 100%;参照文献进行颗粒细胞收集[5]。
1.3.6 实时荧光定量PCR法检测卵巢颗粒细胞FOXL2 mRNA的表达 按照TRIzol试剂盒说明书提取总RNA,紫外分光光度仪检测其质量和浓度。按照逆转录试剂盒说明,冰上操作将不同时间点的RNA逆转录成cDNA。再以逆转录出的cDNA为模板建立反应体系(20 μl)。引物由TaKaRa公司合成,序列如下:FOXL2(扩增片段长度73 bp)Forward primer 5'-GCGGACGCGCAGTCAAAGAGG-3',Reverse primer 5'-TTCT CCGGTGTTGTCCCGCCT-3'。GAPDH(扩增片段长度173 bp)Forward primer 5'-ACGGCACAGTCAAGGCCGAG-3',Reverse primer 5'-ACCCTTCAAGTGGGC CCCGG-3'。反应体系如下:总体积20 μl:2×Goldstar Taqman mixture 10 μl,DEPC H2O 7.2 μl,probe 0.8 μl,cDNA 0.2 μl。反应条件: 95℃ 10 s,接以40个循环:95℃ 15 s,0℃ 1min。实验采用3个复孔并同时扩增GAPDH作为内参照。反应结束后,用7500 Fast Real-time PCR System软件分析,绘制PCR定量标准曲线,mRNA水平以相对定量(relative quantification,RQ)表示。
1.3.7 统计学处理 采用SPSS 16.0统计软件,实验数据以±s表示。多组间比较用方差分析。
2 结果
2.1 TWP和HPT联合用药对小鼠血清性激素的影响 实验结束时30只小鼠全部存活。与Control组相比,TWP组小鼠卵巢分泌的E2水平明显下降,垂体分泌的FSH、LH水平明显升高,性激素变化差异有统计学意义(P<0.01)。HPT组小鼠血清性激素水平与Control组相比变化无差异,与TWP组相比,E2水平明显升高,垂体分泌的FSH、LH水平明显下降,具有统计学意义(P<0.01,Tab 1)。
Tab 1 Changes of levels of serum gonadal hormone in each group(±s,n=30)

Tab 1 Changes of levels of serum gonadal hormone in each group(±s,n=30)
**P<0.01 TWP vs control,△△P<0.01 TWP+HPT vs TWP
Group E2/ng·L-1 LH/IU·L-1 FSH/IU·L -1 Control 6.9940±0.4971 1.2130±0.1529 1.3750±0.1018 TWP 5.0600±0.5319**1.8960±0.2051**1.8690±0.1348**TWP+HPT 6.6400±0.8721△△1.3480±0.1642△△1.4010±0.1663△△
2.2 TWP和HPT联合用药对小鼠卵巢指数的影响 与Control组相比,TWP组小鼠卵巢指数明显下降(P<0.01),而TWP+HPT组小鼠卵巢指数则无明显差异(P>0.05),结果见Tab 2。
Tab 2 Changes in humid index of ovaries(±s,n=10)
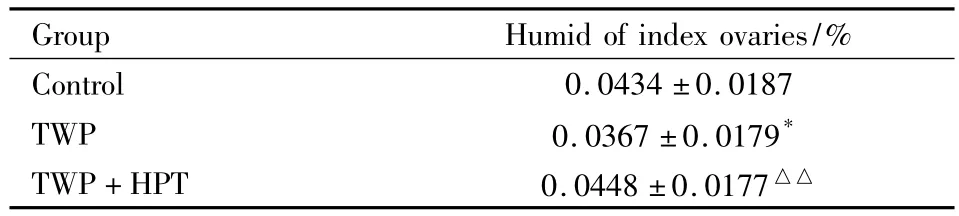
Tab 2 Changes in humid index of ovaries(±s,n=10)
**P<0.01 TWP vs control;△△P<0.01 TWP+HPT vs TWP
Group Humid of index ovaries/% Control 0.0434±0.0187 TWP 0.0367±0.0179* TWP+HPT 0.0448±0.0177△△
2.3 TWP和HPT联合用药对小鼠卵巢mRNA的影响 Fig 1显示,与Control组相比,TWP组FOXL2 mRNA转录水平下降,其2-ΔΔCt值仅为0.473,差异具有统计学意义(P<0.05);与TWP组相比,TWP+HPT组FOXL2 mRNA拷贝数增高,其2-ΔΔCt值为0.781,且差异具有统计学意义(P<0.05)。
4 讨论
TWP多环节的免疫抑制作用,使它在治疗免疫性疾病中有着独特的地位,并在临床应用中已取得了良好的疗效[6]。但TWP对卵巢细胞毒副作用,使其在育龄和育龄前患者的长期维持性治疗中受到很大限制。本研究结果显示,TWP组小鼠卵巢指数明显下降,同课题组另一病理研究发现TWP组小鼠卵巢组织受损明显,卵泡较小,各级卵泡均有明显的减少,且闭锁卵泡增多[7]。卵巢功能表现为高促性腺激素型受损,E2分泌明显减少,血清FSH、LH水平明显升高,提示雷公藤多苷对卵巢组织结构及下丘脑-垂体-性腺轴均有明显损害。本实验将从维持卵巢功能方面发挥重要作用的人类常染色体基因—FOXL2基因着手,探讨其损伤机制。研究表明[8],FOXL2基因位于3号染色体的3q23区域,在成年小鼠的卵泡细胞中高度表达,是卵泡的维持和颗粒细胞的分化必需基因,在FOXL2突变的小鼠,颗粒细胞不能完全转换为立方形,从而导致次级卵泡的缺失及卵母细胞的闭锁,进而影响卵巢功能[9]。另外,FOXL2的失活则会增加StAR、CYP19、CYP11A和CCND2基因在小卵泡和未成熟卵泡中的表达从而加速卵泡的发育,导致原始卵泡增多,出现卵巢早衰[10-11]。本实验发现,TWP组小鼠FOXL2 mRNA转录下调,提示TWP可能通过干扰FOXL2 mRNA转录从而导致小鼠出现卵巢早衰表型。
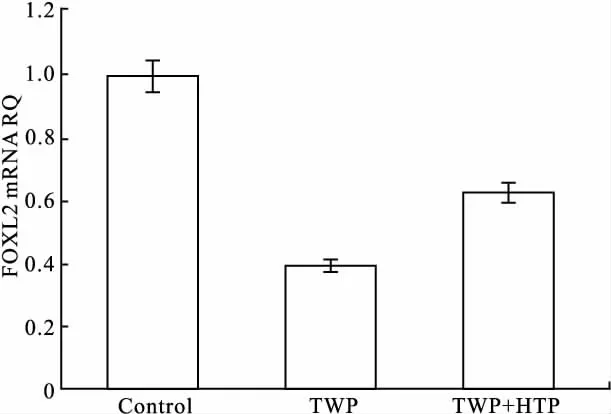
Fig 1 FOXL2 mRNA expression levels from different groups(±s,n=10)
雌孕激素序贯性替代治疗广泛应用于防治卵巢早衰及绝经后相关症状[4]。对TWP致继发性POF患者给予HPT,可以改善低性激素水平,维持月经及第二性征,有效率达90.47%[2]。本实验根据正常小鼠周期及体内性激素水平的变化[12],在应用TWP的同时伍用HPT,结果显示,E2性激素水平和卵巢指数升高,LH和FSH水平降低,FOXL2 mRNA拷贝数增加,提示HPT对TWP所致雌性小鼠卵巢损伤有较好的保护作用,可以上调小鼠颗粒细胞FOXL2 mRNA转录,从而促进卵泡的生长发育。
[1] Tao X,Cush J J,Garret M,et al.A phase I study of ethyl acetate extract of the chinese antirheumatic herb Tripterygium wilfordii hook F.in rheumatoid arthritis[J].J Rheumatol.2001;28(10): 2160-7.
[2] 郝 丽,卢 文,林 辉,等.雌孕激素替代治疗TW所致卵巢早衰的疗效观察[J].中华肾脏病杂志,2005,21(3):143-5
[2] Hao L,Lu W,Lin H,et al.Efficacy of estrogen combined with progestogen replacement therapy on patients with secondary premature ovary failure induced by Triptergium wilfordii[J].Chin J Nephrol,2005,21(3):143-5
[3] 徐叔云,卞如濂,陈 修.药理实验方法学[M].北京:人民卫生出版社,2006:202-4.
[3] Xu S X,Pian R L,Chen X.Methodology of pharmacological experiment[M].Beijing:People's Medical Publishing House,2006:202-4.
[4] The North American Menopause Society.The 2012 hormone therapy position statement of the north American Menopause Society[J].J North Am Menop Soc,2012,19(3):257-71.
[5] 王 妍,赵晓娥,杨培先,等.小鼠卵巢颗粒细胞的体外培养[J].西北农林科技大学学报:自然科学版,2007,35(8):11-4.
[5] Wang Y,Zhao X E,Yang P X,et.al.Culture of mouse granulosa cells in vitro[J].J Northwest A&F Univ(Nat.Sci.Et),2007,35(8):11-4.
[6] 黎磊石,刘志红.应用TW治疗肾炎二十五载的体会[J].肾脏病与透析肾移植杂志,2003,12(3):246-7.
[6] Li L S,Liu Z H.Application of Tripterygium wilfordii in treating nephritis twenty-five years experience[J].J Nephrol Dialy Transplant,2003,12(3):246-7.
[7] 闫军放,郝 丽,张丹凤,等.雷公藤多苷及雌孕激素替代对小鼠卵巢Fas和FasL蛋白达的影响[J].中国医科大学学报,2012,41(8):688-91.
[7] Yan J F,Hao L,Zhang D F,et,al.Effect of Tripterygium Wilfordii and estrogen progestin replacement on mouse ovarian Fas and FasL protein Tat effect[J].J China Med Univ,2012,41(8): 688-91.
[8] Crisponi L,Deiana M,Loi A,et al.The putative forkhead transcription factor FOXL2 is mutated in blepharophimosis/ptosis/epicanthus nversus syndrome[J].Nat Genet,2001,27:159-66.
[9] Schmidt D,Ovitt C E,Anlag K,et al.The murine winged-helix transcription factor Foxl2 is required for granulose cell differentiation and ovary maintenance[J].Development,2004,131:933-42.
[10]Pisarska M D,Bae J,Klein C,et al.Forkhead l2 is expressed in the ovary and represses the promoter activity of the seroidogenic acute regulatory gene[J].Endocrinology,2004;145:3424-33.
[11]BentsiBarnes I K,Kuo F T,Barlow G M,et al.Human forkhead L2 represses key genes in granulosa cell differentiation including aromatase,P450scc,and cyclin D2[J].Fertil Steril,2009,94 (1):3536.
[12]孙敬方,邵义祥,邹振伟,等.动物实验方法学[M].北京:人民卫生出版社,2004:423-42.
[12]Sun J F,Shao Y X,Zou Z W,et al.Animal experimental method[M].Beijing:People's Medical Publishing House,2004:423-42.
