26-失碳-8-氧代-α-芒柄花萜醇对体外培养成骨细胞活性的影响
2012-02-03王朝元唐俊龙魏甜甜易继凌杨光忠
王朝元,宋 超,唐俊龙,魏甜甜,易继凌,杨光忠
(1中南民族大学生命科学学院,武汉430074;2中南民族大学药学院,武汉430074)
玉柏石松(Lycopodium obscurumL.),又名伸筋草,为石松科石松属植物.在土家族医学和中医中,玉柏石松等伸筋草一直被用来治疗骨折和骨质疏松等[1,2].现代临床医学研究证实,玉柏石松治疗跌打损伤及骨折有很好的临床效果[3-6],但其促进骨生长的有效成分和治疗骨折的机理尚不清楚.因此,对玉柏石松中具有成骨活性成分的研究具有重要的理论意义和临床应用前景.
早有报道[7]从玉柏石松中提取 26-失碳-8-氧代-α-芒 柄 花 萜 醇 (26-NO-Ono,26-nor-8-oxo-αonocerin),但目前26-NO-Ono的研究主要在提取工艺上,它对成骨细胞活性的研究暂无报道.因此,本实验通过研究26-NO-Ono对体外培养的成骨细胞的增殖,ALP活性及骨相关基因(骨涎蛋白、I型胶原蛋白、骨钙蛋白和骨桥蛋白)表达的影响,阐明其调控骨生长的作用和作用机理.
1 材料和方法
1.1 试剂和仪器
DMEM/High Glucose(Thermo),小牛血清(GIBCO),胰蛋白酶(Amresco),二甲基亚砜(Amresco),MTT(Amerro),ALP 试剂盒(南京建成生物科技公司),Trizol(Invitrogen),PCR引物(武汉博越技术有限公司),反转录试剂盒(Fermentas),SYBR Green荧光染料(TOYOBO)
CO2培养箱(HF90/240型,利康生物医疗科技控股集团),倒置显微镜(Motic AE21型,重庆光学仪器),酶联免疫检测仪(MULTISKAN ASCENT 354型,THERMO),可见分光光度计(721型,上海光学仪器),普通PCR仪(Biometra,德国),凝胶成像分析仪(JS-380A,上海培清科技),荧光定量PCR仪(Rotor-gene 2000,Corbett research澳大利亚).
1.2 26-NO-Ono贮存液的制备
26-NO-Ono由中南民族大学药学院杨光忠教授实验室从玉柏石松中提取并鉴定[8],为一个四环三萜化合物.称取9.15mg的26-NO-Ono粉末,溶于3.86mL的二甲基亚砜(DMSO),配制成终浓度为5.33mmol/L的溶液备用.并根据需要用培养基将其稀释至 6.66,13.32,26.64,53.28 μmol/L.
1.3 细胞培养
将新生昆明小鼠头颅剪碎,用胰酶消化后,1500r/min,离心 5min,沉淀细胞,弃上清,加入含10%小牛血清、100U/mL青霉素和100μg/mL链霉素的DMEM,吹匀后转入培养瓶中,37℃,5%CO2,饱和湿度条件下培养.待细胞80%汇合,用0.1%胰蛋白酶加0.02%EDTA(乙二胺四乙酸)消化传代.
1.4 成骨细胞增殖率的测定(MTT法)
取原代培养的成骨细胞第2代,按1.0×104细胞 /孔接种于96孔板中.置37℃的5%CO2培养箱中培养4h.待细胞贴壁后加入200μL浓度分别为3.33,6.66,13.32,26.64 μmol/L 的药液,每个浓度设5个复孔.实验设对照组,为含10%血清和与药物组中等体积的DMSO的培养基.分别培养0d(细胞接板4h贴壁后),1d,3d后每孔加入20μLMTT(5 mg/mL),置 37℃、5%CO2培养箱中反应 4h.弃上清,每孔加入150μL DMSO终止反应,反复吹打以溶解紫色结晶,置37℃培养箱中10 min后用酶标仪在490nm波长下测定每孔中紫色物质的OD值.
1.5 26-NO-Ono对成骨细胞内碱性磷酸酶(ALP)活性的影响
取原代培养的成骨细胞第2代,按2.0×104细胞/孔接种于24孔板中.细胞贴壁后换成诱导培养基(普通培养基中加入50μg/mL维生素C、10mmol/Lβ-甘油磷酸钠、10-8mol/L地塞米松)培养,分别加入3.33,6.66,13.32,26.64μmol/L 的药液,每组设3个复孔,实验设对照组同上1.4.分别培养3,6,9d后,每孔分别加入100μL 0.1%Triton X-100裂解过夜,根据ALP试剂盒的说明书操作,用酶标仪在540nm测吸光度.并用考马斯亮蓝法检测其蛋白质的含量.
1.6 26-NO-Ono对成骨细胞中骨相关基因mRNA表达的影响
取原代培养的成骨细胞第2代,按1×105细胞/孔接种于6孔板中,细胞贴壁后换成诱导培养基培养.分别加入6.66,26.64μmol/L 的药液.每组设2 个复孔,实验设对照组同上 1.4.分别培养3,6,9d后,用Trizol法提取细胞总RNA,用凝胶成像分析系统测出mRNA的灰度值,再用DEPC水将各样品mRNA的浓度调成一致(总体积≤11μL),加入1μL Oligo-dT,补足 DEPC 水至 12μL,65℃ 水浴 5min后立刻静置于冰上5min,加入5×Buffer 4μL,dNTP mixture 2μL,RNase Inhibitor 1μL,Rever Tra Ace-α 1μL混匀反转录.条件为 30℃ 10min,42℃ 30min,99℃ 5min.将上述cDNA模板中加ddH2O至70μL,取1μL 为模板,加上下游引物各 1μL,ddH2O 1μL,SYBR Green荧光染料4μL混匀,real-timePCR反应条件:95℃ 30s,58℃ 30s,72℃ 40s,40 个循环.本实验选用GAPDH为内参基因,采用相对定量分析的方法(2﹣ΔΔCt法)来检测骨相关基因的表达.不同骨相关基因PCR的引物见表1[9].

表1 荧光定量PCR引物序列Tab.1 Primer sequences for real-time PCR
1.7 统计分析
根据公式 F =2-[(待测组目的基因平均Ct值-待测组内参基因平均Ct值)-(对照组目的基因平均Ct值-对照组内参基因平均Ct值)],计算出目的基因的相对表达量.用t检验法对结果进行显著性差异分析.
2 结果与分析
2.1 26-NO-Ono对成骨细胞增殖率的影响
26-NO-Ono对成骨细胞增殖率的影响见图1.由图1可见,当处理1d时,实验组与对照组有显著性差异(P<0.01),说明各浓度的26-NO-Ono能明显促进成骨细胞的增殖,且浓度越高效果越明显.当处理3d时,各浓度的26-NO-Ono对成骨细胞的增殖没有显著的影响(P>0.05).说明26-NO-Ono对细胞增殖的影响呈时间依赖性,它通过促进细胞早期粘附贴壁等促进细胞功能.
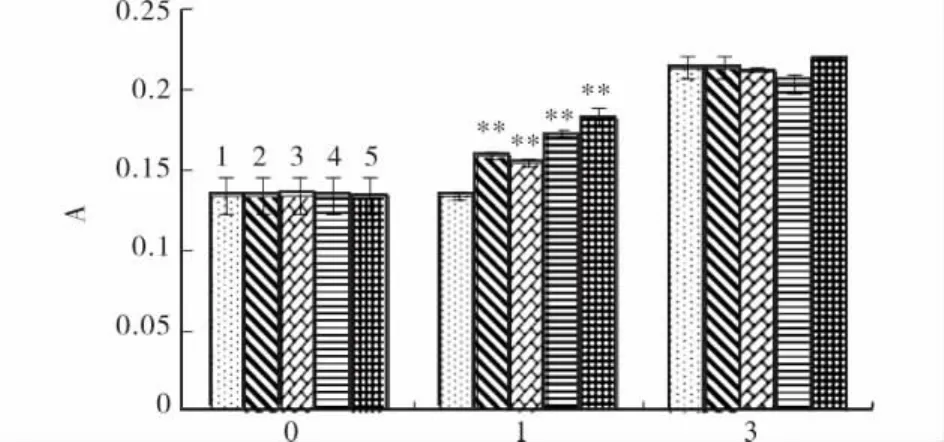
图1 26-NO-Ono对成骨细胞增殖率的影响Fig.1 Effect of26-NO-Ono on the proliferation of osteoblasts
2.2 26-NO-Ono对成骨细胞碱性磷酸酶(ALP)活性的影响
ALP是成骨细胞早期分化的标志,它的表达高峰发生在基质成熟期,有利于骨的形成[9,10].随着成骨细胞的进一步成熟,当细胞进入钙化期时,细胞内的ALP活性下降[11].图2为26-NO-Ono对成骨细胞ALP活性的影响.由图2可见,处理3d后,实验组成骨细胞ALP活性明显高于对照组,说明26-NO-Ono能促进 ALP的活性(P<0.01);第6d时,浓度为6.6μmol/L的26-NO-Ono对 ALP的活性有一定的促进作用(P<0.05),而其他浓度组的ALP活性略低于对照组ALP活性;第9d时,实验组ALP活性均显著低于对照组ALP活性(P<0.01).说明处理6d和9d时药物对ALP活性促进作用不明显甚至降低其活性,实验组成骨细胞更早的进入了钙化期。在9d内,对照组细胞的ALP活性呈增长趋势,而实验组呈下降趋势,说明26-NO-Ono处理可以使成骨细胞分泌ALP的时间提前.故26-NO-Ono能促进成骨细胞的成熟分化及钙化.

图2 26-NO-Ono对成骨细胞碱性磷酸酶活性的影响Fig.2 Effect of26-NO-Ono on Alkaline Phosphatase(ALP)activity of osteoblasts
根据上述结果,选定2个浓度(6.66μmol/L和26.64μmol/L)的26-NO-Ono进一步研究其对成骨细胞骨相关基因表达的影响.
2.3 26-NO-Ono对骨相关基因表达的影响
在骨形成过程中,成骨细胞中骨相关基因(如BSP、Col-I、OCN和OP等)的表达对成骨活性有十分重要的意义.BSP可与胶原蛋白共价结合并诱导破骨细胞里的钙离子应答,与骨重建相关[13,14];Col-I是骨中的有机基质模板,是骨基质的主要有机成分[15,16];OCN是骨质基质矿化的必需因子,维持骨组织的正常矿化,是成骨细胞中期分化的标志物[17-19].OPN在骨基质的矿化和吸收过程中起重要作用,是成骨细胞成熟分化的标志[20-23].
根据1.7中公式计算出BSP的相对表达量结果如图3.由图3可见,加26-NO-Ono培养6d时,2种浓度的26-NO-Ono均对BSP的表达有显著促进作用(P<0.05);培养3d和9d时,低浓度的26-NOOno对BSP表达有抑制作用(P<0.01),而高浓度的则既不抑制,也不促进BSP的表达.

图3 26-NO-Ono对骨涎蛋白(BSP)表达的影响Fig.3 Effect of26-NO-Ono on BSP expression of osteoblast
根据1.7中公式计算出Col-I、OCN、OPN的相对表达量结果如图4、图5和图6.由图4可见,培养6d时,2种浓度的26-NO-Ono均对Col-I的表达有显著促进作用(P<0.01);培养3d和9d时,高浓度26-NO-Ono对Col-I的表达有明显的抑制作用(P<0.01).由图5可见,培养6d时,2种浓度的26-NOOno均明显促进OCN基因的表达(P<0.05);培养3d和9d时,26-NO-Ono明显抑制OCN的表达(P<0.05).由图6可见,培养3d时,低浓度的26-NOOno对OPN表达的作用不明显,而高浓度的26-NOOno可明显促进OPN的表达(P<0.05);培养6d和9d时,高浓度26-NO-Ono对OPN基因的表达有明显抑制作用(P<0.05).
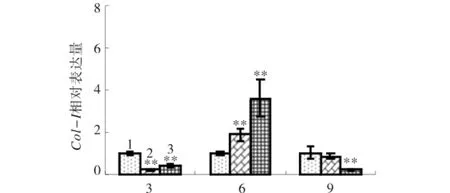
图4 26-NO-Ono对I型胶原蛋白(Col-I)表达的影响Fig.4 Effect of 26-NO-Ono on Col-I expression of osteoblast
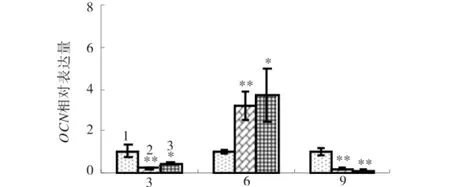
图5 26-NO-Ono对骨钙蛋白(OCN)表达的影响Fig.5 Effect of 26-NO-Ono on expression of osteoblast

图6 26-NO-Ono对骨桥蛋白(OPN)表达的影响Fig.6 Effect of 26-NO-Ono on OPN expression of osteoblast
综上所述,用不同浓度的26-NO-Ono分别培养成骨细胞 3,6,9d 后,骨相关基因BSP、Col-I、OCN和OPN的表达分别呈现不同的表达谱,说明26-NO-Ono对成骨细胞骨相关基因表达的影响与细胞增殖和分化状态有关,并呈时间和剂量依赖性.
3 结论
26-NO-Ono能促进体外培养的成骨细胞的贴壁及成骨细胞的成熟分化,对成骨细胞骨相关基因(如BSP、Col-I、OCN和OPN)表达的影响与细胞增殖和分化状态有关,并呈时间和剂量依赖性.
[1]南京药学院中草药学编写组.中草药学[M].南京:江苏科学技术出版社,1976:24.
[2]赵敬华.土家族医药学概论[M].北京:中医古籍出版社,2005:109.
[3]胡伟宏,胡绍基.阳和汤在骨伤科运用举隅[J].福建中医药,2000,13(5):47-48.
[4]郭勇飞,何 晖.骨质疏松致胸腰椎骨折综合治疗效果观察[J].广西医学,2003,25(12):2520-2521.
[5]吴富章,郭 涛,洪 星,等.陈旧性腕舟骨骨折的系统康复治疗[J].中华物理医学与康复杂志,2004,26(5):297-299.
[6]郭炳顺,祝 萍,傅君鸣.中药外洗治疗骨折124例[J].陕西中医,2001,22(12):738-739.
[7]戴克敏,潘德济,程彰华,等.伸筋草类药用植物资源的初步研究[J].植物资源与环境,1992,1(1):36-43.
[8]邓铁忠,艾 勇,陈 玉,等.玉柏石松三萜成分研究[J].药学学报,2009,44(8):891-894.
[9]Lee SU,Park SJ,Kwak H B,etal.Anabolic activity of ursolic acid in bone: Stimulating osteoblast differentiationin vitroand inducing new bone formationin vivo[J].Pharmacol Res,2008,58(5-6):290-296.
[10]陶庆树,周振雷,胡 丹,等.骨代谢标志物研究进展[J].畜牧与兽医,2006,38(2):51-53.
[11]卓丽玲,张春岭,顾建红,等.磷对体外大鼠成骨细胞增殖分化及钙化功能的影响[J].中国兽医科学,2008,38(11):997-1002.
[12]童安莉,陈璐璐,丁桂芝.成骨细胞骨形成机制研究进展[J].中国骨质疏松杂志,1999,5(3):60-64.
[13]李丛华.骨涎蛋白在组织矿化中的作用[J].国外医学口腔医学分册,2005,32(6):449-451.
[14]赵 征,金 岩,文玲英.BSP、OPN在小鼠牙胚发育中的表达[J].临床口腔医学杂志,2005,21(12):725-728.
[15]Masquelier D,Herbert B,Hauser N,et al.Morphological characterization of osteo blast-like cell cultures isolated from new born rat calvaria[J].Calcif Tissue Int,1990,47(2):92-104.
[16]Lynch M P,Stein JL,Stein GS,etal.The influence of typeⅠcollagen on the developmentandmaintenance of the osteoblast phenotype in primary and passaged rat calvarial osteoblasts:modification of expression of genes supporting cell growth,adhesion,and extra cellularmatrix mineralization[J].Exp Cell Res,1995,216(1):35-45.
[17]张金超,刘丹丹,易长青,等.金纳米粒子对成骨细胞MC3T3-E1增殖、分化和矿化功能的影响[J].科学通报,2010:55(6):435-441.
[18]徐 凌,梁 星,黄 姣,等.成骨生长肽对大鼠颅盖骨成骨细胞样细胞增殖和分化的影响[J].四川大学学报:医学版,2006,37(3):445-448.
[19]刘 介,王丽君,李 俊,等.羟基磷灰石结晶度对成骨细胞活性的影响研究[J].中国中医骨伤科杂志,2010,18(4):13-21.
[20]Sodek J,Chen J,Nagata T,et al.Regulation of osteopnontin expression in osteoblasts[J].Ann N Y Acad Sci,1995,21(760):223-241.
[21]刘 宏,王勤涛,吴织芬,等.rhBMP-2对人牙牙周细胞骨桥蛋白表达的影响[J].中华口腔医学杂志,2000,35(5):330-332.
[22]Hunter G K,Goldberg H A.Modulation of crystal formation by bone phosphoproteins:role of glutamic acidrich sequences in the nucleation of hydroxyapatite by bone sialoprotein [J]. Biochem J,1994,302(Pt1):175-179.
[23]范 哲,李鸿雁,龙 毅.骨桥蛋白的研究进展[J].中国实验诊断学,2005,9(2):307-400.
