反复自然流产患者绒毛膜组织中促血管生成素的表达变化及意义
2012-02-02莫发荣滕若冰农蔚霞周昌文刘良森沈寅琛
莫发荣,滕若冰,农蔚霞,周昌文,刘良森,沈寅琛
(1广西医科大学,南宁530021;2广西南宁市妇幼保健院)
促血管生成素(Ang)是由血管内皮细胞分泌的促血管生成的一组生长因子,依据其氨基酸序列的不同分为Ang-1、-2、-3、-4[1],其主要作用是促进血管成熟和重塑。研究[2]表明,Ang-1、Ang-2对肿瘤组织的血管新生和肿瘤细胞的浸润起促进作用,而胚胎着床过程与肿瘤细胞浸润有相似之处,若血管新生出现障碍则导致胚胎着床失败或出现妊娠并发症。本研究检测了反复自然流产(RSA)患者和健康早孕妇女绒毛膜组织组织中的Ang-1、Ang-2蛋白,观察其表达变化并探讨其临床意义。
1 材料与方法
1.1 材料
1.1.1 标本来源 随机选取37例于2010年3月~2011年7月在广西南宁市妇幼保健院妇产科行人工流产患者(人工流产组)的绒毛膜组织,患者具备以下条件:①年龄20~38岁;②非意愿妊娠需要终止妊娠;③以往无不良妊娠史;④孕期无腹痛、阴道出血和任何不适。选择33例同期在本院就诊的发生过2次或2次以上RSA患者(RSA组)的绒毛膜组织,患者具备以下条件:①年龄20~38岁;②无染色体异常;③无子宫畸形;④无内分泌异常;⑤无血栓形成倾向;⑥流产非免疫因素、感染因素引起。两组患者孕周<12周,排除全身或生殖系统急性炎症及各种良、恶性肿瘤和血管异常增生等有可能影响Ang表达的疾病。
1.1.2 试剂来源 抗Ang-1多克隆抗体(北京博奥森),Ang-2多克隆抗体(北京博奥森),辣根过氧化物酶(HRP)标记的山羊抗兔二抗(上海长岛生物公司),DAB显色试剂盒和苏木素复染液(福建迈新生物公司),其余化学试剂均为国产分析纯。
1.2 绒毛膜组织中Ang-1、Ang-2蛋白的检测方法按常规石蜡切片制作方法将绒毛膜组织标本制成石蜡切片,厚度为6 μm。石蜡切片经脱蜡水化后,行免疫组化染色。切片经0.01 mol/L(pH 6.0)柠檬酸盐缓冲液高压修复5 min后自然冷却。3% H2O2阻断内源性过氧化物酶,免疫前血清封闭非特异性抗原。抗Ang-1多克隆抗体和抗Ang-2多克隆抗体稀释度均为1∶400,4℃孵育过夜。按免疫组化试剂盒说明依次加HRP标记的羊抗兔IgG和底物。DAB染色、苏木素复染、常规脱水、透明、封片。以正常非免疫兔血清取代一抗作阴性对照,以PBS取代一抗作空白对照。Ang-1、Ang-2蛋白位于绒毛膜上皮细胞中,呈棕黄色颗粒。经病理图像分析系统(德国LEICA)在高倍镜(×400)下拍片取图,用Image-Pro Plus Version 6.0图像分析软件对每张切片阳性区域进行定量检测,测定阳性产物的积分光密度值(IOD值)。阳性反应越强,染色越深,IOD值越大。
1.3 统计学方法 采用SPSS13.0统计软件。计量资料比较用t检验,相关性分析用Pearson直线相关分析法。P≤0.05为差异有统计学意义。
2 结果
2.1 两组绒毛膜组织中Ang-1、Ang-2蛋白的表达比较 人工流产组37例中有31例绒毛膜组织可见Ang-1蛋白呈阳性反应(阳性率83.8%),有36例可见Ang-2蛋白呈阳性反应(阳性率97.3%);RSA组33例中有31例绒毛膜组织可见Ang-1蛋白呈阳性反应(阳性率93.9%),Ang-2蛋白均呈阳性反应(阳性率100%)。所有阳性反应均见于绒毛膜上皮细胞。两组阳性率比较,P>0.05。两组绒毛膜组织中Ang-1、Ang-2蛋白的IOD值比较见表1。
表1 两组绒毛膜组织中Ang-1、Ang-2蛋白的IOD值比较(±s)
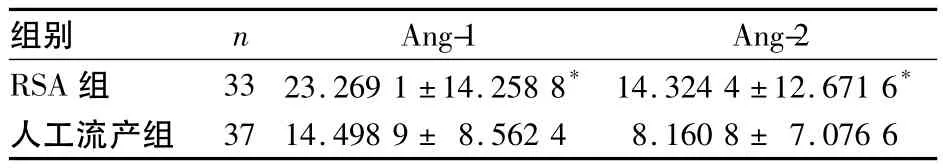
表1 两组绒毛膜组织中Ang-1、Ang-2蛋白的IOD值比较(±s)
注:与人工流产组相比,*P<0.05
?
2.2 绒毛膜组织中Ang-1、Ang-2蛋白表达与孕妇年龄的关系 RSA组绒毛膜组织Ang-1蛋白的表达随孕妇年龄增加而上调,但无统计学意义(r= 0.326,P>0.05);Ang-2蛋白表达随孕妇年龄增加而下调,但也无统计学意义(r=-0.039,P>0.05)。人工流产组绒毛膜组织Ang-1、Ang-2蛋白的表达均随孕妇年龄增加而下调,无统计学意义(r分别为-0.079、-0.230,P均>0.05)。
2.3 胚胎孕周与绒毛膜组织中Ang-1、Ang-2蛋白表达的关系 RSA组绒毛膜组织中Ang-1、Ang-2蛋白的表达与胚胎孕周呈正相关(r分别为0.497、0.430,P均 <0.05)。人工流产组绒毛膜组织中Ang-1、Ang-2蛋白的表达随胚胎孕周增加而增加,但无统计学意义(r分别为0.204、0.227,P均>0.05)。
3 讨论
RSA是一种常见病,发病率约为1%,但超过50%的RSA找不到明确的原因。目前,对RSA病因的研究还只限于细胞遗传学、激素或代谢、子宫解剖、感染因素和自身免疫功能异常等方面,但这只是一部分。妊娠从胚泡着床到胎盘形成都离不开血液的营养供应,离不开血管新生及其通透性的改变。胎儿、胎盘及子宫蜕膜血管的生长发育是胚胎正常生长发育的关键,成功的妊娠要求胎盘血管网的充分发育以满足母胎之间气体和养料的交换及胎儿代谢废物的排泄。胎盘的血管生成最初发生在妊娠第19天,是妊娠早期新生血管形成的主要方式,完整的胎儿毛细血管网出现在妊娠第22天前后。因此,如果胎盘血管发育不足,将影响胎儿营养的供给,胚胎难以存活,导致流产的发生[3]。
Ang的主要作用是促进血管成熟和重塑,是继血管内皮生长因子(VEGF)之后发现的又一内皮细胞特异性的促血管生成因子[4]。Ang家族主要通过与Tie-2相互作用而参与调节血管的发生、发展等过程。Tie-2受体是特异性表达于内皮细胞和某些激酶型造血祖细胞的酪氨酸激酶型受体,在胚胎时期的血管内皮呈均匀表达[5],Hur等[6]研究发现,Ang-1和Ang-2竞争Tie-2,Ang-1促进血管稳定而Ang-2促进血管活化并促进新生血管生成,Ang-2在与VEGF结合后通过阻断Ang-1对血管的稳定作用而促进血管出芽。
本研究结果显示,37例人工流产患者中31例的绒毛膜组织可见Ang-1蛋白呈阳性反应,有36例可见Ang-2蛋白呈阳性反应;33例RSA患者中有31例绒毛膜组织中可见Ang-1蛋白呈阳性反应,Ang-2蛋白均呈阳性反应。所有阳性反应均见于绒毛膜上皮细胞,而且RSA患者绒毛膜组织Ang-1蛋白和Ang-2蛋白的表达高于人工流产绒毛膜组织。提示Ang-1蛋白和Ang-2蛋白的正常表达有助于胚胎正常生长发育,过度表达则血管出现缺陷而导致胚胎死亡[7,8]。本研究结果显示,两组绒毛膜组织的Ang-1、Ang-2蛋白表达与孕妇年龄无关,但RSA患者绒毛膜组织的Ang-1、Ang-2蛋白表达与胚胎孕周呈正相关,随胚胎孕周的增加而增加,这与马华刚等[9]的研究一致。我们推测,Ang-1蛋白和Ang-2蛋白的高表达可能是造成RSA的原因之一。
[1]Valenzuela DM,Griffiths JA,Rojas J,et al.Angiopoietins 3 and 4: diverging gene counterparts in mice and humans[J].Proc Natl Acad Sci USA,1999,96(5):1904-1909.
[2]Feng Q,Liu K,Liu YX,et al.Plasminogen activators and inhibitors are transcribed during early macaque implantation[J].Placenta,2001,22(2-3):186-199.
[3]沈寅琛.促血管生成素与血管生成及妊娠的相关性研究进展[J].海南医学,2010,21(15):111-113.
[4]杜彬,周序珑.血管生成素的特点及其对血管新生的调节作用[J].中国病理生理杂志,2003,19(2):275.
[5]Macdonald PR,Progias P,Ciani B,et al.Structure of the extracellular domain of Tie receptor tyrosine kinases and localization of the angiopoietin-binding epitope[J].J Biol Chem,2006,281(38): 28408-28414.
[6]Hur SE,Lee JY,Moon HS,et al.Angiopoietin-1,Angiopoietin-2 and tie-2 expression in eutopic endometrium in advanced endometriosis[J].Mol Hum Reprod,2006,12(7):421-426.
[7]Charnock-Jones DS.Soluble flt-1 and the angiopoietins in the development and regulation of placental vasculature[J].J Anat,2002,200(6):607-615.
[8]傅晓敏,王雯,黄丽丽.药物流产后异常子宫出血者子宫内膜中血管生成素1、2的表达[J].解剖学报,2007,38(6):752-754.
[9]马华刚,朱桂金.促血管生成素-1,-2基因在小鼠着床期子宫内膜的表达[J].现代妇产科进展,2005,14(3):203-205.