不同数目骨髓间充质干细胞移植对大鼠肺损伤的抑制作用
2012-02-01赵科研王辉山侯明晓孙江滨吴慧颖柳克祥
赵科研,王辉山,侯明晓,孙江滨,吴慧颖,柳克祥
(1.中国人民解放军沈阳军区总医院心血管外科,沈阳 110016; 2.吉林大学第二医院心血管外科,长春 130041)
肺动脉高压(pulmonary artery hypertension,PAH)是顽固性和致死性疾病,肺血管阻力进行性增高,最终导致右心衰竭而死亡,是严重的内皮功能障碍的血管疾病。人们尝试再生手段打断 PAH的恶性循环,移植骨髓细胞,如内皮祖细胞、内皮样祖细胞和基质干细胞,以再生健康的内皮细胞,显示了初步的疗效[1-3]。野百合碱是豆科植物野百合中提取的生物碱,具有细胞毒性作用,代谢产物通过肺脏时沉积于肺小动脉壁及肺毛细血管,导致对肺血管的损伤,破坏肺组织内皮细胞等,导致肺动脉高压,常做为制作肺动脉高压模型的药物[4]。对于不同MSCs数量移植的安全性,以及移植对MCT诱导肺血管损伤的抑制效应如何尚不明确,本文对此研究。
1 材料和方法
1.1 实验动物
清洁级雄性W istar大鼠(3周,60~70 g),成年雄性W istar大鼠60只,体重(180~250)g,均由吉林大学实验动物中心提供(SCXK[吉]2008-0005)。
1.2 主要仪器和试剂
全自动显微镜数码摄像系统(OLYMPUS,日本),LEICA病理切片机(德国),多功能病理图象分析仪(同济),BL-420E+生物机能实验系统(成都泰盟科技有限公司),流式细胞仪(Becton Dickinson美国)。低糖DMEM培养基(Gibco公司),特级胎牛血清(Gibco公司),胰酶(Sigma公司),亚美尼亚仓鼠抗大鼠CD29-Alexa Fluor(Biolegend公司),小鼠抗大鼠CD45-FITC(Biolegend公司),小鼠抗大鼠CD44-PE(Santa Cruz公司),小鼠抗大鼠CD34 -FITC(Santa Cruz公司),平滑肌 Actin免疫组化试剂盒(武汉博士德)。
1.3 方法
1.3.1 MSCs的分离、培养和鉴定
W istar大鼠幼鼠断颈处死,酒精浸泡15 m in,无菌条件下分离股骨、胫骨,DMEM培养液冲洗骨髓腔。洗涤,沉淀以含10%胎牛血清的DMEM混悬,接种在100 m L培养瓶中,5%CO2,37℃下培养。24~48 h后换液,每2~3 d更换一次培养基,相差显微镜观察细胞融合情况。细胞80%融合后0.25%胰酶消化,计数并传代。收获第3代细胞,CD29-Alexa Fluor、CD34-FITC、CD44-PE、CD45-FITC鉴定,流式细胞仪检测。3~5代MSCs以0.25%的含EDTA的胰酶收获,PBS冲洗,以 PBS悬浮细胞1000个/μL,置于冰上直到进行移植。
1.3.2 不同细胞数量静脉移植对正常大鼠 RVSP的影响
采用正常健康雄性大鼠20只,依据移植MSCs个数分为5×105组、1×106组、5×106组和对照(生理盐水)组,每组5只。大鼠颈部正中切口,游离左侧及右侧颈外静脉,通过右侧颈外静脉插管至右心室检测RVSP,通过左侧颈外静脉注入不同数目MSCs,测量细胞移植前、移植后5 m in,30 min及 24 h的RVSP。
1.3.3 动物分组
成年雄性 W istar大鼠 40只,分为 4组:①MCT/MSCs 5×105组;②MCT/MSCs 1×106组;③MCT组;④对照组。MCT组给予野百合碱60 mg/ kg,腹腔注射,对照组注入等量盐水。全麻后固定大鼠,颈部正中切口,游离右侧颈外静脉,1 m L注射器给予MSCs或等量PBS溶液(MCT组和对照组),4周后进行测压、取材。
1.3.4 移植4周后大鼠RVSP测量
移植4周后,暴露右颈外静脉1 cm,3F婴幼儿穿刺鞘管(美国COOK公司)进行改良,头部呈弧形弯曲,由颈外静脉至前腔静脉、右心房缓缓推入右心室,根据压力波形观察测定RVSP。
1.3.5 心室比测量
测RVSP后处死大鼠,取出心脏,沿房室沟剪除心房组织,沿室间隔右心室边缘分离右心室,用滤纸吸去血液,称湿重,计算右心室/(左心室 +室间隔),并以此作为右心室肥大的指标。
1.3.6 移植后肺组织形态学观察
大鼠处死后由主支气管灌注中性福尔马林固定缓冲液,使肺组织膨胀固定20 m in,后切下肺组织浸泡中性福尔马林液中,48 h后取材做石蜡切片,厚约5μm,每个肺组织标本取5支肺泡水平肺小动脉,行HE染色、平滑肌 actin免疫组化染色和弹力纤维地衣红染色。弹力纤维染色图片采用200倍光镜观察,采集图像后分别测定内、外弹力板的平均直径,根据公式计算中膜厚度百分比[5]:WT%=(2 ×WT/ED)×100%。
1.3.7 统计学处理
采用SPSS 11.0软件,右心室压力、心室重量比及肺小动脉中膜厚度百分比均用 ±s表示,各个组值之间进行单因素方差分析。
2 结果
2.1 MSCs培养结果、鉴定
骨髓细胞接种于培养瓶后,约6~8 h可见间充质干细胞贴壁,呈圆形或多角形,2~3 d后可见细胞呈短梭形、短棒状或星形;6~7 d左右见细胞呈集落状生长,放射状排列;约14 d细胞几乎长满培养皿底,呈鱼群、旋涡状分布。传代后的细胞生长迅速,多为梭形,贴壁快,24 h便可全部贴壁、伸展,呈均匀分布、增殖,3~4 d可见细胞融合生长为单层。第3代MSCs表面标记物CD29,CD44,CD34和CD45的阳性率分别为 98.6%,78.2%,0.0%,0.3%(图1)。
2.2 不同数量MSCs静脉移植对正常大鼠RVSP的变化
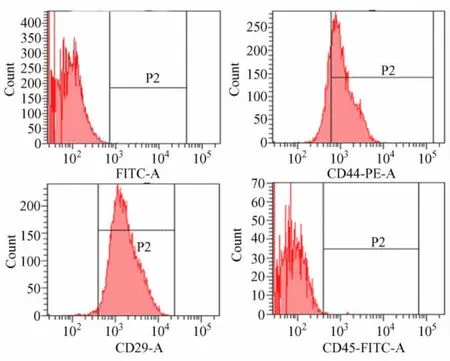
图1 MSCs表面标志物流式细胞仪检测结果Fig.1 Results of the marks of MSCs by flow cytometry
5×105个MSCs与生理盐水对照组进行大鼠静脉内移植是安全的,几乎不导致明显的RVSP的增加。注射1×106个 MSCs到颈外静脉5 min后,RVSP从(22.3 ±4.4)mmHg到(35.8 ±5.6) mmHg,30 min后 RVSP增加达到(44.2 ±4.5) mmHg;24 h后,RVSP为下降为(27.8 ± 3.6) mmHg,与生理盐水对照组相比,会有残存的压力增加(图2),但相对安全;但在移植5×106个MSCs 5 min内有 2只死亡,剩余 3只 RVSP分别为 45.3 mmHg、49.4 mmHg和51.2 mmHg,24 h又一只死亡,剩余2只RVSP36.2 mmHg、41.3 mmHg,静脉移植不安全。
2.3 移植后RVSP及心室比的改变
MCT组4周后 RVSP为(47.2±10.5)mmHg,心室比(0.4454±0.0935),而对照组4周后RVSP (25.2±4.0)mmHg,心室比(0.2348±0.0212),前者右心室压力明显增加(P>0.05)、右心室肥厚(P >0.05);MCT/MSCs 1×106组4周后RVSP为(35.6±8.4)mmHg,心室比(0.3572±0.0923)与MCT组相比均明显下降(P<0.05),而MCT/MSCs 5×105组 RVSP为(42.5 ±11.3)mmHg,心室比(0.4003±0.0725),与单纯MCT组相比均下降不明显(P>0.05)(图3和4)。
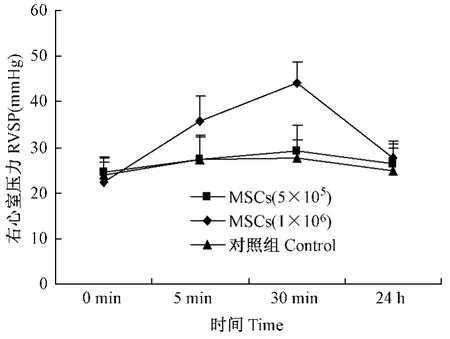
图2 正常大鼠移植不同数目MSCs后不同时间右心室压力的变化Fig.2 Changes of RVSP with time after different numbers of MSCs’transplantation in normal rats

图3 MSCs移植后4周后右心室收缩压的变化Fig.3 Changes of RVSP after four weeks of MSCs’transp lantation

图4 MSCs移植后4周后右心室/ (左心室+室间隔)重量比的变化注:*表示差异显著;△表示差异不显著Fig.4 Changes of RV/(LV+S)ratio after four weeks of MSCs’transplantationNote:* significant difference;△ no significant difference
2.4 移植后肺组织病理变化
2.4.1 HE染色:
对照组肺动脉管壁菲薄,内皮细胞扁平连续,细胞分布均匀,大小厚薄较一致;MCT组肺小动脉壁增厚伴玻璃样变,管腔狭窄甚至闭塞,大量炎性细胞浸润,以淋巴细胞为主;小血管壁正常结构丧失,有纤维素样渗出,管周有淋巴细胞浸润,肺泡壁上毛细血管淤血,肺间质增厚;MCT/MSCs 1×106组与MCT组相比弹力纤维变薄,而MCT/MSCs 5×105组亦变薄,但无MCT/MSCs 1×106组明显(彩插2图5)。
2.4.2 平滑肌actin免疫组织化学染色:
正常对照组平滑肌染色,中层厚度很薄;MCT组中层平滑肌明显增厚;MCT/MSCs 1×106组及MCT/MSCs 5×105组平滑肌actin染色均较MCT变薄(彩插2图6)。
2.4.3 弹力纤维染色:
正常对照组肺腺泡内小动脉内外弹力板(花边样)呈深棕色,中层不增厚,管腔无狭窄;MCT组中层增厚,管腔呈狭窄;MCT/MSCs 1×106组与 MCT组相比中层变薄,而MCT/MSCs 5×105组亦变薄,MCT/MSCs 1×106组明显(彩插2图7)。结果显示,正常对照组肺小动脉中层厚度百分比(10.1± 1.1)%,MCT组中层厚度百分比(26.4±4.9)%,MCT/MSCs 1×106组中膜厚度(19.2 ±3.8)%较MCT组明显变薄(P <0.05),而 MCT/MSCs 5× 105组中膜厚度(23.3 ±3.6)%与 MCT组相比无统计学意义(P>0.05)(图8)。

图8 MSCs移植后4周后肺小动脉中膜厚度百分比.注:*表示差异显著;△表示差异不显著Fig.8 Percentage of wall thickness of the pulmonary arterioles after four weeks of MSCs’transplantationNote:* significant difference;△ no significant difference
3 讨论
我们研究认为采用5×105个 MSCs、1×106个MSCs进行颈外静脉移植是安全的,不会导致严重的血流动力学变化。经过颈外静脉移植的细胞经过前腔静脉、右心房、右心室、肺动脉到达肺微小动脉,定植于此发挥作用。Campbell等[6]研究从静脉移植细胞后,脾、肝和骨骼肌组织,没有发现有荧光信号的细胞,细胞以高度选择方式到阻力前毛细血管床,这正因为肺是生理的解剖滤器,相对大的粒子例如悬浮细胞会定植于肺的微血管,这对治疗某一肺动脉血管疾病非常有用。颈外静脉移植细胞导致RVSP升高,是因为悬浮细胞多,会导致肺微小动脉的栓塞,从而使肺动脉压力及RVSP升高。因此较少的细胞形成的栓塞少所以影响小,而1×106个MSCs移植后RVSP升高后逐渐下降,可能是部分细胞与肺动脉内皮可黏附、迁移入血管内腔,或移植细胞的丢失,导致肺小动脉的栓塞减少而使 RVSP在24 h后下降。Sachiko等[7]认为更多的细胞注射可能导致更多的肺小动脉栓塞致RVSP急性严重升高,血流动力学变化明显以致循环不稳定,所以死亡率较高。
Ortiz等[8]认为骨髓间充质细胞可以定植于博莱霉素损伤的肺,尽管观察到的数量较少,但是该细胞展现了上皮细胞样形态,降低肺部炎症及胶原沉积,而且移植的细胞在肺组织中长期存在,表现出高度的可塑性,并保留其分化基因的能力而发挥作用[9,10]。而移植骨髓间充质干细胞的实验研究较少,Nagaya等[11]培养人脐带血单核细胞,获取的内皮祖细胞,移植MCT诱导的肺动脉高压大鼠左颈外静脉,2周后,检测到大鼠肺血管阻力下降16%,平均肺动脉压力下降14%。我们在MCT诱导大鼠肺动脉高压的同时进行MSCs移植,发现1×106MSCs进行静脉内移植,可以明显降低RVSP,减轻了肺动脉压力升高导致的右心室肥厚,还可以使肺小动脉中层厚度明显变薄,不论从血流动力学还是病理形态上均证实可以明显抑制肺动脉高压形成的严重程度,而且较5×105个MSCs移植效果明显。
关于干细胞移植对肺动脉高压作用机制复杂。首先,移植的干细胞可以整合到肺血管的内皮细胞层,分化为内皮细胞,修复内皮缺损。Nagaya等[11]静脉移植表达绿色荧光蛋白的内皮祖细胞,发现该细胞可以掺和到MCT诱导大鼠的肺小动脉和毛细血管中,分化为成熟的内皮细胞;其次,存在大量的证据证实骨髓来源的细胞具有刺激各种组织血管新生的能力,这主要通过基因标志的骨髓移植得到的结论;再次,就是干细胞的自分泌和促进临近细胞分泌细胞因子的能力。内皮细胞可以像输注巨噬细胞一样可以分泌生长因子,并不融合到血管,从而使缺血后侧枝血流轻度增加[12]。
近年来,已有各种干细胞联合基因转染治疗肺动脉高压的报道。Zhao等[13]采用腹主动脉-下腔静脉分流法10周诱导大鼠肺动脉高压,分离人外周血内皮细胞培养,质粒转染降钙素基因相关肽,由大鼠颈外静脉移植,4周后平均肺动脉压及总肺血管阻力均下降。因此骨髓间充质干细胞静脉内移植是治疗肺动脉高压的良好尝试,可以应用于各种原因导致的肺动脉高压,是良好的种子细胞,还可以转染基因增加治疗的效果。考虑到如此众多的肺动脉高压患者,即使很少的个体受益,也会带来明显的影响。
[1]Jiang Y,Jahagirdar BN,Reinhardt RL,et al.Pluripotency of mesenchymal stem cells derived from adultmarrow[J].Nature,2002,418(6893):41-49.
[2]Zhao YD, Courtman DW, Deng Y, et al. Rescue of monocrotaline-induced pulmonary arterial hypertension using bone marrow-derived endothelial-like progenitor cells[J].Circ Res,2005,96(4):442-450.
[3]何志旭,汪浩文,尚峰,等.骨髓间充质干细胞移植治疗肺动脉高压大鼠肺血管病变的研究[J].中国输血杂志.2009,22(3):180-184.
[4]Hayashi Y,Hussa JF,Lalich JJ.Corpulmonale in rats[J].Lab Invest,1967,16(6):875-880.
[5]刘斌,王献民,魏丽,等.4种肺动脉高压动物模型肺血管重构模式的差异研究[J].中国病理生理学杂志,2008,24 (2):289-293.
[6]Campbell AIM,Kuliszewski MA,and Stewart DJ.Cell-Based Gene Transfer to the Pulmonary Vasculature Endothelial Nitric Oxide Synthase Overexpression Inhibits Monocrotaline-Induced Pulmonary Hypertension[J].Am JRespir Cell Mol Biol,1999,21(5):567-575.
[7]Sachiko KH,Hitoshi H,Shigetoshi M,et al.Implantation of Mesenchymal Stem Cells Overexpressing Endothelial Nitric Oxide Synthase Improves Right Ventricular Impairments Caused by Pulmonary Hypertension[J].Circulation,2006,114(Sup.1): I-181-I-185.
[8]Ortiz LA,Gambelli F,McBride C,et al.Mesenchymal stem cell engraftment in lung is enhanced in response to bleomycin exposure and ameliorates its fibrotic effects[J].Proc Natl Acad Sci USA,2003,100(14):8407-8411.
[9]Grove JE,Lutzko C,Priller J,et al.Marrow-derived cells as vehicles for delivery of gene therapy to pulmonary epithelium[J].Am JRespir Cell Mol Biol,2002,27(6):645-651.
[10]Kotton DN,Ma BY,Cardoso WV,et al.Bone marrow-derived cells as progenitors of lung alveolar epithelium [J].Development,2001,128(24):5181-5188.
[11]Nagaya N,Kangawa K,Kanda M,et al.Hybrid cell-gene therapy for pulmonary hypertension based on phagocytosing action of endothelial progenitor cells[J].Circulation,2003,108(7): 889-895.
[12]Ward MR,Stewart DJ,Kutryk MJ.Endothelial progenitor cell therapy for the treatment of coronary disease,acute MI,and pulmonary arterial hypertension: current perspectives[J].Catheter Cardiovasc Interv,2007,70(7):983-998.
[13]Zhao Q,Liu Z,Wang Z,et al.Effect of Prepro-Calcitonin Gene-Related Peptide-Expressing Endothelial Progenitor Cells on Pulmonary Hypertension[J].Ann Thorac Surg,2007,84(2): 544-552.
