慢性间断性缺氧伴二氧化碳潴留小鼠模型的建立
2012-02-01刘海林张子彦郭云云李景春宋永斌徐江涛
刘海林,张子彦,郭云云,李景春,宋永斌,徐江涛
(兰州军区乌鲁木齐总医院神经内科,乌鲁木齐 830000)
睡眠呼吸暂停综合征(sleep apnea syndrome,SAS)的病理生理机制本质上是一个慢性间断性缺氧伴二氧化碳潴留(chronic intermittent hypoxia with carbon dioxide retention,CIH-CR)的过程。大量的研究表明,SAS是多种疾病的独立危险因素,可导致心、肺、肾、脑及血液等器官或系统损害[2]。建立理想的SAS动物模型对研究其发病机制及治疗有重要意义。本研究旨在建立一种成本低廉、操作简便、易于推广、符合SAS病理生理学特征CIH-CR的动物模型。
1 材料和方法
1.1 实验动物及分组
SPF级健康雄性昆明种小白鼠,购自新疆医科大学实验动物中心,动物合格证[SCXK(新)2003-0001],体重18~22g,共22只。分为常氧(normal control,NC)及CIH-CR组,每组11只。
1.2 实验仪器
自制实验仓(包括:有机玻璃、继电器、微动电极、牵引器、不锈钢套管);CY212C型测氧仪(浙江电化分析仪器厂),EM-21型便携式二氧化碳检测仪(连云港金升科技有限公司),PC-68B血氧饱和度仪(深圳市科瑞康实业有限公司)。
1.3 实验方法
1.3.1 CIH-CR实验仓及其工作原理:本实验仓规格为45.3×22.0×4.9 cm。仓底部有通气孔并与打好孔的不锈钢套管相连,通过两个牵引器控制通气孔的开启与关闭,关闭(缺氧处理)与开启(复氧处理)时间由两个继电器控制,开启与关闭时间可依实验需要调整,达到给予小鼠反复缺氧/复氧自动循环的目的。二氧化碳检测仪固定于仓内,实验仓顶端预留测氧孔。实验期间小鼠活动自如,自由饮食。
实验仓工作原理:关闭实验仓时,小鼠呼吸仓内有限的O2排出CO2造成低O2和CO2潴留,然后使实验仓与外界相通形成复氧,O2和CO2浓度迅速恢复正常水平。循环时间由继电器自动控制,每次循环150s,其中关闭时间为120s,开启时间为30 s,每天8 h(10∶00~18∶00),其余时间置小鼠饲养笼,室温、空气、正常饮食。NC组每日同时置相同规格有机玻璃箱内,箱内开放,不形成缺O2和CO2潴留。间断性缺氧实验过程中箱内气体浓度由二氧化碳检测仪和测氧仪监测。
为了验证实验仓的效果,测定10只小鼠在此间断缺氧条件下尾部末端SO2变化情况,方法为:先将小鼠用苯巴比妥钠30 mg/kg腹腔注射麻醉,放入实验仓中,尾部通过预留孔伸出仓外,使用血氧饱和度仪测尾部末梢SO2。
1.3.2 右室肥厚指数计算:实验小鼠腹腔内注射戊巴比妥钠30 mg/kg体重,直接开胸切取心脏,在房室瓣水平去除心房、大血管和心包组织,沿室间隔分离左心室(包括室间隔)和右心室,冰盐水冲洗干净,清洁滤纸吸干水份后称左心室(含室间隔)湿重和右心室湿重,计算右心室湿重/左心室(含室间隔)湿重(RV/LV+S),即为右心室心肌肥厚指数[3]。
1.3.3 病理观察:实验终点取小鼠心、肺、肾、脑组织以10%的甲醛固定、石蜡切片、常规HE染色,光镜观察。
1.4 统计学处理
实验数据应用SPSS16.0统计软件处理,采用均数±标准差(±s)表示,两独立样本t检验,以P<0.05为差异有显著性。
2 实验结果
2.1 CIH-CR实验仓内O2浓度、CO2浓度和小鼠尾部末端SO2周期性变化动态测定结果
实验仓内 O2浓度、CO2浓度和小鼠尾部末端SO2见表1及图1,图2,图3。
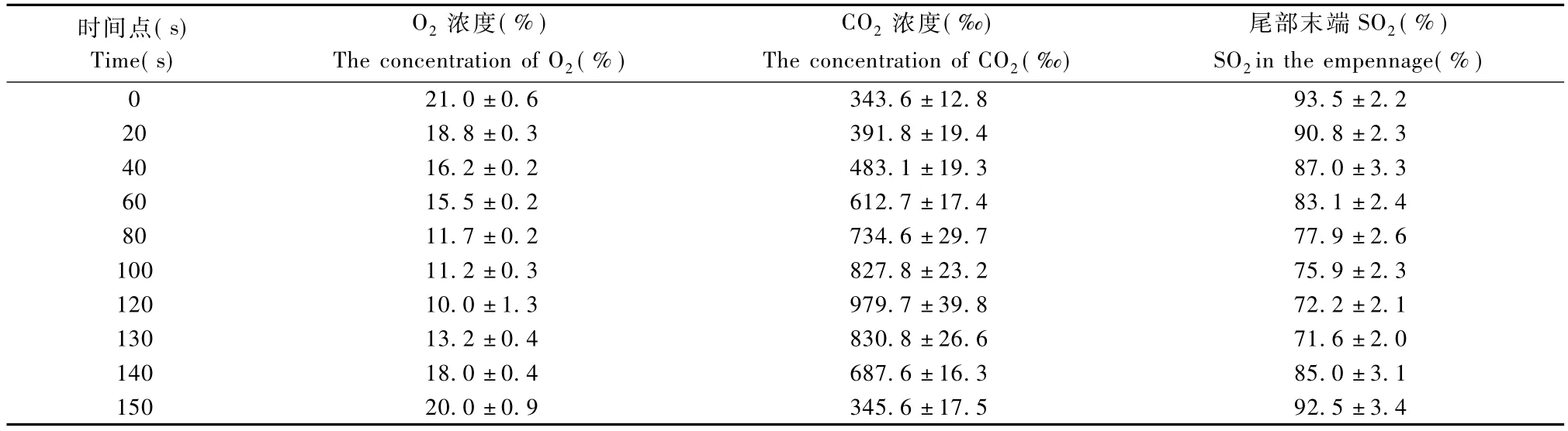
表1 10个循环周期中缺氧箱内各个时间点O2浓度(%)、CO2浓度(‰)及小鼠尾部末端SO2(%)Tab.1 The concentration of O2,CO2 and the SO2 in the empennage ofmouse in the cabin in 10 cycle
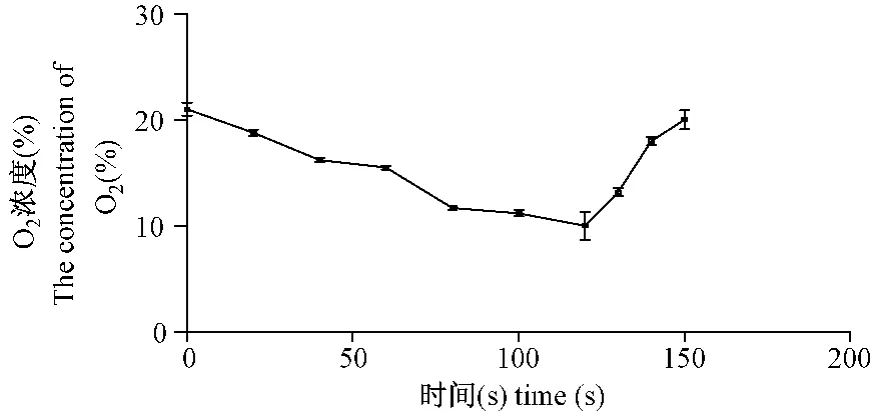
图1 箱内O2浓度变化趋势Fig.1 The change trend of O2 concentration in the cabin

图2 箱内CO2浓度变化趋势Fig.2 The change trend of CO2 concentration in the cabin

图3 小鼠尾部末端血SO2变化趋势Fig.3 The change trend of the SO2 in the empennage ofmouse in the cabin
2.2 CIH-CR组小鼠右室肥厚指数的影响
NC组和CIH-CR组小鼠右室肥厚指数分别为0.21±0.03和0.30±0.02,与NC组相比,CIH-CR组小鼠右心肥厚指数明显升高(P<0.01)。
2.3 心、肺、肾和脑组织HE染色结果
2.3.1 小鼠心肌组织病理学改变:NC组小鼠心肌组织结构正常,肌纤维排列规则,间质无明显水肿。CIH-CR组小鼠心肌细胞可见核肿胀,间质水肿,偶见轻度嗜酸性变,见封3图4~5。
2.3.2 小鼠心组织病理学改变:NC组组胞壁薄,血管壁较光滑,与对照组比较,CIH-CR组小鼠肺泡腔体积变小,血管扩张充血,肺间质增多,肺泡间质毛细血管增多,见封3图6~7。
2.3.3 小鼠肾脏组织病理学改变:NC组肾小球、肾小管细胞及上皮细胞排列整齐,胞浆均匀;CIH-CR组肾小球肾小管上皮肿胀,管腔消失,部分肾小管内有蛋白管型,见封3图8~9。
2.3.4 小鼠脑组织病理学改变:NC组神经元 大小、形态正常;CIH-CR组性神经元明显增加,细胞肿胀突出,胞浆空泡增大,细胞皱缩,胞体深染,见封3图10~11。
3 讨论
目前,在已发表的SAS动物模型中,不同的实验缺氧-复氧循环时间30~300 s不等,每天总缺氧时间5~8 h不等,缺氧累计天数14~70 d不等,最低O2浓度3% ~10%不等。对二氧化碳是否潴留观点不一[4-8],不同研究者的实验方案重复性和可比性较差。造成低氧的方式主要是向缺氧装置中冲入氮气或压缩空气与混合气体[7,9],可以对缺氧时间及程度精确控制,但仪器成本较高,不利于推广。
本实验采用小鼠作为 CIH-CR模型的实验动物,根据小鼠昼伏夜出的习性,每天间断缺氧在日间进行(10∶00~18∶00)。在间断缺氧箱密闭后,由于小鼠呼吸箱内有限O2,排出CO2,箱内O2浓度逐渐降至 10% ±1.3%,CO2浓度逐渐升至979.7±39.8%。给予通气后箱内 O2浓度在120 s左右迅速升高至 20% ±0.9%,CO2浓度降至343.6±12.8%。同时检测血氧饱和度发现,缺氧最低点时 SO2为71.2±2.1%,当恢复至正常氧浓度时SO2为93.5±2.2%,类似于SAS患者血氧浓度变化曲线,说明该模型能模拟SAS的血氧特点。本实验结果显示,4周后模型组小鼠右心室明显肥大(P<0.01),提示4周的 CIH-CR循环可模拟 SAS。并且组织病理学表现符合低氧后改变,进一步从形态学角度说明本研究制备了可靠的SAS小鼠模型。
我们的实验是通过小鼠的自主呼吸耗竭O2,产生CO2,符合SAS逐渐缺氧和高CO2的生理过程。本实验箱通过电控阀控制箱的开启和闭合,可调节缺氧时间,从而可根据需要制作不同程度的SAS模型。实验箱在电极转换调控阀门时产生一定的声音,不断干扰小鼠的睡眠,符合SAS对睡眠结构产生影响的过程。箱内刚好容纳22只小鼠,此空间小鼠耐受良好,便于观察小鼠呼吸及自主运动情况,且可以成批复制小动物模型。本模型设计简单,成本低廉,易于推广。
总之,虽该实验箱存在一些缺点,但因其符合SAS病理过程,设计简单,成本低廉,不失为一种理想的SAS模型实验箱。
[1]郭彦红,姬秋和,张丙芳.阻塞性睡眠呼吸暂停综合征与IL -6关系的研究[J].西北国防医学杂志,2002,23(1):21 -22.
[2]李景春,徐江涛.睡眠呼吸暂停综合征啮齿动物模型的研究进展[J].现代生物医学进展,2009,9(12):2377-2379.
[3]Nattie EE,Doble EA.Threshold of intermittent hypoxia-induced right ventricular hypertrophy in the rat[J].Respir Physiol.1984,56(2):253-259.
[4]Fletcher EC,Lesske J,Qian W,et al.Repetitive,episodic hypoxia causes diurnal elevation of blood pressure in rats[J].Hypertension,1992,19(6Pt1):555-561.
[5]Fagan KA.Selected Contribution:Pulmonary hypertension in mice following intermittent hypoxia[J].JAppl Physiol,2001,90 (6):2502-2507.
[6]Park AM,Suzuki YJ.Effects of intermittent hypoxia on oxidative stress-induced myocardial damage in mice[J].J Appl Physiol.2007,102(5):1806-1814.
[7]McGuire M,MacDermott M,Bradford A.The effects of chronic episodic hypercapnic hypoxia on rat upper airway muscle contractile properties and fiber-type distribution[J].Chest.2002,122(4):1400-1406.
[8]XU W,Chi L,ROW BW,et al.Increased oxidative stress is associated with chronic intermittent hypoxia-mediated brain cortical neuronal cell apoptosis in a mouse model of sleep apnea[J].Neuroscience,2004,126(2):313-323.
[9]Troncoso Brindeiro CM,da Silva AQ,A llahdadi KJ,et al.Reactive oxygen species contribute to sleep apnea-induced hypertension in rats[J].Am JPhysiol Heart Circ Physiol,2007,293(5):2971-2976.
