吡格列酮对db/db小鼠骨骼肌蛋白酪氨酸磷酸酶1B表达的影响
2012-02-01邵加庆
卢 斌,顾 萍,邵加庆,杜 宏,王 坚
(南京军区南京总医院内分泌科,南京 210002)
骨骼肌胰岛素抵抗是肥胖和2型糖尿病发生的 重要机制。研究发现蛋白酪氨酸磷酸酶1B(protein tyrosine phosphatase 1B,PTP1B)负性调节胰岛素信号转导,其表达增加及活性增强可以导致胰岛素抵抗的发生。吡格列酮作为胰岛素增敏剂改善胰岛素抵抗,但其作用机制尚未明确。本研究通过吡格列酮干预来观察其对db/db小鼠骨骼肌PTP1B表达的影响,探讨吡格列酮改善胰岛素敏感性的可能作用机制。
1 材料和方法
1.1 实验动物与分组:
C57BL/KsJ db/db小鼠购自美国 Jackson实验动物中心,并在本院实验动物中心繁育成功(SCXK[军]20072012)。实验期间小鼠在层流柜中饲养,所有器具及食物均消毒,无菌操作。小鼠自由进食、进水,保持垫料干燥,温度保持在23℃,12 h/12 h亮暗周期。按随机数字表将小鼠分为吡格列酮组10只和db/db对照组10只,每日固定时间分别给予吡格列酮(艾汀,北京太洋药业有限公司生产)10 mg/kg体重和相同体积的安慰剂(5%阿拉伯胶)灌胃,连续给药4周,另选取10只同周龄同窝出生的C57BL/KsJ db/m小鼠给予安慰剂灌胃作为非糖尿病对照组(db/m组)。实验结束,所有动物麻醉处死取骨骼肌,冻存于-70℃。
1.2 观察指标
1.2.1 生理生化指标 每周监测小鼠体重和空腹血糖,投药前和投药4周后测定空腹血糖(FBG)、空腹胰岛素(FINS)。血糖测定使用强生公司生产的One-Touch血糖仪。血清胰岛素水平的测定采用小鼠胰岛素 ELISA试剂盒(Morinaga,Yokohama, Japan)。胰岛素敏感性用 HOMA胰岛素抵抗指数(HOMA-IR,HOMA-IR=FPG×FINS/22.5)来评价。1.2.2 PTP1B蛋白表达的测定 提取骨骼肌蛋白,采用BCA蛋白定量试剂盒检测总蛋白浓度,取50 ug蛋白经SDS-聚丙烯酰胺凝胶电泳分离蛋白,电转移法将蛋白转移至硝酸纤维素膜,封闭后加入羊抗鼠PTP1B多克隆抗体(Santa Cruz公司)过夜孵育,洗膜后加入生物素标记的兔抗羊 IgG抗体(Santa Cruz公司)孵育2 h,洗膜后用 ECL增强显色。同时用同样方法对上述样品用抗鼠的β-actin单克隆抗体免疫杂交与显色作为内参对照。用BioRad Flour-S成像仪将胶片进行扫描,用凝胶图象处理系统进行半定量分析。
1.3 统计学分析
2 结果
2.1 生理生化指标
4周龄db/db小鼠进入试验时已表现为肥胖,血糖升高,高胰岛素水平,与 db/m组相比,差异有统计学意义(P<0.05),而吡格列酮组与db/db对照组小鼠上述指标间差异无统计学意义(P>0.05)。吡格列酮组小鼠在给予药物干预 4周后FBG、FINS水平及 HOMA-IR均显著低于 db/db对照组,差异有统计学意义(P<0.05),见表1。
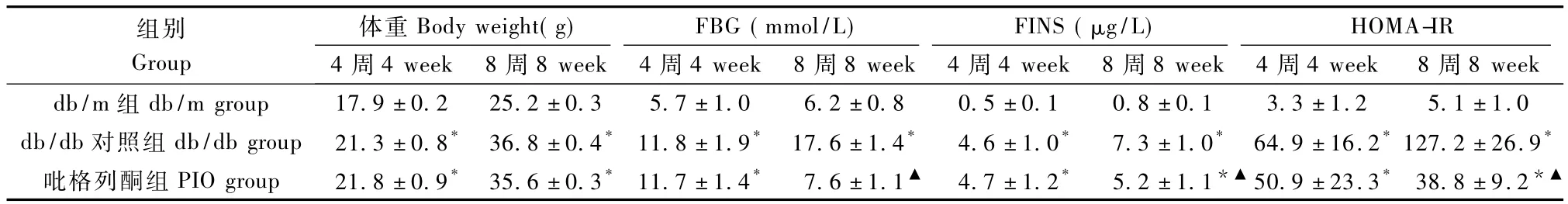
表1 3组小鼠的体重及生理、代谢指标比较Tab.1 The comparison of weight,physiological and metabolic parameters
2.2 Westernblot检测PTP1B蛋白表达
应用WB检测各组小鼠骨骼肌PTP1B蛋白的表达,结果显示,db/db组小鼠骨骼肌 PTP1B表达显著高于db/m组(P<0.05),给予吡格列酮干预4周后,吡格列酮组db/db小鼠骨骼肌PTP1B表达水平较 db/db对照组显著降低(P <0.05)(图1)。
3 讨论
db/db小鼠是一种先天肥胖性2型糖尿病小鼠模型,由于瘦素受体基因发生突变所致。一般于出生后3~4周即可表现为肥胖,血糖升高,胰岛素抵抗等特性,是研究2型糖尿病的理想模型。本研究中4周龄db/db小鼠表现为高血糖、体重增加,胰岛素抵抗指数增加,与对照组相比有显著性差异。

图1 图1 各组小鼠骨骼肌PTP1B蛋白表达量Fig.1 PTP1B protein expression in muscle of each group
肥胖、胰岛素抵抗的机制目前尚未完全阐明。研究发现胰岛素信号转导受到正负调节蛋白的协同作用,而在众多负调节因子中PTP1B作用突出。PTP1B是蛋白酪氨酸磷酸酶家族中的一员,在人体多种组织细胞中普遍存在,主要位于胞浆内质网表面,它通过使激活的胰岛素受体及胰岛素受体底物等去磷酸化失活而发挥生理功能[1]。研究发现PTP1B的表达水平在糖尿病或发生胰岛素抵抗时明显升高。在啮齿类糖尿病动物的骨骼肌和脂肪细胞中,PTP1B的表达和活性均显著升高[2]。PTP1B基因敲除小鼠,与野生型小鼠相比,其胰岛素敏感性增强,肝脏及肌肉组织中的胰岛素受体磷酸化水平升高,该小鼠即使在致肥胖饮食条件下也不出现肥胖或胰岛素抵抗[3]。这些研究提示PTP1B是胰岛素信号转导的负性调节者,PTP1B也就成为胰岛素抵抗机制研究的重要位点[4]。
吡格列酮属于噻唑烷二酮类药物(thiazolidilsdioms,TZDs),作为胰岛素增敏剂,能有效降低2型糖尿病患者血糖和血浆胰岛素水平,提示该药不刺激胰岛素的分泌,而是通过增强机体对胰岛素的敏感性达到降低血糖的效果。目前认为其主要作用机制是通过激活过氧化物酶体增殖物激活受体 γ(peroxisome proliferator-activated receptor -γ,PPARγ),调节某些参与葡萄糖和脂肪酸代谢的胰岛素反应性基因的转录[5]。吡格列酮如何改善骨骼肌胰岛素敏感性具体机制目前还不确切,本研究对此进行初步探讨。PPARγ在骨骼肌表达量很低,只有脂肪组织表达量的10%[6],因此以往认为脂肪组织是吡格列酮的主要作用位点,而骨骼肌胰岛素作用改善是由于下调脂质水平及减少葡萄糖脂肪循环引起的。然而骨骼肌胰岛素敏感性改善非常明显,而且TZD类药物可以在成熟的骨骼肌细胞L6增加葡萄糖转运[7]。TZD类药物是否通过PPAR非依赖途径增加肌肉胰岛素敏感性?
本研究用db/db糖尿病小鼠模型,观察吡格列酮对其骨骼肌中PTP1B表达的影响,探讨吡格列酮改善骨骼肌胰岛素抵抗的分子机制。由于PTP1B是一种胞内蛋白,目前还没有定量检测的方法,所以我们采用Western blot进行半定量蛋白检测。实验证实在胰岛素抵抗状态下,db/db小鼠骨骼肌PTP1B蛋白表达明显增加。经吡格列酮处理4周后db/db小鼠血糖下降,胰岛素抵抗明显改善,同时伴随着骨骼肌PTP1B水平的下降。这提示PTP1B可能与吡格列酮改善骨骼肌胰岛素敏感性有关。因此吡格列酮可能是通过减少PTP1B表达从而增加骨骼肌胰岛素敏感性。但仍需大量进一步体外研究来证实该作用。下一步通过体外试验研究吡格列酮对骨骼肌细胞PTP1B表达的影响及应用PTP1B激动剂或抑制剂进行干预,这有助于研究PTP1B在胰岛素抵抗中的作用及吡格列酮作用机制。
[1]Goldstein BJ,Bittner Kowalczyk A,White MF,et al.Tyrosine dephosphorylation and deactivation of insulin receptor substrate-1 by protein-tyrosine phosphatase 1B.Possible facilitation by the formation of a ternary complex with the Grb2 adaptor protein[J].JBiol Chem,2000,275(6):4283-4289.
[2]Hirata AE,Alvarez-Rojas F,Carvalheira JB,et a1.Modulation of IR/PTP-1B interaction and downstream signaling in insulin sensitive tissues of MSG-rats[J].Life Sci,2003,73(11):1369 -1381.
[3]K laman LD,Boss O,Peroni OD, et al.Increased energy expenditure,decreased adiposity,and tissue-specific insulin sensitivity in protein-tyrosine phosphatase 1B-deficientmice[J].Mol Cell Biol,2000,20(15):5479-5489.
[4]Ramachandran C,Kennedy BP.Protein tyrosine phosphatase 1B:a novel target for type 2 diabetes and obesity[J].Curr Top Med Chem,2003,3(7):749-757.
[5]Kahn CR,Chen L,Cohen SE.Unraveling the mechanism of action of thiazolidinediones[J].JClin Invest.2000,106(11): 1305-1307.
[6]Fajas L,Auboeuf D,RaspéE,et al.The organization,promoter analysis,and expression of the human PPARgamma gene[J].J Biol Chem.1997,272(30):18779-18789.
[7]Brunmair B,Gras F,Neschen S,et al.Direct thiazolidinedione action on isolated rat skeletalmuscle fuel hand ling is independent of peroxisome proliferator-activated receptor-gamma-mediated changes in gene expression[J].Diabetes.2001,50(10):2309 -2315.
