热量限制对SH-SY5Y细胞氧化损伤的影响
2012-01-30张景燕赵静姝吴燕川赵志炜
陈 娟,张景燕,王 蓉,赵静姝,郭 瑾,吴燕川,赵志炜
(1.首都医科大学宣武医院中心实验室,北京老年病医疗研究中心,神经变性病教育部重点实验室,北京 100053;2.中国人民解放军总医院301超声诊断科)
神经退行性疾病的共同特征是特定区域神经元功能的丧失,即神经元的不可逆损伤、死亡。越来越多证据表明,氧化应激参与了神经退行性疾病的病理机制,在阿尔茨海默病、帕金森综合症、脑卒中等疾病中都发现了自由基增多导致的细胞损伤,增多的氧自由基能攻击蛋白质、脂肪酸和脂质膜,从而破坏细胞的功能和完整性。因此,减少神经元内氧自由基的产生,对保护神经元、延缓衰老及对抗损伤有重要意义[1]。
热量限制饮食在很多物种中能够改善健康和延缓衰老,近年来大量研究发现,热量限制饮食可以减少多种与年龄相关的疾病的发生[2],但至今其延缓衰老的机制尚未十分清楚。有研究表明,热量限制延缓衰老可能机制之一是抗氧化应激[3]。热量限制大大降低了脑、心脏和肝脏中线粒体活性氧物质的产率,可能是延缓衰老进程的一个基本机制[4]。本实验拟通过观察低热量培养对过氧化氢诱导的SH-SY5Y细胞氧化损伤的影响,为进一步探讨热量限制在氧化应激损伤中的保护机制打下基础。
1 材料和方法
1.1 材料
1.1.1 细胞株:人神经母细胞瘤株 SH-SY5Y细胞来自瑞典卡罗林斯卡医学院。
1.1.2 试剂:噻唑兰(MTT)购自 Sigma公司,二甲基亚砜(DMSO)购自北京亚太精细化工公司,乳酸脱氢酶(LDH)测定试剂盒,购自北京化工厂,编号001012,30%过氧化氢购自北京化工试剂厂。
1.2 方法
1.2.1 细胞培养与处理:细胞用 DMEM*F12(Gibco)培养基培养(3.0g/L-glucose),加入10%胎牛血清、青霉素 100IU/m L、链霉素100IU/m L于37℃、5%CO2培养箱中培养。贴壁细胞生长密度达到70%~80%时,分组处理:对照组及损伤组,换用DMEM ×F12加入1%血清,培养24h;低糖组及低糖+损伤组,换用低糖组培养基为DMEM(2.0g/L-glucose)加1%胎牛血清,培养24h;予以250μmol/L的H2O2分别损伤1h和7 h。用于后续实验。
1.2.2 MTT代谢率测定:将SH-SY5Y细胞接种于96孔板中,细胞接种密度1.0×104/孔,待细胞贴壁生长至70%~80%时予以相应处理,加入MTT溶液(5.0g/L)20uL继续培养4h后,弃去培养液,每孔加入150μL DMSO作用10m in后,用全波长酶标仪(Multiskan Spectrum)测定570nm处光密度值。
1.2.3 细胞生长形态观察:用倒置显微镜(Olympus产品)观察培养的细胞,比较对照组和实验组细胞的形态。
1.2.4 LDH漏出率测定细胞培养方法:同前,按照LDH试剂盒所示方法(比色法),测定570nm处光密度值,同时做条图。
1.3 统计学方法
用SPSS11.5软件统计分析,资料数据以均数±标准差(±s)表示,组间差异显著性检验用单因素方差分析(One Way ANOV)及重复资料的方差分析,P<0.05认为差异有显著性意义,P<0.01认为差异有非常显著性意义。
2 结果
2.1 MTT代谢率测定
不同浓度过氧化氢作用1h后,采用MTT法检测细胞活力。结果显示随着过氧化氢浓度的增加,细胞活力呈递减趋势(图1)。

图1 不同浓度过氧化氢对细胞活力的影响注:与对照组相比**P>0.05;##P<0.01。误差条:±2sFig.1 Effect of different concentrations of hydrogen peroxide on the SH-SY5Y cells viabilityNote:**P>0.05,vs.control group;##P<0.01,vs.control group
用250μmol/L过氧化氢分别处理1h和7 h,和对照组比较,低糖组活力明显上升;与损伤组比较,低糖+损伤组活力上升(图2)。
2.2 LDH漏出率测定结果
与空白组比较,损伤组漏出率明显增加,P<0.05,低糖组1h漏出率稍有减少,P>0.05;与损伤组比较,低糖 +损伤组1h漏出率明显减少,P< 0.01,继续培养至7 h显示,低糖组漏出率由(1.154±0.062)增加至(1.223±0.107);低糖+损伤组漏出率由(1.128±0.542)增加至(1.262±0.081),P<0.01(图3)。
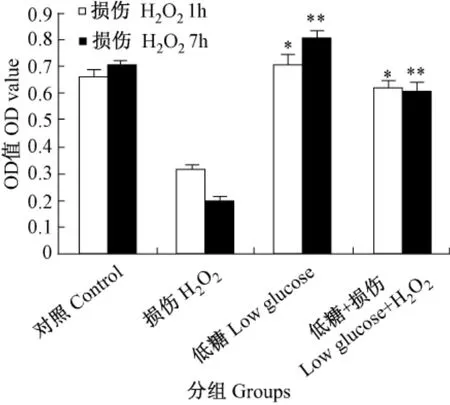
图2 热量限制对过氧化氢损伤不同时间段的影响注:损伤1h,与空白组比较,*P<0.01;与损伤组比较,*P<0.01;损伤7 h,与空白组比较,**P<0.01;与损伤组比较,**P<0.01。误差条:±2sFig.2 Effect of caloric restriction for different times on thehydrogen peroxide-induced cell damage Note:Damaged for 1hour,*P<0.01,vs.control group;*P<0.01,vs.H2 O2 group;damaged for 7 h,**P<0.01,vs.control group;**P<0.01,vs.H2 O2 group.
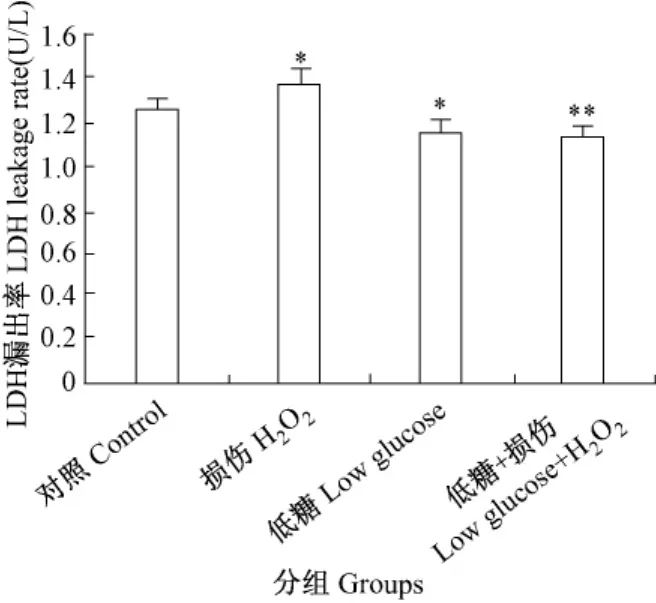
图3 LDH漏出率测定注:图3为过氧化氢损伤1h的细胞LDH漏出率。与空白组比较,*P>0.05;与损伤组比较,**P<0.01。误差条:±2sFig.3 The LDH leakage rates in the cells of different groupsNote:H2 O2-treated for 1hour.*P>0.05,vs.control group;**P<0.01,vs.H2 O2 group
2.3 细胞形态学观察
图4、5、6(见彩插1)所示为各组细胞在不同处理时段的细胞形态。图4为未加损伤之前,空白组、低糖组的细胞形态,各组细胞数目及形态与对照组比较无明显改变。图5为加入损伤药物1h后的细胞形态与未加损伤钱比较无明显改变,图6为加入损伤药物7 h后的细胞形态,低糖组和空白组细胞突起伸展良好细长,损伤组可见细胞数目明显减少,死细胞多,细胞突起回缩,细胞明显变圆,贴壁性不好,透光性差。
3 讨论
热量限制(caloric restriction,CR)是指一种有计划的减少由食物提供的热量的进食方式,一般指在生物体所摄入营养成分在保证其不发生营养不良的情况下,将正常自由进食所得的热量减去30% ~50%。早在20世纪30年代,McCay等[5]人就发现限制食物的摄入就能延长啮齿类动物的寿命。许多学者运用热量限制的方法在从酵母到灵长类动物中发现了类似的结果[6]。在热量限制的动物和志愿者,可以看到一个稳定的生理变化:较低的体温、较低的血糖和胰岛素水平、以及脂肪和体重的降低[7]、较强的应激耐受能力,包括热应激和氧化应激。神经元衰老机制研究中,氧化应激是加速神经元衰老的主要原因之一,虽然神经元衰老的机制仍不是很清楚,但长期以来一直认为氧化应激、DNA损伤可能是神经元衰老的关键原因[8]。
本实验观察到在细胞生长至对数期后给予低糖预处理24h,过氧化氢损伤1h(短期)和7 h(长期),MTT代谢率及LDH漏出率测定显示低糖组活力较损伤组活力明显增高,低糖组细胞形态维持良好,而损伤组细胞突触回缩,形态变圆,悬浮细胞和死细胞增多,显示低糖对短时间的急性氧化应激损伤和长期的氧化应激损伤都能起到一定的保护作用,这一结论与近年研究的热量限制抗氧化损伤的结论相符[9],低糖通过模拟热量限制的作用,降低线粒体活性氧类物质的生成,上调相关解偶联蛋白的表达,提高机体的抗氧化酶水平,使机体内活性氧类物质生成减少,清除提高,从而发挥很好的抗氧化损伤作用[10,11];也提示我们,在日常生活中减少碳水化合物的摄入的比例有益于提高自身的抗氧化应激能力,保持身体健康,延缓衰老。总之,CR是一个生物体主动调节的过程,其延缓衰老的作用可能是通过促进线粒体增殖进而降低自由基水平来实现的[12]。本实验为热量限制抗氧化应激损伤提供了重要的理论依据。
[1]Radak Z, Zhao ZF, Goto S, et al. Age-associated neurodegeneration and oxidative damage to lipids,proteins and DNA[J].Molec Aspects Med,2011,32:305-315.
[2]赵静姝,王蓉.热量限制与神经保护作用[J].首都医科大学学报,2011,32(4):514-518.
[3]Ha JS,Lim HM,Park SS.Extracellular hydrogen peroxide contributes to oxidative glutamate toxicity[J].Brain Res,2010,1359:291-297.
[4]Ingram DK,Roth GS.Glycolytic inhibition as a strategy for developing calorie restriction mimetics[J].Exp Gerontol,2011,46:148-154.
[5]McCay CM,Crowell MF,Maynard LA.The effect of retarded growth upon the length of life and upon ultimate size[J].Nutrition,1989,5(3):155-171.
[6]黄建华,夏世金,沈自尹.热量限制延缓衰老及其在人类中的实践[J].中国老年学杂志,2007,22(27):2251-2253.
[7]Gupta RC,Milatovic S,Dettbarn WD,et al.Neuronal oxidative injury and dendritic damage induced by carbofuran:protection by memantine[J].Toxicol Appl Pharmacol,2007,219:97-105.
[8]Kwon SH,Kim JA,Hong SI,et al.Loganin protects against hydrogen peroxide-induced apoptosis by inhibiting phosphorylation of JNK,p38,and ERK 1/2MAPKs in SHSY5Y cells[J].Neurochem Int,2011,58:533-541.
[9]Csiszar A,Labinskyy N,Jimenez R,et al.Anti-oxidative and anti-inflammatory vasoprotective effects of caloric restriction in aging:role of circulating factors and SIRT1[J].Mechan Ageing Dev,2009,130:518-527.
[10]Salmon AB,Richardson A,Pérez VI.Update on the oxidative stress theory of aging:Does oxidative stress play a role in aging or healthy aging?[J].Free Radical Biol Med,2010,48:642-655.
[11]Jia ZQ,Misra HP.Reactive oxygen species in in vitro pesticideinduced neuronal cell(SH-SY5Y)cytotox icity:role of NFκ B and caspase-3[J].Free Radical Biol Med,2007,42:288-298.
[12]侯亚萍,汪华侨.热量限制及其阿尔茨海默病等退行性疾病的可能作用[J].解剖学研究,2010,32(1):53-58.
