人载脂蛋白C3基因转基因小鼠的建立及血脂变化分析
2012-01-30全雄志葛文萍关菲菲张连峰
全雄志,高 翔,张 旭,葛文萍,关菲菲,董 伟,张连峰,2
(1.卫生部人类疾病比较医学重点实验室,2.国家中医药管理局人类疾病动物模型三级实验室,中国医学科学院实验动物研究所和北京协和医学院比较医学中心,北京 100021)
载脂蛋白C(apolipoprotein C,ApoC)是血浆中一组水溶性的低分子量蛋白质,包括载脂蛋白C I、C II、C III和新近发现的C IV四个亚类,它们主要存在于乳糜微粒(chylom icron,CM)、极低密度脂蛋白(very low density lipoprotein,VLDL)和高密度脂蛋白(high density lipoprotein,HDL)中。载脂蛋白C在脂蛋白代谢中发挥着重要的作用。载脂蛋白C III(ApoC III)是载脂蛋白 C族中含量最丰富的一类,通过抑制血管内皮细胞表面的脂蛋白脂酶(lipoprotein lipase,LPL)以及肝脂酶(hepatic lipase,HL)等酶和受体的活性来影响血浆富含甘油三酯脂蛋白(triglyceride-rich lipoprotein,TRL)的代谢[1-2]。现在的研究证明,APOC3基因主要在肝脏和小肠中表达,但是在其他器官如肌肉、心脏、肾脏、脾脏等组织中也有一定量的表达[3-4]。所以,本研究利用转基因技术建立了系统性表达人载脂蛋白C3(APOC3)基因的转基因小鼠,旨在为进一步研究该基因与高血脂以及高血脂相关的心血管病提供工具动物。
1 材料和方法
1.1 人APOC3表达载体的构建及转基因
基因购买自Origene公司,用PCR的方法克隆该基因的开放阅读框,并在两端引入酶切位点Xho I (宝生物工程有限公司 中国)和 EcoR I(宝生物工程有限公司 中国),插入pMD-18T simple vector(宝生物工程有限公司 中国),测序结果无突变。以Xho I和EcoR I进行酶切回收该基因片段,插入系统性表达启动子Ubc下游构建人APOC3转基因载体。构建成功后,再用Pvu II(宝生物工程有限公司中国)将其线形化,获得Ubc启动的人APOC3基因转基因片段。调整浓度至5ng/μL,用显微注射法(TE2000-U显微注射仪)将线性化的转基因载体注射到C57BL/6J小鼠的受精卵中,制备转基因小鼠。C57BL/6J小鼠购自中国医学科学院实验动物研究所康蓝公司【SCXK-(京)2009-0007】,用ICR小鼠作假孕受体,购自中国医学科学院实验动物研究所康蓝公司【SCXK-(京)2009-0007】。实验中涉及动物的操作程序已经得到中国医学科学院医学实验动物研究所实验动物使用与管理委员会的批准,批准号为GC-09-2063。
1.2 PCR鉴定人 APOC3基因转基因小鼠的基因型
转基因小鼠在9~14日龄时用剪趾法标记,收集剪下的组织,用碱裂解法提取基因组DNA,利用特异引物通过 PCR法进行检测。PCR反应条件:DNA模板10~100ng,上游引物为5'-TCCTTGTTGT TGCCCTCCT-3',下游引物为5'-ACGGCTGAAGTTG GTCTGAC-3'(英潍捷基(上海)贸易有限公司,中国)。PCR反应体系20μL(试剂购自宝生物工程有限公司,中国)。反应条件:94℃预变性3min,94℃变性30s,60℃退火30s,72℃延伸30s,重复变性到延伸29次,完成30个循环。目的基因APOC3片段为274bp。
1.3 Western blot检测鉴定APOC3基因的表达
提取人APOC3转基因小鼠与同龄野生型小鼠血液、肝脏、肌肉、小肠、心脏、肾脏、脾脏总蛋白,进行SDS-PAGE凝胶电泳,蛋白转移至 NC膜上(Millipore美国),置于5%脱脂奶粉封闭液,用山羊抗人APOC3抗体检测基因的表达水平(Abcam)。采用辣根过氧化物酶(H rp)-耦联的兔抗羊抗体结合一抗(Pierce,USA),用Hrp-耦联的鼠抗GAPDH单克隆抗体做为内参(康成生物,中国)。
1.4 血生化分析检测不同月龄转基因小鼠与同龄野生型小鼠的血脂指标
分别选用3、5、7、9月龄的转基因阳性小鼠6只(n=6),和同龄野生型小鼠6只(n=6),雌雄各半,眼眶静脉取血,室温静置30min,4℃、5000r/min、离心15min,分离血清。用血生化分析仪(日立7020日本)分析小鼠血脂指标。实验所得数据利用SPSS 11.5软件进行组间差异的比较,采用的是独立样本的t检验(independent-sample t test)。
1.5 脂肪染色观察5月龄转基因小鼠与同龄野生型小鼠的肝脏脂肪水平
选用5月龄的转基因阳性和同龄野生小鼠,颈椎脱臼法牺牲小鼠,打开腹腔取出肝脏,将肝脏组织固定在4%中性甲醛中48h,进行修块、脱水、包埋、切片、油红O染色和镜下观察(Nikon显微镜,日本和Leica MZ16F体视镜,德国)。
2 结果
2.1 表达载体的构建
用PCR克隆的人APOC3基因,测序结果表明同已报道的人APOC3序列完全一致(Gene ID:345,NM-000040)。将该基因插入系统性表达启动子Ubc下游,构建人APOC3基因转基因载体(图1)。
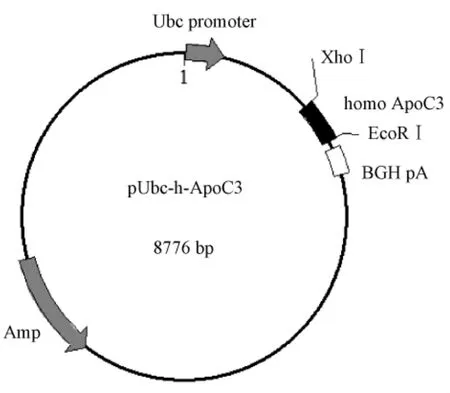
图1 APOC3基因转基因表达载体Fig.1 APOC3transgenic construct
2.2 APOC3转基因小鼠基因型的鉴定
用显微注射法将线性化的转基因载体注射到C57BL/6J小鼠的受精卵中,转入到假孕受体ICR小鼠中,小鼠出生后9~14d提取基因组DNA,用PCR扩增APOC3目的基因274bp的片段来检测APOC3转基因小鼠(图2),共得到6只首建鼠均可传代。
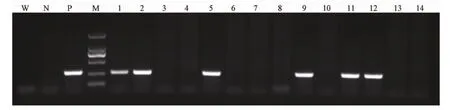
图2 PCR鉴定APOC3转基因小鼠基因型注:P:阳性对照;N:阴性对照;W:空白对照;M:DNA相对分子质量标记;1、2、5、9、11、12是F0代阳性转基因小鼠;3、4、6、7、8、10、13、14是F0代阴性小鼠。Fig.2 Genotyping of the APOC3transgenic m ice by PCRNote:P is positive control;N is negative control;W is blank control;M is DNA molecular weight marker;Lane 1,2,5,9,11,12are positive transgenic mice;Lane 3,4,6,7,8,10,13,14are F0negative mice.
2.3 APOC3基因的表达
首先用Western blot分析6个系1月龄的转基因小鼠血液中 APOC3的表达情况,结果显示APOC3在血液中均有表达(图3A),选取表达高的一个系保种繁殖,并进行下一步实验。继续用Western blot分析选出的高表达系的3、5、7、9月龄APOC3转基因小鼠与同龄野生型小鼠血液中APOC3的表达情况,其中 5月龄表达量最高(图3B)。因此,进一步分析5月龄转基因小鼠与同龄野生型小鼠全身多种组织的总蛋白中APOC3的表达情况,结果显示APOC3基因肝脏、小肠、肌肉、心脏、肾脏、脾脏中皆有高表达(图3C)。
2.4 不同月龄转基因小鼠与同龄野生型小鼠的血脂指标
3,5,7,9月龄的转基因小鼠与同龄野生型小鼠的血脂指标分析显示,3、5、7、9月龄转基因小鼠甘油三酯(triglyceride,TG)分别比同龄野生小鼠高20.7%(P<0.01)、212.5%(P<0.01)、41.2%(P<0.01)、28.6%(P<0.01)(图4)。
2.5 肝脏脂肪水平
用5月龄的转基因阳性和同龄野生小鼠肝脏组织进行油红O染色,镜下观察显示,脂肪颗粒呈橘红色,呈片状分布于肝脏组织内,血管周围居多,转基因阳性小鼠与同龄野生小鼠相比,脂肪颗粒明显增多(图5)。
3 讨论
近年来,心血管疾病的发病率呈明显的上升趋势,已成为老年人的主要死亡原因之一,同时,血脂代谢紊乱在心血管疾病发生发展中的重要作用已得到大家的公认。ApoC III作为机体内TRL分解代谢的主要调节因子之一,大宗的临床试验证实,作为冠状动脉疾病发生的预警信号,ApoC III比传统意义上的血浆TG水平更有价值[5-10]。
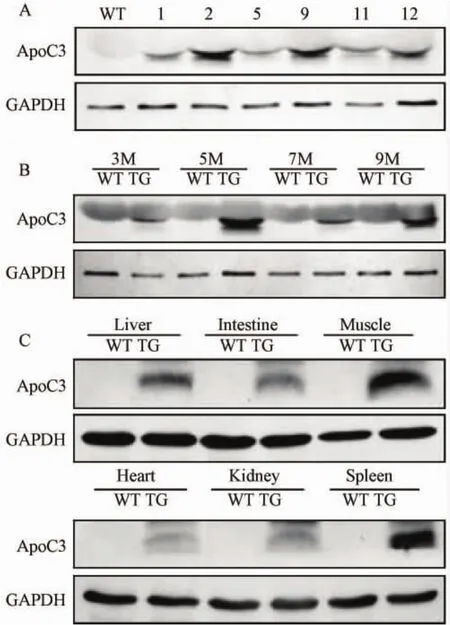
图3 APOC3基因在转基因小鼠血液、肝脏、小肠、肌肉、心脏、肾脏、脾脏中的表达注:WT:野生型小鼠;1、2、5、9、11、12:转基因小鼠;内参:GAPDH。Fig.3 Expression of APOC3in the blood,liver,intestine,muscle,heart,kidney and spleen of the transgenic mice Note:WT:Wild type mice;1,2,5,9,11,12:Transgenic mice;The Western blot is normalized with GAPDH.
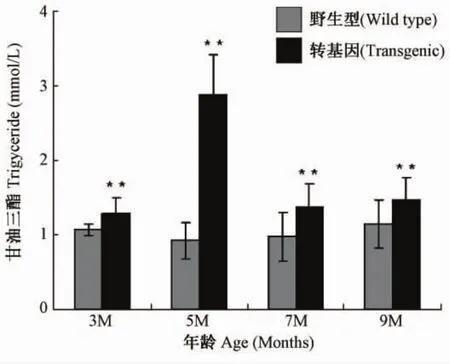
图4 不同月龄小鼠血浆甘油三酯含量注:野生组与转基因组相比较,*P<0.01Fig.4 Triglyceride of the mice at different agesNote:W ild type compared with the transgenic mice,*P<0.01
动物实验及人体实验均表明,ApoC III在体内富含甘油三酯脂蛋白(TRL)的分解代谢中具有重要的调节作用,它是脂蛋白脂酶(LPL)的抑制剂,同时还可以抑制肝脏对TRL及其残粒的摄取。脂蛋白脂酶(LPL)能催化 CM及 VLDL中甘油三酯的代谢,在血管内皮表面发挥作用,是TRL分解代谢的关键酶。ApoC III是脂蛋白脂酶最强的抑制剂之一[11]。国外学者研究证实,加 ApoC III到 ApoC III缺乏症患者血清中可以降低20% ~50%的脂蛋白脂酶活性[12]。ApoC III能抑制肝脏摄取 CM、VLDL以及其残粒,使血液中TG含量增加,引起高甘油三酯血症。W ind ler等[13]以灌流大鼠肝脏为模型的研究发现,将人或大鼠 ApoC III加入到含有乳糜微粒或VLDL的肝灌流液中,可显著减少肝脏对CM及VLDL的摄取。大量的动物及人体研究均表明,ApoC III是通过影响肝细胞膜上脂蛋白受体的识别功能而影响肝脏对TRL及其残粒的代谢的。Maeda等[14]在动物实验研究中发现,在转人ApoC III基因小鼠中,当血浆ApoC III水平增加40%,血浆TG即增加2倍。
本研究经过Western blot筛选,得到了高表达人APOC3基因的转基因小鼠品系。通过对不同月龄转基因小鼠与野生型小鼠血生化分析结果的比较,以及肝脏脂肪染色观察,证明该转基因品系具有高脂血症的表型,可以作为研究脂蛋白代谢紊乱、高脂血症、脂肪肝、动脉粥样硬化等疾病的实验动物模型[15]。
[1]Brown S,Ordovas JM,Campos H.Interaction between the APOC3gene promoter polymorphisms,saturated fat intake and plasma lipoproteins[J].Atherosclerosis,2003,170(2):307 -313.
[2]Jong MC,Hofker MH,Havekes LM.Role of ApoCs in lipoprotein metabolism:functional differences between ApoC1,ApoC2,and ApoC3[J].Arterioscler Thromb Vasc Biol,1999,19(3):472-484.
[3]Teramoto T.Structure and function of apolipoproteins[J].Nippon Rinsho.1994,52(12):3100-3107.
[4]Snieder H,van Doornen LJ,Boomsma DI,et al.The age dependency of gene expression for plasma lipids,lipoproteins,and apolipoproteins[J].Am J Human Genet,1997,60(3):13.
[5]Blankenhorn DH,A laupovic P,W ickham E,et al.Prediction of angiographic change in native human coronary arteries and aortocoronary bypass grafts.Lipid and nonlipid factors[J].Circulation,1990,80:470-476.
[6]Hodis HN,Mack WJ,Azen SP,et al.Triglyceride and cholesterol-rich lipoproteins have a differential effect on mild/moderate and severe lesion progression as assessed by quantitative coronary angiography in a controlled trial of lovastatin[J].Circulation,1994,90:42-49.
[7]Mack WJ,Krauss RM,Hodis HN.Lipoprotein subclasses in the monitored atherosclerosis regression study(MARS).Treatment effects and relation to coronary angiographic progression[J].Arterioscler Thromb Vasc Biol,1996,16:697-704.
[8]Luc,G,Fievet C,Arveiler D,et al.Apolipoproteins C-III and E in apoB and non-apoB-containing lipoprotein in two populations at contrasting risk for myocardial infarction.The ECTIM study[J].J Lipid Res,1996,37:508-517.
[9]Thompson GR.Angiographic evidence for role of triglyceride lipoproteins in progression of coronary artery disease[J].Eur Heart J,1998,19:H31-H36.
[10]Sacks FM, Alaupovic P, Moye LA, et al. VLDL,apolipoproteins B,CIII,and E,and risk of recurrent coronary events in the cholesterol and recurrent events(CARE)trial[J].Circulation,2000,102:186-1892.
[11]刘皓,刘秉文.载脂蛋白C研究进展.中国动脉硬化杂志,2002,10(1):76-80.
[12]Jong MC,Hofker MH,Havekes LM.Role of apoCs in lipoprotein metabolism functional differences brtween apoC1,apoC2and apoC3.Arterioscler Thromb Vasc Biol,1999,19:472-484.
[13]刘瑞,白怀,刘秉文.ApoCIII在富含甘油三酯脂蛋白代谢中的作用.国外医学临床生物化学与检验学分册,2002,22(2):63-64.
[14]Maeda N,Li H,Lee D,et al.Targeted disruption of the apolipoprotein CIII gene in mice results in hypo-triglyceride and protection from postprandial hypertriglyceridemia[J].J Biol Chem,1994,269:23610-23616.
[15]赵海苹,张连峰.动脉粥样硬化基因工程小鼠模型[J].中国比较医学杂志,2009,19(9):54-58.
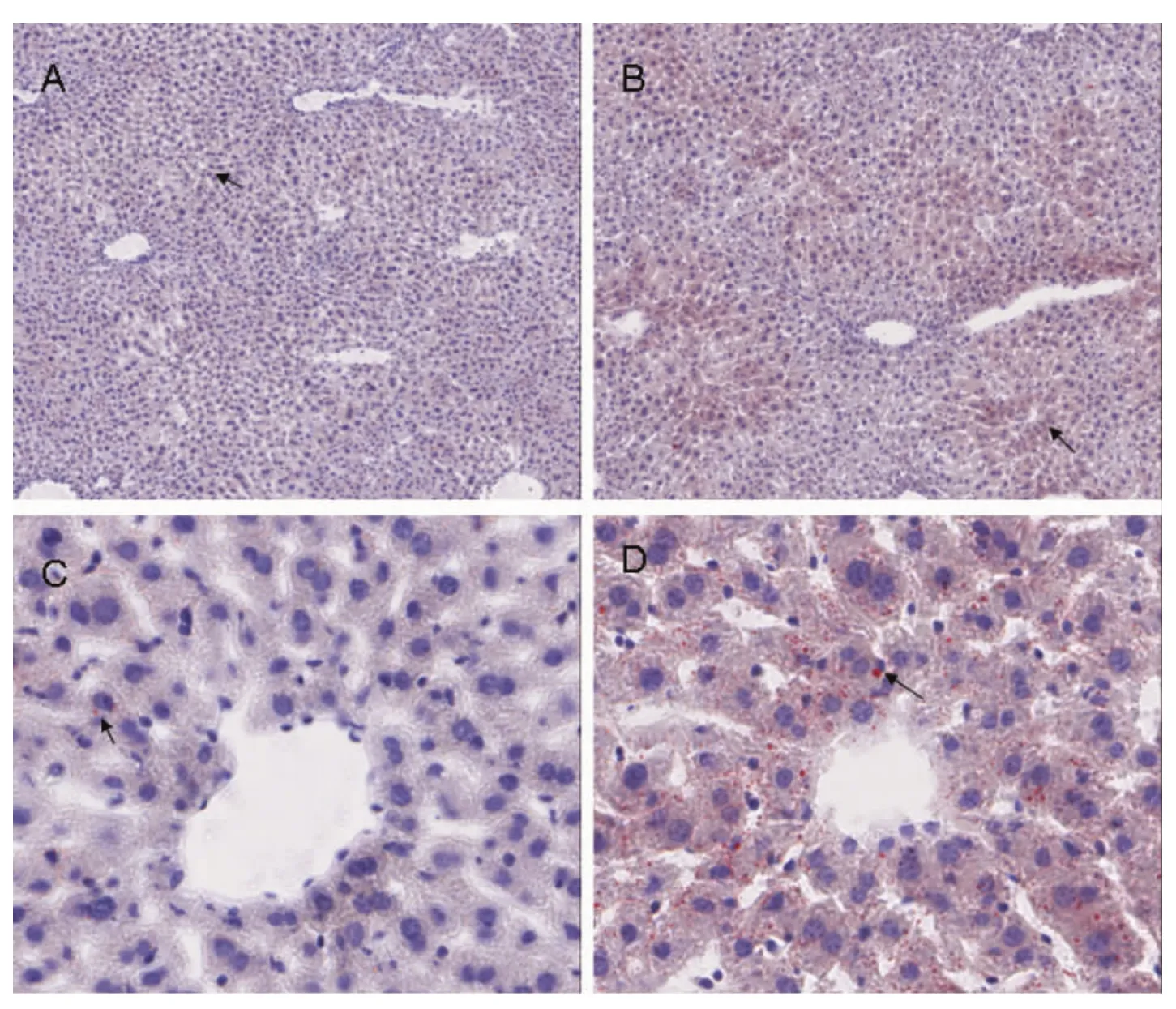
图5 肝脏脂肪染色A:野生型小鼠肝脏;B:转基因小鼠肝脏;C:野生型小鼠肝脏;D:转基因小鼠肝脏;注:箭头所示为肝脏脂肪颗粒。Fig.5 Distribution of fat in the mouse livers.Fat stainingA:The liver of a wild type mouse;B:The liver of a transgenic mouse;C:The liver of a wild type mouse;D:The liver of a transgenic mouse;Note:Arrows show the fat particles.
