人肝脏胶原样凝集素1在肝癌细胞株HepG2内的定位及其功能探讨
2012-01-29王万海李付广张世杰任春峰尹慧卿
明 亮,王万海,李付广,张世杰,任春峰,尹慧卿
(1郑州大学第一附属医院,郑州450052;2郑州大学基础医学院)
人肝脏胶原样凝集素l(CL-L1)是胶原样凝集素家族的新成员之一[1,2]。机体内胶原样凝集素的主要功能是通过识别外来病原体表面上病原相关分子模式,参与区分“自己”和“非己”糖结构,从而在抗病原体感染和宿主防御中发挥重要作用[3]。目前已发现的胶原样凝集素中多数为分泌蛋白,存在于体液和分泌液中,只有CL-L1为可溶性胞质内蛋白[4]。因此,推测CL-L1可能具有其独特的功能,但目前对其功能的了解甚少。为此,2011年11月1日~2012年5月31日,我们观察了CL-L1在肝癌细胞株HepG2的定位,并通过pcDNA3.1/myc-his-CL-L1和pEGFP-N1载体将CL-L1基因转染HepG2细胞,观察其克隆形成能力,探讨CL-L1的功能。
1 材料与方法
1.1 材料 肝癌细胞株HepG2,pEGFP-N1载体,大肠杆菌DH5α。DMEM培养液和胎牛血清,工具酶,其他试剂及材料见文献[3]。
1.2 方法
1.2.1 载体pcDNA3.1/myc-his-CL-L1和pEGFPN1-CL-L1的构建 采用已构建好的含有人全长CL-L1 cDNA的真核表达载体pcDNA3.1/myc-his-CL-L1及pEGFP-N1-CL-L1[3],酶切鉴定和序列分析显示插入的目的片段DNA序列与读码框完全相符。
1.2.2 基因转染 在直径35 mm的细胞培养皿中接种3×105个HepG2细胞,置5%CO2、37℃培养箱中培养20 h。配置转染液:1号液(2 μg的pcDNA3.1/myc-his-CL-L1质粒+无血清、无抗生素的DMEM培养液 250 μL),2号液(5 μL的 Lipofectamine 2000+无血清、无抗生素的DMEM培养液250 μL),将配好的1、2号液混合,即为转染液,室温静置30 min。培养的HepG2细胞去上清,用无血清和无抗生素的DMEM培养液洗2次,加入1 mL无血清和无抗生素的DMEM培养液后逐滴加入转染液,边加边摇动[5]。细胞培养6 h后,去除转染液,换成DMEM完全培养液继续培养42 h。
1.2.3 HepG2细胞内CL-L1蛋白检测 HepG2细胞转染pcDNA3.1/myc-his-CL-L1后48 h,收集细胞蛋白(以转染空载质粒的细胞作对照),BCA法进行蛋白定量后,各取50 μg总蛋白进行10%SDS-PAGE电泳并转印至PVDF膜,用Western blot法进行检测分析。
1.2.4 HepG2细胞克隆形成实验 HepG2细胞转染pcDNA3.1/myc-his-CL-L1后24 h,消化全部细胞,转移到细胞培养皿中再继续培养24 h,加G418至终浓度800 mg/L,每3~4 d换液1次,直至长出肉眼可见的克隆,吸去培养液,考马斯亮蓝染色过夜,拍照。以转染空载质粒的细胞作对照。
1.2.5 HepG2细胞内CL-L1蛋白的定位 ①激光共聚焦显微镜观察法:在直径35 mm的细胞培养皿中接种2×105个 HepG2细胞,将培养皿置5% CO2、37℃培养箱中培养20 h。配置转染液:3号液(2 μg质粒+无血清、无抗生素的DMEM培养液100 μL),4号液(4 μL的Lipofectamine 2000+无血清、无抗生素的DMEM培养液100 μL),将配好的3、4号液混合,即为转染液,室温静置 30 min。HepG2细胞于转染液中转染pEGFP-N1-CL-L1后48 h(以转染空载质粒的细胞作对照),吸去转染液,4%多聚甲醛室温固定30 min,0.1%TritonX-100破膜5 min,封片液(含Dapi)封片,用激光共聚焦显微镜观察CL-L1蛋白在细胞内的定位。②荧光标记观察法:用内质网特异性荧光染料ER-Tracker Blue-White DPX和高尔基体特异的红色荧光探针染料BODIPY TR C5-Ceramide对转染后的HepG2细胞的内质网及高尔基体分别进行染色[2]。在330~385 nm激发光下观察内质网特异探针发出的蓝色荧光,460~490 nm激发光下观察EGFP融合蛋白发出的绿色荧光,在545~580 nm激发光下观察高尔基体特异探针发出的红色荧光,图象重叠观察EGFP融合蛋白在HepG2细胞内的定位。
2 结果
2.1 转染pcDNA3.1/myc-his-CL-L1的HepG2细胞中CL-Ll蛋白的表达 pcDNA3.1/myc-his-CL-L1转染HepG2细胞后,其CL-L1蛋白明显高表达,转染空载质粒的细胞未见CL-L1蛋白表达,见图1。
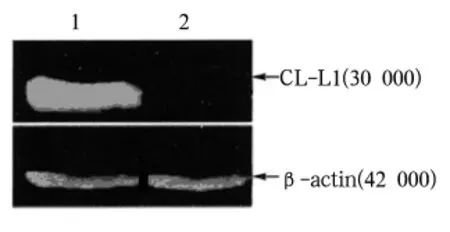
图1 注:1:转染重组质粒pcDNA3.1/myc-his-CL-L1的HepG2细胞内的CL-L1蛋白;2:转染空载质粒的HepG2内细胞未见CL-L1蛋白表达;β-actin为内对照,显示上样量一致
2.2 转染pcDNA3.1/myc-his-CL-L1的HepG2细胞克隆形成能力 转染重组质粒pcDNA3.1/mychis-CL-L1的HepG2细胞经G418筛选后4周左右,与转染空载质粒的细胞相比其克隆形成能力明显下降,见图2。

图2 注:1:转染空载质粒的HepG2内细胞形成的克隆;2:转染重组质粒pcDNA3.1/myc-his-CL-L1的HepG2细胞形成的克隆
2.3 CL-L1蛋白在HepG2内的定位 激光共聚焦显微镜观察发现CL-L1蛋白(显示绿色荧光)定位于HepG2细胞的细胞质基质中。荧光标记法显示CL-L1蛋白广泛分布于HepG2的细胞质内,不在高尔基体和内质网中表达。
3 讨论
胶原样凝集素家族是一类含有胶原样结构域的C型凝集素,目前已鉴定出8个成员,包括甘露聚糖结合凝集素(MBL)、两种表面活性物质(SP-A、SPD)、肾脏胶原样凝集素1(CL-K1)、胎盘胶原样凝集素1(CL-P1)、胶固素和胶原样凝集素-43(CL-43)以及CL-L1[5]。胶原样凝集素通过糖识别结构域特异性来识别病原体包膜糖基,发挥中和、凝集、调理作用或补体激活作用而抑制病原微生物的感染,在固有免疫中发挥重要作用[3,6,7],也可调节适应性免疫系统的功能[8]。
肝癌的发生发展与病毒侵袭密切相关,特别是与病毒包膜的糖基密切相关。在本研究中,我们发现CL-L1融合蛋白的绿色荧光与内质网、高尔基体不重叠,说明融合蛋白存在于HepG2细胞的细胞质基质中,而不存在于其内质网和高尔基体内。CL-L1是已发现的惟一存在于胞质基质中的胶原样凝集素蛋白,可能具有独特的生物学作用。HepG2细胞转染CL-L1基因后,克隆形成能力明显下降。推测CL-L1基因可能是肝癌相关抑制基因。
[1]Ohtani K,Suzuki Y,Eda S,et al.Molecular cloning of a novel human collectin from liver(CL-L1)[J].J Biol Chem,1999,274 (19):13681-13689.
[2]Selman L,Hansen S.Structure and function of collectin liver 1 (CL-L1)and collectin 11(CL-11,CL-K1)[J].Immunobiology,2012,217(9):851-863.
[3]van de Wetering JK,van Golde LM,Batenburg JJ.Collectins:players of the innate immune system[J].Eur J Biochem,2004,271 (7):1229-1249.
[4]李付广,杨桂枝,王芳,等.重组人肝脏胶原样凝集素1在中国仓鼠卵巢细胞内定位[J].细胞与分子免疫学杂志,2008,24(6): 617-619.
[5]Boussif O,Lezoualch F,Zanta MA,et al.A versatile vector for gene and oligonucleotide transfer into cells in culture and in vivo: polyethylenimine[J].Proc Natl Acad Sci USA,1995,92(16): 7297-9301.
[6]Sano H,Kuroki Y.The lung collectins,SP-A and SP-D,modulate pulmonary innate immunity[J].Mol Immunol,2005,42(3):279-287.
[7]Dommett RM,Klein N,Turner MW.Mannose-binding lectin in innate immunity:past,present and future[J].Tissue Antigens,2006,68(3):193-209.
[8]Sprong T,van Deuren M.Mannose-binding lectin:ancient molecule,interesting future[J].Clin Infect Dis,2008,47(4):517-518.