HPLC法测定新疆罗布麻茶中的芦丁和槲皮素
2012-01-28王省超王瑞英孙颖张泰白张龙燕
王省超,王瑞英,*,孙颖,张泰白,张龙燕
(1.新疆大学理化测试中心,新疆乌鲁木齐830046;2.新疆产品质量监督检验研究院,新疆乌鲁木齐830004;3.新疆大学化学化工学院,新疆乌鲁木齐830046)
罗布麻又名野麻、茶叶花,分为红麻和白麻两种,是属夹竹桃科多年生的半灌木,主要生长在沙漠盐碱地、河岸、山沟的砂质地,盛产于我国西北区域,如新疆、甘肃、青海和宁夏等多个省市区。因最早发现在新疆罗布泊,故名为罗布麻[1]。大量研究表明,罗布麻的主要化学成分为黄酮类化合物、氨基酸、脂肪酸醇酯及多种矿物质元素等[2-4],其中,黄酮类化合物主要分布在罗布麻叶中。罗布麻茶是由罗布麻叶干燥后经传统制茶工艺制成。研究发现,黄酮类化合物对改善血液循环、预防和治疗高血压、降血脂、平肝安神、抑菌延衰抗氧化等方面具有显著作用[5-9]。罗布麻茶中的黄酮类化合物以芦丁、槲皮素等为主,因而测定罗布麻茶中芦丁和槲皮素的含量具有重要意义。
本文以新疆罗布麻茶为研究对象,提取该茶中的芦丁和槲皮素,建立高效液相色谱法对其含量同时进行分析,并初步探讨提取方法、提取温度、提取溶剂及料液比对芦丁和槲皮素含量的影响,以期为罗布麻的进一步研究与开发应用提供一定的参考。
1 仪器与材料
Agilent 1100 型高效液相色谱系统,四元梯度泵,真空脱气机,自动进样器,柱温箱,二极管阵列检测器及Agilent 化学工作站;KHS200 超声波清洗器:江苏昆山禾创超声仪器有限公司;RT-205 型电子分析天平:梅特勒-托利多仪器有限公司;Millpore 超纯水器:美国,Millpore 公司。
芦丁和槲皮素对照品均购自中国药品生物制品检定所;罗布麻茶购于新疆乌鲁木齐市济康大药房;甲醇为色谱纯,磷酸为分析纯,水为超纯水。
2 方法与结果
2.1 溶液的配制
2.1.1 对照品储备液
分别精密称量对照品适量,用色谱纯甲醇溶解、定容至25 mL 的容量瓶中,分别配制成含芦丁0.342 mg/mL 和槲皮素0.124 mg/mL 的对照品储备液,置于4 ℃的冰箱中保存备用。
2.1.2 对照品溶液
精密吸取1 mL 芦丁对照品储备液和2 mL 槲皮素对照品储备液,置于10 mL 的容量瓶中,用色谱纯甲醇定容,配制成含芦丁0.034 2 mg/mL 和槲皮素0.024 8 mg/mL 的对照品溶液。
2.1.3 供试品溶液
精密称取罗布麻茶粉末(过70 目筛)3 g,置于50 mL圆底烧瓶中,加入45 mL 70 %的乙醇溶液,超声提取2 h,定容至50 mL 的容量瓶中,经0.45 μm 的滤膜过滤后,用于HPLC 分析。
2.2 色谱条件
色谱柱为Agilent TC-C18(150×4.6 mm,5 μm);流动相为甲醇-0.3%磷酸水溶液(40∶60,体积比);流速为1.0 mL/min,检测波长360 nm,柱温为30 ℃;进样量为5 μL。在该色谱条件下,对照品芦丁和槲皮素分离较好(如图1),对于供试品,尽管罗布麻茶中成分较多,芦丁和槲皮素在该色谱条件下仍然实现了良好分离,满足定量分析需要(如图2)。
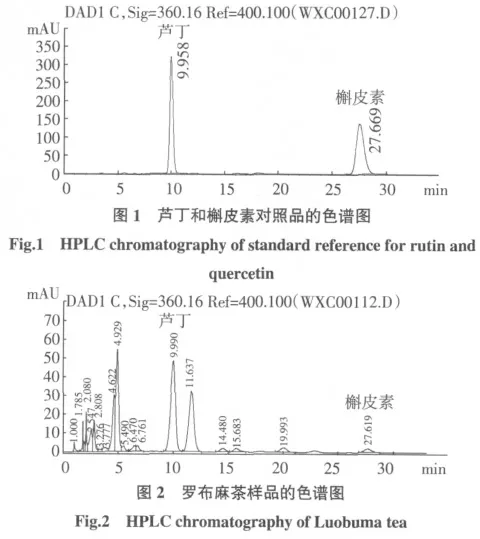
2.3 线性关系考察
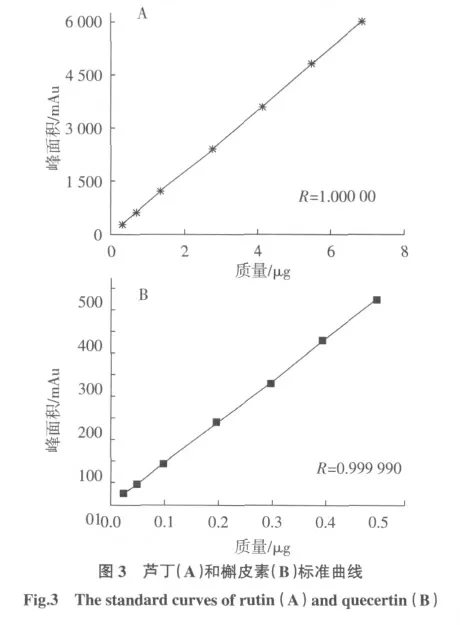
按“2.2”色谱条件,分别将对照品溶液依次进样1、2、4、8、12、16、20 μL,以Y(AV·S)为峰面积,X(μg)为进样质量,芦丁和槲皮素的方程分别为:Y=879.399 6X+2.891 9,r=1.000 00;Y=952.703 0X-2.003 9,r=0.999 90。结果表明,芦丁在0.0342 μg~0.684 μg 和槲皮素在0.0248 μg~0.496 μg 间呈良好线性关系(图3)。
2.4 精密度实验
取上述对照品溶液进样,每次10 μL,重复进样5次,按上述色谱条件测定峰面积,芦丁和槲皮素的RSD 分别为0.45%和0.80%(n=5),表明本方法精密度良好。
2.5 重现性实验
精密称取同一罗布麻茶样品5 份,按“2.1.3”方法制备供试溶液,在“2.2”色谱条件下分别测定芦丁和槲皮素含量,其RSD 分别为1.82%和1.81%(n=5),表明本方法重现性良好。
2.6 回收率实验
精密称取5 份不同质量的罗布麻茶,分别加入1 mL 的对照品,按“2.1.3”制备供试品溶液,在“1.4.3”色谱条件下分别进样10 μL,计算回收率。结果表明芦丁和槲皮素的加样平均回收率分别为99.94 %和99.48%,其RSD 分别为0.82%和0.60%(n=6)(表1)。
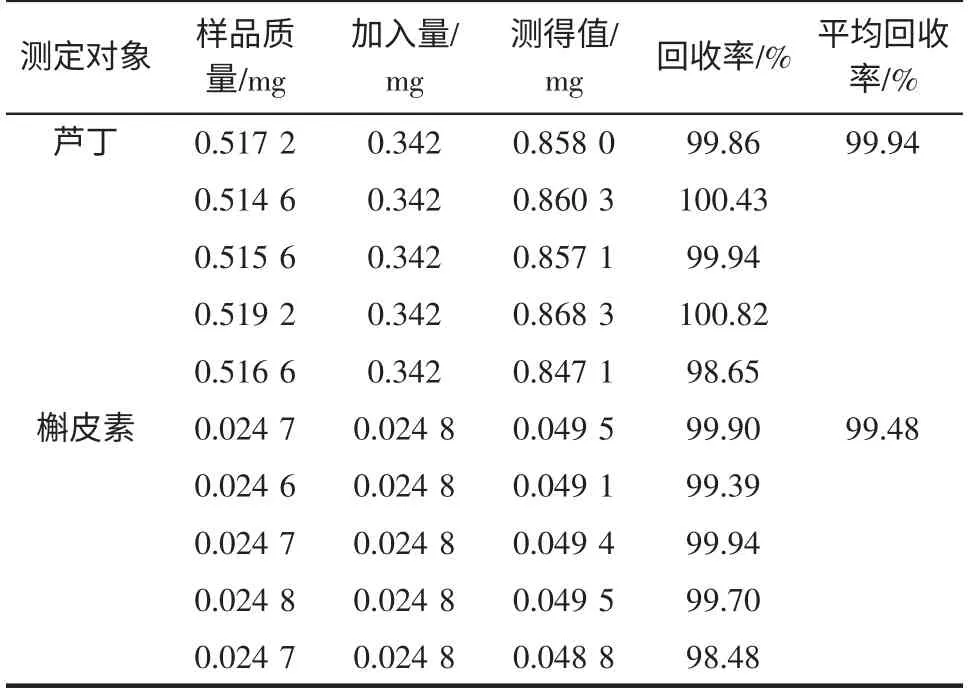
表1 回收率实验结果Table 1 The results of recovery
2.7 稳定性实验
取同一供试品溶液,分别在0、2、4、6、8、10、12 h按上述色谱条件测定峰面积,芦丁和槲皮素的RSD 分别为1.06%和1.80%,结果表明供试品溶液中的芦丁和槲皮素在12 h 内稳定。
2.8 样品的测定
按“2.1.3”方法制备的四份样品溶液,采用“2.2”色谱条件进行分析测试,得到罗布麻茶样品含量,结果见表2。
3 讨论
3.1 检测波长的选择
为了精确检测芦丁和槲皮素的含量,优选检测波长非常重要。将二极管阵列检测器分别设定检测波长为220、247、280、320、360 nm,在相同的色谱条件下进样分析。实验结果表明,芦丁和槲皮素在360 nm 下色谱峰面积较大、分离效果较好,且罗布麻茶中的其它成分在此波长下干扰较小,故选择360 nm 为最佳检测波长。
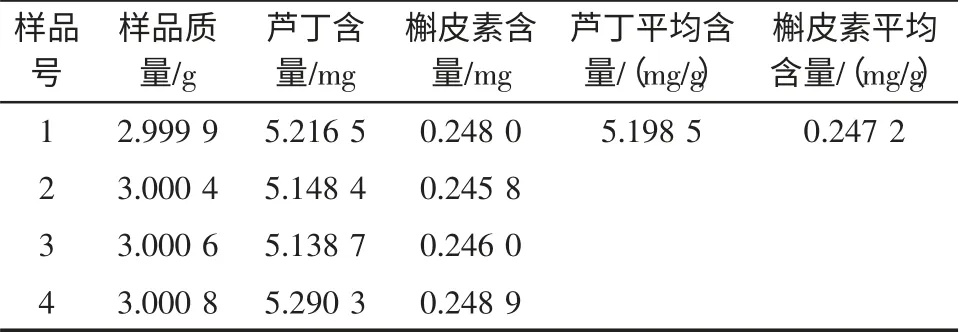
表2 罗布麻茶中芦丁和槲皮素的含量Table 2 Content of rutin and quecertin in Luobuma tea
3.2 流动相的选择
根据芦丁和槲皮素的极性大小[10],本文选择甲醇和水作为流动相。为确定甲醇和水的比例,分别选择在30∶70、40∶60 和50∶50 不同比例下对供试品溶液进行分析。结果表明,当甲醇和水的比例为40∶60 时,供试品中芦丁和槲皮素分离效果较好,且各峰对称性良好,既能达到基线分离的要求,又有适宜的保留时间。由芦丁和槲皮素的结构(图4)可知,两者结构中存在大量羟基,是酸解离基化合物,因此,为了抑制其解离以减少拖峰现象,在流动相中加入0.3 %磷酸作为酸抑制剂[11]。本实验流动相为甲醇:0.3 %磷酸水溶液=40∶60。

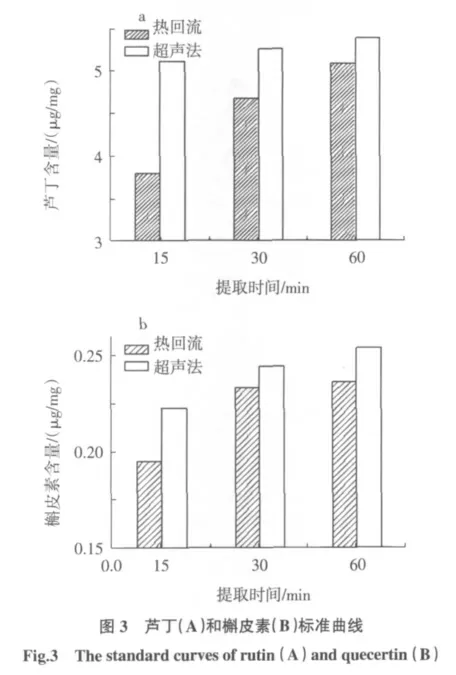
3.3 提取方法的选择
图5 为不同提取方法与芦丁和槲皮素提取效率的关系图。由图5 可知,在相同时间范围内,超声法对芦丁和槲皮素的提取量均明显高于热回流法。这是因为超声波是一种具有强弹性的波,其振动不仅会产生较大的能量,使体系温度升高,进而加速提取物在溶剂中的扩散,而且还会使媒质质点产生较大的速度和加速度,增加溶剂与提取物的接触面,快速穿透植物体,使植物中的有效成分快速从细胞中剥离出来进入溶剂[12-14],最终实现快速提取。
3.4 提取溶剂及浓度的影响
芦丁和槲皮素都是多羟基黄酮类化合物,极性较强,易溶于强极性溶剂,但其结构中具有苯环和碳碳双键等而微溶于水,所以在罗布麻茶叶芦丁和槲皮素含量的测定中,我们对不同极性的提取溶剂(如不同浓度的乙醇)进行单因素实验考察,实验结果如图6 所示。

由图6 可知,当乙醇浓度低于60%时,随乙醇浓度的增加,芦丁提取量变化不明显,槲皮素提取量明显增加;当乙醇浓度高于60%时,随着乙醇浓度的增加,芦丁的提取量明显减小,槲皮素提取量的变化较小。这可能是因为芦丁的结构中有羰基和羟基且分子量大,极性相对较强,而槲皮素结构中的羟基少,极性相对较弱的缘故。综合考虑,选择60%的乙醇作为提取溶剂。
3.5 超声时间的影响
超声时间的长短直接影响芦丁和槲皮素的提取量。图7 是不同超声时间与芦丁和槲皮素提取量的关系图。

由图7 可知,超声时间对黄酮类化合物芦丁和槲皮素的提取影响较大。随着超声时间的增加,芦丁和槲皮素的提取量同时增加,当超声时间超过60 min 后芦丁和槲皮素的提取量减小。这是因为在0~60 min内,溶剂蒸汽压和温度将随超声时间的增加而逐渐升高,大的蒸汽压和适宜的温度有利于芦丁和槲皮素的浸出,使芦丁和槲皮素的提取量逐渐增加。但是,提取过程是一个放热反应,温度越高越不利于芦丁和槲皮素的浸出[15]。所以当超声60 min 后,随着时间的延长,芦丁和槲皮素的浸出量逐渐变小。故本实验在超声时间为60 min 时,芦丁和槲皮素提取量最大。
3.6 料液比的影响
料液比是影响芦丁和槲皮素提取量的一个重要因素。图8 为芦丁和槲皮素的提取量与料液比的关系图。

由图8 可知,随着溶剂量的增加,芦丁和槲皮素的提取量均逐渐增大,当料液比为1∶15(g/mL)时,芦丁和槲皮素的提取量同时达到最大,当溶剂体积继续增加时,芦丁和槲皮素的量反而减小。这可能是由于当溶剂量在一定的范围内时,随着溶剂量的增加,罗布麻茶吸收的超声波能量不断增加,黄酮类化合物芦丁和槲皮素的浸出量逐渐增大;当溶剂体积过大时,罗布麻茶叶吸收能量变小,芦丁和槲皮素的溶解量也随之减小。因此,芦丁和槲皮素的最佳料液比是1∶15。
4 结论
本文建立了简便、快速的高效液相色谱法,同时测定了罗布麻茶中芦丁和槲皮素的含量,并对影响芦丁和槲皮素提取量的提取方法、提取温度、提取溶剂及料液比等因素进行研究。结果表明,芦丁在0.0342μg~0.684 μg(r=1.000 00)和槲皮素在0.024 8 μg~0.496 μg(r=0.999 90)范围内线性关系良好,其加样平均回收率分别为99.94%和99.48%,芦丁和槲皮素的精密度实验RSD 分别为0.45%和0.80%(n=5),适合罗布麻茶中芦丁和槲皮素的同时测定。采用超声法提取芦丁和槲皮素的效率大于热回流。超声法提取芦丁和槲皮素的最佳条件为:超声60 min,料液比1∶15,60%的乙醇为提取溶剂。本文的测定结果为罗布麻的进一步研究与开发应用提供一定的理论依据。
[1] 解成喜,张丽静,范维刚.反相高效液相色谱法测定罗布麻叶中芦丁的含量[J].天然产物研究与开发,2005,17:59-61
[2] Grundamamn O, Nakajima J,Seo S,et al. Anti-anxiety effects of Apocynum venetum L.in the elevated plus maze test[J].J Ethnopharmacol,2007,110:406-441
[3] Kaoru Irie,Takahiro Sato,Ippei Tanaka,Jun-ichiro Nakajima,Maiko Kawaguchi. Toshiyuki Himi. Cardiotonic effect of Apocynum venetum L.extracts on isolated guinea pig atrium[J].J Nat Med,2009,63:111-116
[4] Kazyaju Kamata,Shujiro Seo,Jun -ocjorp Nakajima. Constituents from leaves of Apocynum venetum L.[J]. J Nat Med,2008,62:160-163
[5] Yuchi Zhang,Chunming Liu,Zhengkun Zhang,et al. Comprehensive separation and identification of chemical constituents from Apocynum venetum leaves by high-performance counter-current chromate and high performance liquid chromatography coupled with mass spectrometry[J].Journal of Chromatography B,2010,878:3149-3155
[6] Oliver Grundmann,Jun -Jchiro Nakajima,Kazuaki Kamata,et al.Kaempferol from the leaves of Apocynum venetum possesses anxiolytic activities in the elevated plus maze test in mice[J].Phytomedicine,2009,16:295-302
[7] Leilei Wang,Guangting Han,Yuanming Zhang.Comparative study of composition,structure and properties of Apocynum venetum fibers under different pretreatments[J]. Carbohydrate Polymers,2007,69:319-397
[8] Veronika Butterweck,Kirsten Simbrey,Shujiro Seo,et al. Long-term effects of an Apocynum venetum extract on brain monamine levels and β-AR density in rats [J]. Pharmacology,Biochemistry and Behavior,2003,75:557-564
[9] Dong-Wook Kim,Takako Yokozawa,Masao Hattori,et al. Inhibitory Effects of an Aqueous Extract of Apocynum venetum Leaves and its Constituents on Cu2+-induced Oxidative Modification of Low Density Lipoprotein[J].Phytotherapy research,2000,14:501-504
[10] 刘焱,高智席,周光明.反相高效液相法测定金樱子中的芦丁和槲皮素[J].西南师范大学学报:自然科学版,2008,33(4):39-42
[11] 黎霜,莫蔚明,张治军,等.HPLC 法测定山绿茶中芦丁的含量[J].中国药师,2006,9(9):807-809
[12] Mauricio A.Rostagno,Miguel Palma,Carmel G.Barroso.Ultrasoundassisted extraction of soy isoflavones [J].Journal of Chromatography A,2003,1012:119-128
[13] 程新峰,付云芝,张小娇.超声法制备纳米材料的研究进展[J].无机盐工业,2001,42(11):1-3
[14] 杜娟,刘君,张楠楠,等.超声萃取黑水缬草精油的试验研究[J].黑龙江医药科学,2004,27(3):43-43
[15] Hui Xu,Ying Liao,Jinrong Yao.Development of a novel ulstrasoundassisted headspace liquid-phase microextraction and its application to the analysis of chlorophenols in real aqueous samples[J]. Journal of Chromatography A,2007,1167:1-8
