泡核桃壳多糖中单糖的组成及测定
2012-01-26张海珠邓水来张海马媛周萍
张海珠,邓水来,张海,马媛,周萍
(大理学院药学院,云南大理671000)
泡核桃Juglans sigillataD.又名漾濞核桃、茶核桃、铁核桃,系胡桃科Juglandaceae胡桃属Juglans植物。种植较广泛,主要分布于云南[1]、贵州、四川西部等,生长于海拔1 300~3 300 m山坡或山谷林中[2]。但核桃壳在核桃加工过程中一般作为废物弃掉或焚烧,造成严重污染环境,利用价值极低。随着环境、能源问题突现,开始重视核桃壳的研究。郑志锋等[3]研究了核桃壳的化学组分及不同品种、不同产地核桃壳化学组分的变异,为核桃壳这一废弃性再生资源的利用提供依据。核桃中含有大量的苷类、鞣质、没食子酸、挥发油等,具有消炎、收敛、生肌、泻下等作用,可用于口腔溃疡的治疗。除此之外,核桃壳由于本身的硬度,经特殊的物理化学处理可以制成核桃壳滤料,核桃壳活性碳以及一些工艺制品[4~8]。对核桃壳多糖的组成单体——单糖的测定尚未见报道。
1 试验仪器及材料
1.1 仪器Agilent 1200型高效液相色谱仪(美国Agilent公司),包括G1315A/B PAD检测器,G1315A ALS自动进样器;AE240天秤(梅特勒-托利多仪器(上海)有限公司);HH—S2s数显恒温水浴锅(金坛市大地自动化仪器厂);SZ—1快速混匀器(金坛市金城国胜实验仪器厂);LDZ4—0.8自动平衡微型离心机(北京医用离心机)。
1.2 试药D-葡萄糖醛酸(批号:14068-200602),D-甘露糖(批号:140651-200602)、半乳糖(批号:100226-200404)、D-阿拉伯糖(批号:1506-200203)、鼠李糖(批号:111683-200402)、D-半乳糖醛酸(批号:111646-200301)、葡萄糖(批号:111648-200406)对照品均购自中国食品药品检定研究院。乙酸铵(优级纯),乙腈(色谱纯,美国Tedia试剂公司),1-苯基-3-甲基-5-吡唑酮(1-phenyl-3-methyl-5-pyrazolone,PMP),冰乙酸均为分析纯,水为超纯水。泡核桃采集自云南省大理州漾濞县,由大理学院生药学教研室周浓副教授鉴定为胡桃科胡桃属植物泡核桃Juglans sigillata D.。
2 样品测定方法与结果
2.1 色谱条件Agilent Venusil XBP-C18色谱柱(4.6 mm×250 mm,5 μm),流动相为乙腈-醋酸铵缓冲液(醋酸铵-冰醋酸,pH 5.5)(19∶81),检测波长为250 nm,柱温为30℃,体积流量为1 mL/min。对照品溶液和供试品溶液进样体积10 μL。单糖HPLC色谱图见图1。

图1 HPLC色谱图Fig.1 HPLC chromatograms for identification
2.2 溶液的制备
2.2.1 对照品溶液的制备取80℃干燥至恒定质量的D-甘露糖、鼠李糖、D-葡萄糖醛酸、D-半乳糖醛酸、葡萄糖、半乳糖、D-阿拉伯糖对照品各4.35、4.18、4.39、4.75、4.59、4.27、4.05 mg,置2 mL量瓶中,加蒸馏水溶解并定容至刻度,摇匀,即得7种单糖的对照品混合贮备液(各种单糖的质量浓度约为2.0 mg/mL)。取单糖对照品混合贮备液200 μL于2 mL量瓶中,用蒸馏水稀释定容至刻度,摇匀,即得0.20 mg/mL的对照品溶液。
2.2.2 供试品溶液的制备泡核桃壳经10%NaOH浸泡24 h后,用冰醋酸调pH为中性,加1、2、4、6倍乙醇沉淀得到C、D、E、F提取物。精密称取4种提取物各20 mg,置于安瓿管中,注入2 mol/L三氟乙酸(TFA)水溶液2 mL,放入水浴锅中,沸水浴水解8 h,取出反应物,冷却至室温,加入NaOH溶液(2 mol/L)调节pH值至7.0,即得供试品溶液。
2.3 衍生化产物的制备[9]精密吸取各标准单糖混合溶液和供试品溶液各200 μL,依次加入0.3 mg/L NaOH 50 μL和0.5 mol/L PMP甲醇溶液50 μL,混匀,70℃水浴反应40 min,取出反应物,冷却至室温后,加入0.3 mol/L HCl溶液50 μL中和。加入200 μL三氯甲烷萃取,涡旋,离心收集上层,取上层水相,即得到衍生化后的混合单糖对照品溶液与核桃壳多糖水解样品溶液。
2.4 方法学考察
2.4.1 标准曲线绘制分别精密量取0.2 mg/mL的对照品溶液和2.0 mg/mL的对照品贮备液各50 μL、100 μL、200 μL置2 mL量瓶中,加水定容,摇匀,得系列质量浓度的对照品混合溶液。分别取200 μL各对照品溶液按2.3项下方法进行衍生化处理,制备不同质量浓度的线性工作液,在2.1项色谱条件下分别进样10 μL测定峰面积。以进样量X(μg)为横坐标,色谱峰面积Y为纵坐标绘制标准曲线。D-葡萄糖醛酸、D-甘露糖、半乳糖、D-阿拉伯糖、鼠李糖、D-半乳糖醛酸、葡萄糖的回归方程及其线性关系见表1。

表1 7种单糖的线性范围和回归方程Tab.1 Linear range and regression equation of calibration curve of 7 kinds of monosaccharide
2.4.2 仪器精密度试验取质量浓度为0.020 mg/mL的单糖混合对照品按2.3项下方法进行衍生化处理后,在上述色谱条件下精密吸取10 μL,重复进样6次,记录各种单糖对应的峰面积,测定结果表明D-甘露糖、鼠李糖、D-葡萄糖醛酸、D-半乳糖醛酸、葡萄糖、半乳糖、D-阿拉伯糖的峰面积RSD分别为:0.90%、1.02%、2.10%、1.82%、1.20%、0.85%、0.66%,符合分析要求。2.4.3重复性试验精密称取泡核桃壳F样品6份,按2.2.2项下进行水解操作,再按2.3项下方法进行衍生化处理,按2.1项色谱条件,进样10 μL测定,计录色谱峰面积,计算D-甘露糖、鼠李糖、D-葡萄糖醛酸、D-半乳糖醛酸、葡萄糖、半乳糖、D-阿拉伯糖的峰面积的RSD分别为:2.26%、2.65%、1.88%、2.14%、1.34%、2.89%。
2.4.4 稳定性试验取2.3项下泡核桃壳F样品溶液衍生化产物,按2.1项下色谱条件,于0、2、4、8、12 h分别测定样品峰面积,计算样品中各单糖的峰面积的RSD分别为D-甘露糖1.27%、鼠李糖7.75%、D-葡萄糖醛酸2.33%、D-半乳糖醛酸1.49%、葡萄糖1.81%、半乳糖0.84%、D-阿拉伯糖1.11%,说明供试品溶液中除了鼠李糖稳定性稍差外,其他单糖在12 h内稳定性良好。
2.4.5 加样回收试验称取泡核桃壳F样品9份,每份约10 mg,精密称定,置安瓿管中,分别加入不同量的含有D-葡萄糖醛酸、D-甘露糖、D-木糖、果糖、半乳糖、D-阿拉伯糖、鼠李糖、D-半乳糖醛酸、葡萄糖的单糖混合对照品溶液,制备低、中、高不同浓度的供试品溶液,每一浓度3份,按2.2.2项下进行水解操作,再按2.3项下方法进行衍生化处理,在上述色谱条件下,吸取10 μL进样进行测定,计录色谱峰面积,分别进行色谱分析,结果见表1。结果表明,D-甘露糖、鼠李糖、D-葡萄糖醛酸、D-半乳糖醛酸、葡萄糖、半乳糖、D-阿拉伯糖的平均回收率分别为95.9%、103.1%,104.6%、97.5%、95.8%、87.5%、98.1%,RSD分别为2.66%、2.35%、1.92%、1.87%、2.14%、2.89%、2.72%。由结果可知回收率较好,方法可行。
2.5 样品测定取泡核桃壳提取的C、D、E、F组分20 mg各3份,精密称定,分别按2.2.2项下进行水解操作,再按2.3项下方法进行衍生化处理,在上述色谱条件下,进样10μL测定。根据标准单糖的保留时间确定核桃壳多糖中含有D-葡萄糖酸、D-甘露糖、半乳糖、D-阿拉伯糖、鼠李糖、D-半乳糖醛酸、葡萄糖。在核桃壳C组分中9号峰为未知糖;在核桃壳D、E组分中,9号、10号、11号和12号峰为未知糖;在核桃壳F组分中,9号、10号和12号为未知糖。以本实验的7种已知糖的总量为100%,根据所测得的峰面积计算核桃壳C、D、E、F中所含几种糖的相对平均含有量,结果见表2。
3 讨论
3.1 衍生化试剂的选择糖既没有紫外吸收,也不产生荧光,因此本实验采用衍生化方法来对糖进行分析,建立了核桃壳多糖中单糖的组成和含有量的检测方法。通过适宜的衍生化方法和适合的高效液相色谱法分析条件,进行试验,得到较好的分离分析效果。目前糖的色谱检测方法,大多数采用衍生化后直接检测的方式。糖自身所具有的衍生化基团包括羟基、醛基或酮基等,可以实现还原或选择性酰胺化衍生操作,还可以通过缩合等反应衍生[10-11]。PMP柱前衍生化高效液相色谱分析单糖的方法准确可靠,灵敏度较高,可同时进行多种单糖检测分离,且各单糖间具有理想的分离度,不仅可以检测出中性糖,而且还可同时检测糖醛酸和碱性糖,并可进行定量分析,适合于单糖组成较为复杂的多糖样品分析。取样量少,且具有简易、实用等特点,适用于微量多糖样品的单糖组成及含量的测定。
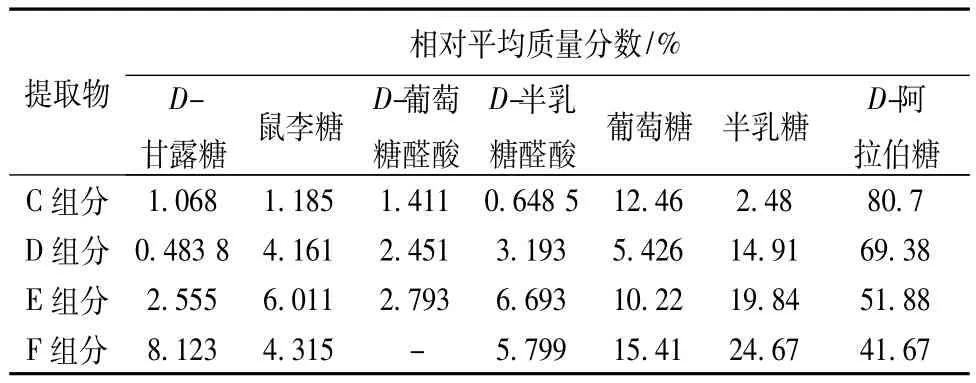
表2 漾濞泡核桃核桃壳C、D、E、F组分中单糖组成及相对平均含有量Tab.2 Average contents of polysaccharide C、D、E and F in walnut shell from Yangbi Yunnan
3.2 有机萃取剂体积的选择柱前衍生需使用过量的衍生化试剂以达到衍生化完全的目的,但若衍生化试剂随样品进入HPLC不但会影响实验结果,而且还会损坏色谱柱。因此在进样之前必须除去过量的衍生化试剂,以清除衍生化试剂的干扰,延长色谱柱的使用寿命。有机萃取溶剂多为三氯甲烷,用量在100 μL~300 μL之间[12-13],本实验通过不同体积萃取溶剂对实验结果影响的条件考察,最终确定有机萃取溶剂体积为200 μL时,对实验结果的影响最小。
3.3 本实验确定了云南漾濞泡核桃壳提取物C、D、E、F组分中单糖的组成和含有量,发现C、D、E组分均含有D-甘露糖、鼠李糖、D-葡萄糖醛酸、D-半乳糖醛酸、葡萄糖、半乳糖、D-阿拉伯糖,F组分中除D-葡萄糖醛酸外含有其余的6种单糖,在检测到的7种单糖中D-阿拉伯糖的相对平均含有量最高,并且又标记出4种未知的单糖。本实验组前期研究发现云南漾濞泡核桃壳提取物C、D、E、F组分均具有良好的抗病毒活性,其这一活性作用和其所含有的单糖成分之间是否存在一定的关系还要进行进一步的研究。
通过本次实验,为核桃壳的充分利用提供了一定的理论依据。同时也对云南漾濞泡核桃壳的研究利用提供一定的参靠价值,有利于核桃壳研究的进一步发展。本次试验的单糖定量测定方法,不仅可提供核桃壳多糖的单糖组成的基本信息,且可推广应用到其他多糖组成的分析。
[1]黄俊杰,柏斌.大理核桃基地面积达35万公顷[J].中国果业信息,2009,26(8):48.
[2]中国科学院中国植物志编委会.中国植物志[M].北京:科学出版社,1979:31-32.
[3]郑志峰,邹局春,花勃,等.核桃壳化学组分的研究[J].西南林学院学报,2006,26(2):33-36.
[4]董瑞,肖凯军,任源.H3PO4法制备核桃壳活性炭及其处理啤酒废水的研究[J].现代食品科技,2011,27(8):960-964.
[5]丁浩,刘少聪,施雪军,等.核桃壳制备活性炭的电化学性能研究[J].四川化工,2011(4):24-27.
[6]余梅芳.核桃壳制备活性炭方法及吸附性能的研究[J].湖州职业技术学院学报,2011,9(1):79-81.
[7]李秀玲,赵朝成.核桃壳质活性炭的制备及吸附恶臭气体的研究[J].环境科技,2009,6:32-34.
[8]韩洪森,汪龙眠.核桃壳滤料污染后的清洗再生[J].黑龙江科技信息,2008(31):8.
[9]宝炉丹,徐国防,马郑,等.柱前衍生化HPLC分析白花蛇舌草多糖中单糖组成[J].中成药,2008,30(3):406-408.
[10]程宾,梁成罡,杨化新.柱前衍生化反相高效液相色谱法定量测定重组人促卵泡激素中的单糖[J].药物分析杂志,2008,28(9):1454-1458.
[11]杨兴斌,赵燕,周四元,等.柱前衍生化高效液相色谱法分析当归多糖的单糖组成[J].分析化学,2005,33(9):1287-1290.
[12]任浩娜,陈晓辉,毕开顺.柱前衍生化HPLC法分析沙参多糖中单糖组成[J].沈阳药科大学学报,2009,26(3):206-209.
[13]栾海云,李金莲,王少华,等.柱前衍生化HPLC法检测兔血浆和肝组织中左卡尼汀及其代谢物的含量[J].中国临床药理学与治疗学,2010,15(6):636-640.
