黄药子毒性组分对肝细胞内Ca2+浓度的影响
2012-01-26王加志刘树民汤青李伟
王加志,刘树民,汤青,李伟
(1.黑龙江中医药大学佳木斯学院,黑龙江 佳木斯 154007;2.黑龙江中医药大学中医药研究院,黑龙江 哈尔滨 150040)
黄药子临床应用时肝损害时有报道[1],表明人们对用药安全的关注日益加深。本研究组前期研究发现,黄药子的肝损害作用与氧化应激有关[2]。本研究通过对肝细胞内Ca2+浓度的初步研究,探讨氧化应激与肝细胞内Ca2+的变化情况,为从细胞凋亡及信号转导方面研究中药肝损害奠定基础。
1 仪器与试剂
1.1 实验仪器
LSM-510-META激光共聚焦扫描显微镜(德国ZEISS公司);倒置式显微镜(Axiovert 200 MBP);BQ 50-1J恒流泵(河北保定兰格恒流泵有限公司);KDC-160HR高速冷冻离心机(科大创新股份有限公司中佳分公司)。
1.2 试剂
FLUO-3 AM(美国分子探针(AP)公司);胰蛋白酶(美国SIGMA公司);Ⅳ型胶原酶(美国SIGMA公司);PBS(美国SIGMA公司);DMEM培养基(美国SIGMA公司);DMSO(美国SIGMA公司);试剂均为国产分析纯。
1.3 实验动物
雄性SD大鼠4只,体质量(250±20)g,由黑龙江中医药大学药物安全评价中心(GLP)提供,动物质量合格证书号:医动字第01-10-2号。
1.4 实验药物
黄药子购于黑龙江省药材公司,产地河北,经黑龙江省药检所鉴定为薯蓣科植物黄独(Dioscorea bulbifera L.)的块茎。黄药子二萜内酯类组分制备按前期实验[3],其在原药材中含量为 0.568%。
1.5 动物分组及给药量
SD大鼠4只,分为空白对照组、肝毒性组各2只,灌胃给药,肝毒性组给药量为0.064 8g/kg,相当于生药2.85g/kg。日两次,空白对照组为含吐温-80同等浓度的蒸馏水,共7天。
1.6 样品制备
1.6.1 细胞内Ca2+测定样品
取SD雄性大鼠4只,于末次给药12h后,断椎处死,把整个动物浸入盛有75%乙醇的烧杯中数秒钟消毒,取出后放在大平皿中携入超净台。用消毒的剪刀剪开腹部皮肤,暴露肝脏,置于无菌灌流台中,加胶原酶50mg于灭菌的 PBS液200ml中,循环灌洗肝脏15min,然后用眼科手术剪刀仔细将组织反复剪碎,直到成1mm3左右的小块,再用PBS清洗,移入无菌离心管中,加入0.25%的胰蛋白酶适量,37℃水浴中消化8~10min,每隔几分钟摇动一下试管,使组织与消化液充分接触,静止,吸去上清,向离心管中加入5~10ml含5%小牛血清的DMEM培养基,用吸管吹打混匀,即得。
1.6.2 FLUO -3 AM 工作液的配制
FLUO-3 AM 50μg溶解于40μl无水二甲基亚砜(DMSO)中即成贮备液,贮备液加入DMEM培养基
基金项目:黑龙江省中医药管理局资助课题(ZHY10-Z02)
作者简介:王加志(1977-),男,副教授,博士,主要从事中药药性理论研究。
通讯作者:刘树民(1963-),男,教授,博士研究生导师,主要从事中药临床药效物质基础研究及中药药性理论研究。
收稿日期:2012-06-12
修回日期:2012-07-10
10ml即得4.4μm 的工作液。
FLUO-3的共聚焦显微镜激发光峰值波长为490nm,用于检测的荧光峰值波长为525nm,扫描点面积 0.053 1mm2。
1.6.3 FLUO -3 染色方法
使用时按实际情况将工作液适当稀释,最低稀释至浓度为2μm。取细胞悬液100μl,加入10μl荧光染料,加入DMEM培养基至1 000μl,培养箱中37℃反应15min后测定,从染料加入到测定完成,不超过40min。本实验使用的浓度为2.2μm。
2 结果
细胞内Ca2+测定结果:在生理情况下,Ca2+作为细胞内第二信使,在维持细胞增殖、分裂、运动、能量代谢、氧代谢、Ca2+依赖蛋白激酶和磷脂酶的激活等方面发挥着重要作用。而这种作用的正常发挥则依赖于肝细胞内液约为0.2μmol/L的Ca2+浓度和细胞外液约1.3mmol/L的Ca2+浓度,即肝细胞始终处于胞内外1万倍浓度梯度差,悬殊的电化学梯度正是Ca2+发挥第二信使作用所必需的,也表明肝细胞内有着强有力的Ca2+稳态调节机制。内质网和线粒体是胞内最主要的钙库,因而线粒体和内质网在胞内钙稳态调节中起着主导作用。以空白对照组大鼠肝细胞内钙离子浓度为基准,评价干预因素黄药子毒性组分对肝细胞内钙离子的影响。
空白组:空白组细胞数量多,形态规整,荧光染料染色均一,亮度适中,以背景形鲜明对照,适合观察,证明以fluo-3为荧光染料负载的细胞悬液样品制备成功。
黄药子组:同等条件下制备的细胞悬液中,细胞数量最少,在相同的观察条件下,细胞的荧光亮度最强,说明细胞内游离Ca2+含量增高。结果见图1。
3 讨论
本实验使用激光扫描共聚焦显微镜技术和新一代的胞内游离Ca2+探针fluo-3/AM(典型的单波长荧光探针),发射波长较长,荧光选择性强,自身无荧光,只有与乙酰甲酯AM相连方可进入细胞内,被细胞内酯酶水解并与游离钙结合后才发出荧光,能有效地避免非特异性染色,不需要紫外光激发,避免了紫外光对活细胞样品的损伤,不需要制作工作曲线。
Ca2+作为主要的细胞内信使,同时也是内质网-线粒体交流的主要“语言”,与凋亡密切相关。细胞质内钙离子浓度的升高会导致钙离子转移到线粒体[4-5],引起线粒体 Δψm 下降,损伤线粒体,诱导细胞凋亡。线粒体膜的损伤又可导致Ca2+进一步升高,形成恶性循环,加重细胞的损害。
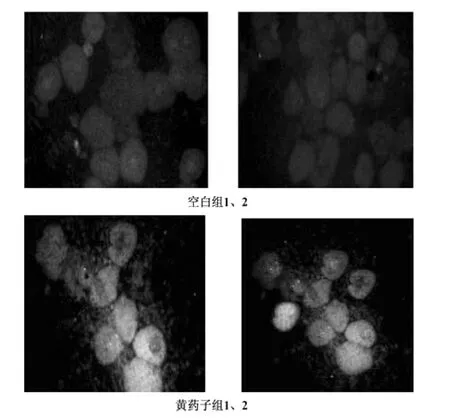
图1 钙离子激光共聚焦扫描图
黄药子可损伤肝细胞线粒体,并生成大量的氧自由基[3],线粒体损伤后,肝细胞ATP缺乏,胞膜受损,跨膜Ca2+内流增加,内质网等胞内钙库释放Ca2+增多,胞膜Ca2+泵排Ca2+能力和内质网膜Ca2+-Mg2+-ATP酶摄Ca2+能力减弱,结果导致胞浆内钙超载,线粒体保护性摄取胞浆内游离Ca2+以平衡钙稳态,最终会导致自身钙超载,故肝细胞钙超载必然伴随线粒体钙超载。
[1]李维昌,杨军,李惠文,等 黄药子致药物性肝病1例[J].临床合理用药,2009,2(15):79.
[2]李伟,赵艳,汤青,等.黄药子醇提物肝脏毒性部位筛选研究[J].中医药信息,2009,26(1):28 -29.
[3]王加志.黄药子中二萜内酯类成分对大鼠肝细胞损伤作用的实验研究[J].药物不良反应杂志,2009,11(1):13 -16.
[4]洪莉,蔡威.凋亡与肝细胞损伤机制的研究进展[J].临床小儿外科杂志,2006,5(1):42 -46.
[5]Kim JH,Choi S,Jung JE,et al.Capacitative Ca2+entry is inv - olved in regulating soluble amyloid precursor protein(sAPPα)release me-diated by muscarinic acetylcholine receptor activation in neuroblastoma SH - SY5Y cells[J].J Neurochem,2006,97(1):245-254.
