果胶酶法提取番茄总皂苷的工艺研究
2012-01-25陈思呈刘金磊卢凤来李典鹏
陈思呈,刘金磊,卢凤来,李典鹏*
(1.广西壮族自治区中国科学院广西植物研究所,广西桂林541006;2.广西师范大学生命科学学院,广西桂林541004)
番茄Lycopersicon esculentum Mill.为茄科番茄属植物,原产南美洲,我国各地均普遍栽培。番茄皂苷为番茄中水溶性成分,而番茄红素为番茄中脂溶性成分,在加工生产番茄红素过程中,往往需要脱水而将番茄皂苷白白损失浪费掉。目前国内还很少有番茄皂苷的研究报道,日本的研究人员在番茄皂苷的理化性质及药理活性方面进行了深入而广泛的研究,并证明番茄皂苷尤其是主要成分番茄皂苷A(esculeoside A)具有多种生理和药理活性,其在降血脂及抗动脉粥样硬化方面具有独特的作用[1-2]。
目前国内外尚未见番茄皂苷提取工艺的研究报道。选用适当的酶作用于药用植物材料,破坏细胞壁的致密构造,有利于有效成分的溶出,以提高目标物质的得率[3]。果胶酶(pectinase)是能够分解果胶物质的多种酶的总称[4],果胶酶作用于果胶质中D-半乳糖醛酸残基之间的糖苷键,使高分子的聚半乳糖醛酸降为小分子物质[5]。本实验首次建立了番茄总皂苷果胶酶酶解的工艺,为进一步研究番茄皂苷提供了依据。
1 试药与仪器
1.1 实验仪器Agilent1200高效液相色谱仪(美国Agilent公司);2000ES蒸发光散射检测器(美国Alltech公司);安捷伦化学工作站(美国Agilent公司);R-3旋转蒸发仪(瑞士步琪有限公司);TL-5.0台式离心机(上海市离心机械研究所);TP-2200B电子天平(湘仪天平仪器设备有限公司);METTLER AT200分析天平(上海涵今仪器仪表有限公司);B3500S-MT超声清洗器(必能信超声有限公司);L-550离心机(湘仪离心机仪器有限公司);Christ Alpha 1-2实验室高级冻干机(德国Martin Christ公司);MILLIPORE Simplicity超纯水器(上海人和科学仪器有限公司);果汁机(九阳股份有限公司)。
1.2 实验材料新鲜成熟樱桃小番茄,购自桂林资源县番茄种植基地;自制番茄皂苷A标准品(经核磁共振谱1HNMR,13C-NMR鉴定其结构,HPLC-ELSD法测定得出纯度为98.9%)。
1.3 化学试剂果胶酶(型号:PP-3,天津利华酶制剂技术有限公司);甲醇(美国TEDIA公司,色谱纯);重蒸蒸馏水(自制);超纯水(自制);去离子水(自制)。
2 方法与结果
2.1 番茄皂苷A的测定番茄皂苷A在HPLC-ELSD检测法中显示其相对含有量占总皂苷的很大的部分,其它皂苷类物质则含有量很低[6],因此后续大部分工艺环节主要以番茄皂苷A为考察指标。同一批次番茄打浆酶解后直接通过测定番茄皂苷A的浓度来评价工艺参数,可以减少过多的后续操作带来计算结果上的误差。番茄中的皂苷主要为甾体皂苷,而由于甾体皂苷具有无紫外吸收或吸收极弱的特点,其检测存在很大的困难[7],目前据文献报道的、蒸发光散射检测已经成功地应用于酸枣仁皂苷、人参皂苷、黄芪皂苷等的定量分析与检测[8]。因此对其测定方法及条件进行了研究。
2.1.1 番茄皂苷A标准品的配制精密称取10.00 mg番茄皂苷A标准品,用50%甲醇水溶液(在此浓度的溶剂中有最好的溶解度)定容到50 mL,配置成质量浓度为0.2 mg/mL,即0.2 μg/μL的番茄皂苷A标准品溶液。
2.1.2 色谱条件的确立色谱柱:ZORBAX SB-C18柱(4.6 mm×150 mm,5 μm);柱温:30℃;流动相:甲醇-水(梯度洗脱:0→5 min:20%→40%甲醇;5→10 min:40%→60%甲醇;10→20 min:60%→80%甲醇);检测时间:20 min;后运行时间:5min;流动相体积流量:0.8 mL/min;ELSD检测器参数:漂移管温度:100℃。空气:2.7L/min。见图1。
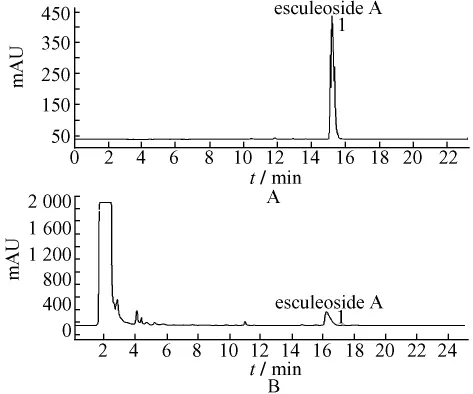
图1 对照品和样品的HPLC色谱图
2.1.3 标准曲线的制备依次精密吸取0.6、1.2、1.8、2.4、3.6、4.2 μg的标准品溶液,以进样量(μg)的常用对数值为横坐标,峰面积积分值的常用对数值为纵坐标,绘制标准曲线,计算回归方程。回归方程为:Y=1.697 4X+5.717 3,R2=0.999 6。番茄皂苷A在0.6~4.2 μg范围内有良好的线性关系。
2.1.4 精密度实验标准品溶液连续进样6次,每次15 μL,记录峰面积,计算峰面积及相当于番茄皂苷A质量的RSD值,其中峰面积RSD为1.01%,番茄皂苷A质量RSD为0.61%,结果表明,仪器精密度良好。
2.1.5 稳定性实验精密称取粗皂苷粉末102.00 mg,定容至50 mL,0~10 h分别检测,记录峰面积,计算峰面积及质量的RSD值。其中峰面积RSD为2.95%,番茄皂苷A质量RSD为1.73%,结果表明,供试样品在10 h内稳定。
2.1.6 重复性实验精密称取6份粗皂苷粉末,每份100 mg,定容至50 mL,检测并记录峰面积,计算峰面积及质量的RSD值。其中峰面积RSD为2.17%,番茄皂苷A质量RSD为1.31%,结果表明,供试样品重复性良好。
2.1.7 加样回收率实验精密称取4份测定过番茄皂苷A含有量的粗皂苷粉末,每份约100 mg。精密称取番茄皂苷A标准品4份,每份2 mg,分别加到4份样品中,最后定容到50 mL。检测峰面积,求算回收率、平均回收率和RSD值。平均回收率为96.03%,RSD为0.41%,结果表明实验方法准确度较高,符合测定要求。
2.2 酶解单因素实验
2.2.1 酶添加量对酶解效果的影响将番茄打成匀浆,精密称量9份,每份1 kg,放入烧杯中,分别加入相当于鲜果质量0.0、0.1‰、0.2‰、0.3‰、0.4‰、0.5‰、0.6‰、0.7‰、0.8‰的果胶酶,在50℃条件下恒温酶解2.0 h,立即取出离心,液相检测其中番茄皂苷A的峰面积,计算其质量浓度,平行2份,结果取平均值。由图2可知,随着添加酶量的增加,开始时清液中番茄皂苷A质量浓度逐渐升高,超过0.5‰后逐渐下降。有文献报道果胶酶制取总皂苷相关工艺,分析其中的原因可能是,当继续加大酶量,底物浓度不能对酶达到饱和,导致酶的作用受到抑制,造成皂苷得率下降[9-10],孟硕等实验证明单一果胶酶对苷键亦有一定的水解作用[11]。实验用的果胶酶,其中可能存在一些竞争性抑制因子,则会抑制果胶酶与底物的结合,杂质糖苷酶的存在也会造成皂苷类物质糖苷键的水解。但是一定量果胶酶的加入,增加了番茄浆的澄清度和可过滤性,使得后续的离心及过柱更简便易行[12],因此选定最佳酶加入量为0.4‰。
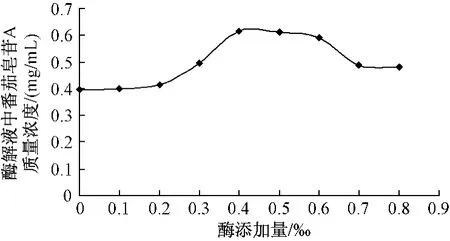
图2 酶添加量对番茄皂苷A质量浓度影响
2.2.2 酶解反应温度对酶解效果的影响将番茄打成匀浆,精密称取7份,每份1 kg,放入烧杯中,加入0.4‰果胶酶,在35、40、45、50、55、60、65℃条件下恒温酶解2 h,离心,检测上清液中番茄皂苷A峰面积,并计算其质量浓度。由图3可知,当酶解温度达到50℃时,番茄皂苷A的质量浓度达到最高。
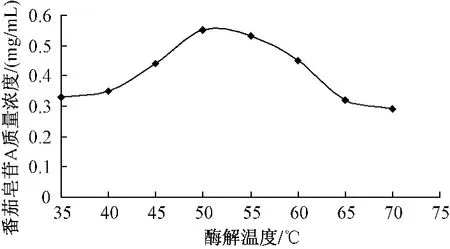
图3 酶解温度对番茄皂苷A质量浓度影响
2.2.3 酶解反应pH值对酶解效果的影响将番茄打成匀浆,精密称取7份,每份1 kg,放入烧杯中,pH值分别调到2.5、3.0、3.75(番茄汁自身pH值)、4.0、4.5、5.0、5.5、6.0、6.5、7.0(调到7.0时颜色突然变深)。加入0.4‰果胶酶,在50℃条件下恒温酶解2 h,离心,检测上清液中番茄皂苷A峰面积,并计算其质量浓度。由图4可知,当酶解pH值为3.75~5.0时,酶解液中番茄皂苷A质量浓度最大。

图4 酶解pH值对番茄皂苷A质量浓度影响
2.2.4 酶解反应时间对酶解效果的影响将番茄打成匀浆,精密称取7份,每份1 kg,放入烧杯中,加入0.4‰果胶酶,在50℃,pH4.0下,分别酶解0.5、1.0、1.5、2.0、2.5、3.0、3.5 h,每份酶解液取出后,立即离心,检测上清液中番茄皂苷A峰面积,并计算其质量浓度。由图5可知,当酶解时间达到2 h时,酶解液中番茄皂苷A质量浓度达到最大。

图5 酶解时间对番茄皂苷A质量浓度影响
2.3 番茄酶解正交实验考虑到以上酶解单因素对番茄皂苷A提取效果均有不同程度的影响,并且4个单因素之间存在着交互的作用。因此,选取这4个单因素,在3个不同水平上,按照L9(34)正交表设计正交实验。
2.3.1 正交因素与水平的设计见表1。

表1 正交试验因素与水平设计
2.3.2 正交实验结果及方差分析见表2,表3。
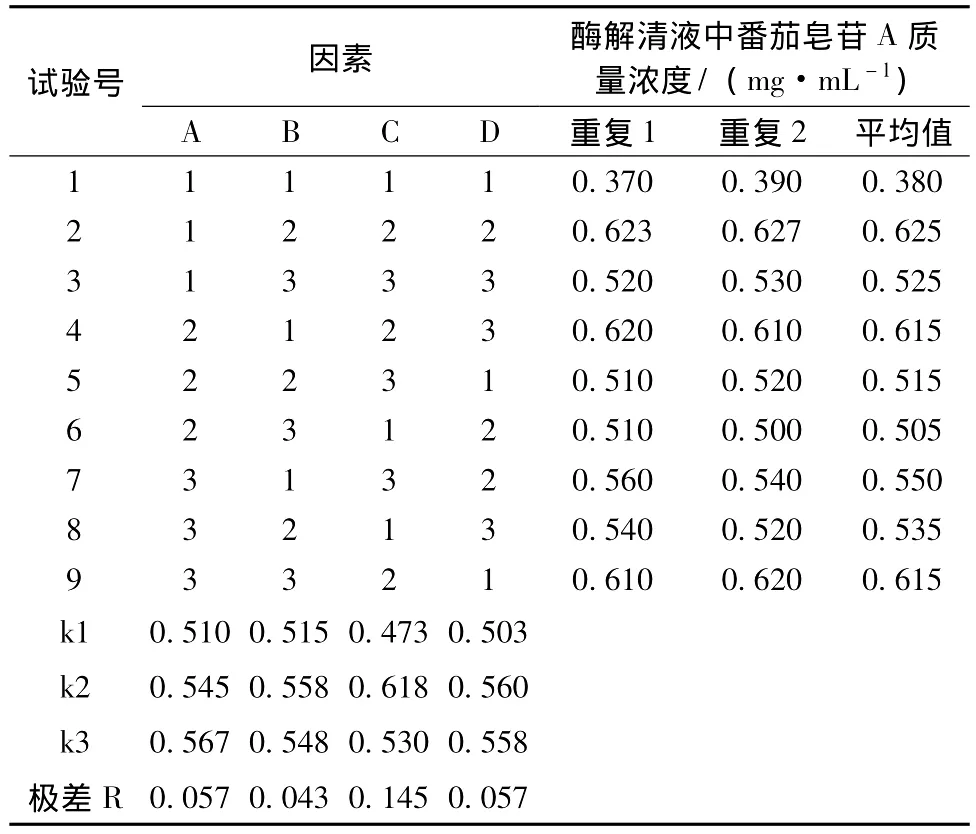
表2 正交试验结果与分析
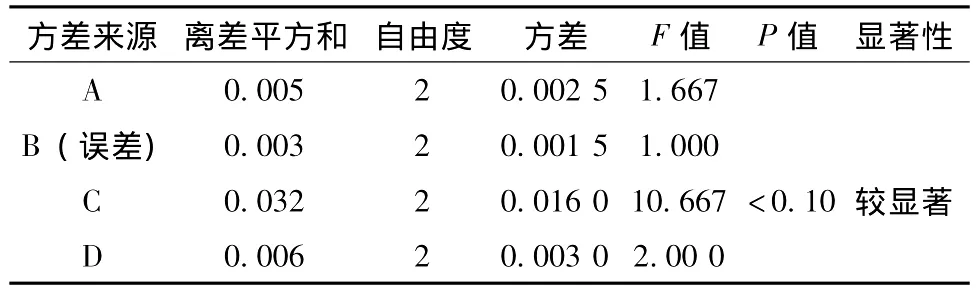
表3 方差分析
由极差分析及方差分析可知,酶解法制得番茄清液中,番茄皂苷A质量浓度或得率的影响因素主次顺序为:C>D>A>B,即影响酶解法中番茄皂苷A质量浓度的因素依次是:酶用量>酶解pH>酶解温度>酶解时间。其中在所选定的3个水平下,酶添加量对番茄皂苷A的质量浓度影响比较显著。
因此确定酶解法最佳提取条件为:A3B2C2D2,即最佳提取工艺为:酶解温度55℃,酶解时间2 h,酶添加量0.4‰,pH4.0。
2.4 酶解工艺的验证实验精密称取同一批次西红柿6份,每份45 kg,分为加酶组和不加酶组,每组3份,加酶组机器打浆后按优选出的最佳工艺条件进行酶解,并经过大孔树脂吸附制取总皂苷。另一组不加酶,机器打浆后直接离心过大孔柱吸附制取总皂苷。结果见表4,加酶组所得总皂苷平均得率为0.25%,明显高于不加酶组的0.14%。并且在实验中发现,不加酶组所得番茄汁含有大量絮状细胞团,给离心及过柱带来了极大困难。此外,由于番茄水分经冷冻干燥法测定高达90%以上,在大生产中若采用溶剂提取法则很难实现,综合考虑成本及可操作性,果胶酶法明显优于其他提取法。
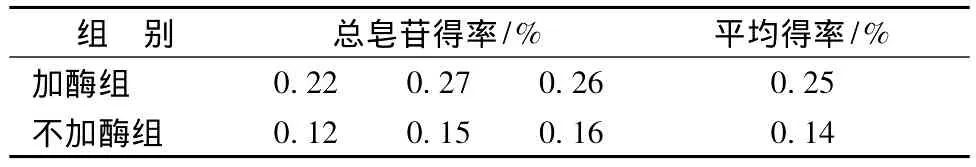
表4 不同提取法总皂苷得率比较
3 分析与讨论
3.1 番茄果实含水量高,经测定在90%以上,若采用溶剂提取法则操作困难,成本必将很高。为使工艺过程更为高效而低成本,首先采用机械破碎的方式使大量细胞破壁促进内含物充分释放。机械破碎后得到的番茄浆黏度大,且存在大量未被充分破碎的细胞。为了使番茄细胞充分破碎及分离以提高番茄皂苷的得率及后续的过柱性能,本实验设计采用果胶酶法并优化其条件,实验证明酶解工艺是高效可行的。
3.2 通过对影响酶解效率的4个因素进行单因素实验,在单因素的基础上对这4个单因素在3个水平上,按照L9(34)进行正交设计,实验平行2份,对结果进行直观分析及方差分析,得出最佳酶解工艺条件为:酶解温度55℃,酶解时间2 h,酶添加量0.4‰,pH4.0。其中在所选定的3个水平下,酶添加量对番茄皂苷A的质量浓度影响比较显著,因此在实际生产中,对果胶酶的用量要严格控制。
[1]Fujiwara Y,Kiyota N,Hori M,et al.Esculeogenin A,a New tomato sapogenol,ameliorates hyperlipidemia and atherosclerosis in ApoE-deficient mice by inhibiting ACAT[J].Arterioscler Thromb Vasc Biol,2007,27(11):2400-2406.
[2]Tran QL,Tezuka Y,Banskota AH,New spirostanol steroids and steroidal saponins from roots and rhizomes of Dracaera angustifolia and their antiproliferactive activity[J].J Nat Prod,2001,64(9):1127-1132.
[3]余洪波,张晓昱.酶法在中药提取中的研究进展[J].中成药,2005,27(5):591-593.
[4]蓝峻峰,刘琨.叶下珠有效成分的果胶酶法提取工艺[J].中药材,2010,33(1):135-137.
[5]李和生,孙玉喜,王鸿飞.果胶酶降解壳聚糖工艺优化及特性动态变化分析[J].农业机械学报,2006,37(1):83-86.
[6]卢凤来,刘金磊,陈月圆,等.高效液相色谱-蒸发光散射检测法测定番茄中的番茄皂苷A[J].色谱,2010,28(9):908-911.
[7]赵江琼,易以木,徐壹.香草醛比色法测定葱白提取物中总皂苷含量[J].医学导报,2007,26(9):1075-1076.
[8]师文添,赵大云.HPLC-ELSD测定大豆皂苷含量[J].食品工业科技,2010(12):346-348.
[9]苏东林,单杨.酶法辅助提取柑桔皮总黄酮的工艺优化研究[J].农业工程学报,2008,24(4):240-245.
[10]林硕,岳琳娜,高学玲,等.果胶酶提取绞股蓝皂苷的工艺研究[J].中国食物与营养,2009(4):21-24.
[11]孟硕,张鹏,刘建勋,等.果胶酶水解法对栀子提取液中环烯醚萜类成分的影响[J].中国实验方剂学杂志,2011,17(6):10-12.
[12]郑瑞婷,刘长海,马菽浩,等.果胶酶制取苹果汁的优化工艺研究[J].广东农业科学,2010(5):110-111.
