蛹虫草发酵产物新纤溶酶的分离纯化*
2012-01-24刘晓兰张雯舒郑喜群沈媛孙莹
刘晓兰 张雯舒 郑喜群 沈媛 孙莹
(齐齐哈尔大学农产品加工黑龙省普通高校重点实验室,黑龙江齐齐哈尔161006)
血栓性疾病严重危害人类健康,其致残率和死亡率较高[1],现代医学的溶栓疗法是血栓性疾病安全而有效的治疗手段[2].国内外已应用于临床使用的溶栓剂(如尿激酶、链激酶、葡激酶等)虽药效较好,但均存在不同程度的副作用,而且价格昂贵.因而寻找和开发高效的抗栓溶栓药物,仍是国内外学者重点关注的课题.溶栓剂来源十分广泛;微生物生长速度快,生命活动周期短,生长条件容易控制,可以通过人工控制发酵条件获取大量的目的产物,从而在产溶栓剂方面展现出广阔的前景.
蛹虫草(Cordyceps militaris(L.)Link)又名北冬虫夏草,是虫草属的模式种,与中华冬虫夏草同属于真菌门(Eumycota)、子囊菌亚门(Ascomycotina)、核菌纲(Pyrenomycetes)、球壳目(Sphaeriales)、麦角菌科(Clavicipitaceae)、虫草属(Cordyceps)[3].蛹虫草在我国的黑龙江、吉林、辽宁等省份均有野生分布[4],是名贵的食药兼用大型真菌,且药理作用十分广泛[5-8].蛹虫草可以生产并分离纯化出纤溶酶[9],笔者推测由蛹虫草生产并分离纯化出的纤溶酶具有良好的安全可靠性,很有可能成为一种新型的溶栓剂或功能性食品基料,将其用于防治血栓栓塞症,前景十分广阔.
纯化蛋白的设备和生产成本相当昂贵,在应用生物化工、基因工程等方法生产药用蛋白的生产总成本中,分离和纯化要占70%~90%.制备色谱是多数蛋白纯化工艺的必需步骤.与治疗蛋白较昂贵的销售价格相比,制备色谱是一个可接受的技术.因色谱技术的可塑性很强,如果应用得当,其成本可以大幅降低,所以色谱分离和纯化蛋白技术研究更趋活跃.从每一步色谱分离最优化条件来讲,涉及固定相、流动相、流速、洗脱方式、活性回收率等参数的选择.到目前为止,虽有一些规律可循,但主要还是用实验方法来确定.
近年来陆续有学者对蛹虫草子实体及深层培养产生的纤溶酶进行了研究.徐同[9]在人工培养蛹虫草子实体时,发现生长的菌丝体含有纤溶酶,其采用硫酸铵盐析、羧甲基(CM)阴离子交换层析和Sephacryl S-200凝胶过滤对纤溶酶分离后,初步测定的纤溶酶相对分子质量为31800.Kim等[10]发现蛹虫草子实体含有纤溶酶,采用二二乙氨乙基-琼脂糖 (DEAE-Sephadex A-50)、Sephadex G-75和Superdex 75层析从比酶活为3.3 U/mg的子实体抽提液中分离得到相对分子质量为52000的纤溶酶,酶活回收率为12.9%,比酶活为633 U/mg.崔莉等[11-12]用硫酸铵盐析和Superdex 75凝胶层析方法从纤溶酶比酶活为0.02U/mg的蛹虫草深层培养液中分离纯化得到新型纤溶酶,酶活回收率为6%,比酶活为 1.77U/mg.宿红艳等[13]采用盐析和 DEAESepharose离子交换层析对液体深层培养产生的纤溶酶进行了粗提纯,研究了粗酶的部分酶学性质.笔者课题组近年来发现,从大兴安岭地区采集分离的蛹虫草经深层培养后产生了新的纤溶酶[14],本研究对蛹虫草液体深层发酵产生的纤溶酶的分离纯化方法进行改进,可为蛹虫草纤溶酶性质和功能性试验的开展提供样品制备的基础.
1 材料与方法
1.1 材料和仪器
蛹虫草菌(Cordyceps militaris)由齐齐哈尔大学食品与生物工程学院提供.牛血纤维蛋白原和牛凝血酶为中国医学科学院天津血研所产品;低相对分子质量标准蛋白质(Marker,14400~97400)购自上海西巴斯生物技术开发有限公司;丙烯酰胺、N,N'-甲叉双丙烯酰胺、十二烷基硫酸钠(SDS)购自Sigma公司;Sephadex G-25填料、Phenyl-Sepharose HP填料、CM-Sepharose FF填料、凝胶过滤色谱预装柱Superdex 75(φ1.6cm ×60 cm)、AKTA prime蛋白质纯化系统购自美国GE公司.其余试剂均为进口或国产色谱纯或分析纯试剂.
1.2 方法
1.2.1 纤溶酶酶活和蛋白质浓度的测定
纤溶酶酶活的测定参考 Astrup-T[15]血纤维蛋白平板法.采用Lowry法[16]测定蛋白质浓度,以牛血清白蛋白为标准蛋白.
1.2.2 粗酶液制备方法
培养条件为2%(质量分数,下同)蔗糖和5%豆饼,250mL锥形瓶装液量为50 mL,接种量为直径1cm的菌片1片,23℃、180r/min摇瓶避光培养5d.发酵液在4℃、10000r/min条件下离心10min,取上清液备用.
1.2.3 硫酸铵盐析
将发酵液离心后的上清液硫酸铵饱和度调至20%,置冰箱(4℃)冷藏12h,在4℃、10000r/min 条件下离心20 min,将上清液与沉淀分离,取上清液备用.
1.2.4 Sephadex G-25 凝胶色谱
用 Sephadex G-25(φ2.6 cm ×30 cm)凝胶过滤色谱对上述粗酶液进行脱色和交换缓冲液.上样量为20mL,洗脱液为0.02mol/L磷酸盐缓冲液(PBS,pH=7.4,硫酸铵饱和度为30%),流速为2mL/min,每管收集6 mL,检测纤溶酶酶活和280 nm吸光值D(280),收集活性组分.
1.2.5 苯基 -琼脂糖 Phenyl-Sepharose HP疏水相互作用色谱
用AKTA prime蛋白质纯化系统进行Phenyl-Sepharose HP疏水相互作用色谱分析.柱型为φ2.6 cm×15cm;起始缓冲液为硫酸铵饱和度为30%的0.02mol/L磷酸盐缓冲液(pH=7.4);洗脱液为0.02 mol/L的磷酸盐缓冲液(pH=7.4);流速为2mL/min;上样后先用起始缓冲液衡洗3~4倍柱体积,之后用3倍柱体积起始缓冲液和等体积洗脱液进行线性梯度洗脱,检测D(280),用AKTA prime自带的自动部分收集器定时收集洗脱液(每管6mL),测定纤溶酶酶活,收集活性组分.
1.2.6 CM-Sepharose FF 弱阳离子交换色谱
将收集的活性部分脱盐后,用AKTA prime蛋白质纯化系统进行CM-Sepharose FF弱阳离子交换色谱分析.柱型为 φ2.6 cm×15 cm;起始缓冲液为0.02mol/L PBS 缓冲液(pH=6.0 ~7.0);上样后先用起始缓冲液冲洗未结合蛋白至D(280)接近0,然后按照NaCl浓度递增方向采用120mL(150mL)起始平衡缓冲液和120mL(150mL)含0.5mol/L(0.8mol/L)NaCl的洗脱液进行线性梯度洗脱,流速为3.0mL/min;检测D(280),自动部分收集器定时收集洗脱液(每管6mL),测定纤溶酶酶活,收集活性组分.
1.2.7 Superdex 75 凝胶色谱
将收集的活性组分经冻干浓缩后,用AKTA prime蛋白质纯化系统进行Superdex 75凝胶过滤色谱分析.色谱柱为Superdex 7516/60预装柱;洗脱液为含 0.8 mol/L NaCl的 0.02 mol/L PBS缓冲液(pH为6.0或7.4);洗脱液体积为140 mL;流速为1.0mL/min;检测 D(280),用 AKTA prime 的自动部分收集器定时收集洗脱液(每管1 mL),测定纤溶酶酶活,收集活性组分,检测纤溶酶纯度.
1.2.8 蛹虫草纤溶酶相对分子质量测定
采用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳法(SDS-PAGE)[17](12% 分离胶,5% 浓缩胶,交联度为2.6%,灌注垂直板凝胶)测定蛹虫草纤溶酶的相对分子质量.蛋白质标准物由兔磷酸化酶B(97400)、牛血清白蛋白(66200)、鸡卵白蛋白(42700)、牛碳酸酐酶(31000)、鸡蛋清溶菌酶(14400)组成.
2 结果与讨论
2.1 发酵粗酶液的性质
蛹虫草的液体发酵以豆饼和蔗糖为主要原料.前期实验结果表明,蛹虫草在发酵过程中产生了一定量的多糖物质(3~5 mg/mL).通过发酵液的多种聚丙烯酰胺凝胶电泳分析,发现发酵液中有十几种蛋白质;用疏水层析法对发酵液进行初步分离并对纤溶活性进行分析的结果表明,蛹虫草以豆饼和蔗糖为底物的液体发酵至少产生了两种纤溶酶.此外发酵液含有一定量的色素物质.这些因素给纤溶酶的分离提纯增加了难度.
2.2 多糖的改进硫酸铵盐析法去除
盐析是指溶液的离子强度增大到一定数值时蛋白质溶解度下降、从水溶液中析出的现象.盐析作用的机理是,由于中性盐的加入使水的活度降低,原来溶液中大部分甚至全部的自由水转变为盐离子的水化水,那些与蛋白质表面疏水基团接触并掩盖它们的水分子也被移去使得盐离子被溶剂化,留下暴露出的疏水基团;随着盐浓度的增加,蛋白质疏水表面进一步暴露,由于疏水作用蛋白质聚集而沉淀.盐析沉淀的蛋白质保持着它的天然构象,能再溶解[18].
笔者采用常规的盐析方法对发酵液中的纤溶酶进行初步分离时,即当采用较高饱和度的硫酸铵沉淀纤溶酶时,发现沉淀出的纤溶酶不能用缓冲液复溶,无法进行下一步的分离.进一步的实验分析发现,绝大部分的多糖物质也在盐析过程中发生了沉淀,而且多糖对盐析的作用较蛋白质敏感.针对这种情况,考虑采用先将多糖和酶分离开的策略,即采用降低盐饱和度的方法先去除多糖,再对酶进行分离.当粗酶液的硫酸铵饱和度被降低为20%的时候(置于4℃保持12h),发现大部分的多糖形成了絮状沉淀,而纤溶酶在该盐浓度下呈盐溶状态,没有沉淀析出.这样笔者用离心分离的方法从样品中除去了大部分蛹虫草在深层培养过程中产生的多糖物质.发酵液中的多糖物质呈溶解状态的原因主要是,在静电力的作用下,多糖分子相互排斥,形成稳定的分散系;在盐析过程中盐的加入可能增加了离子与多糖表面电荷的中和,使多糖分子之间的排斥力减弱,分子相互靠拢,与部分蛋白质发生了共沉淀反应.
很多大型真菌在液体深层发酵过程中都会产生多糖物质[19-20],用这种改进的盐析方法从发酵液中分离多糖物质和蛋白质是个可尝试使用的策略.
2.3 粗酶液的脱色
蛹虫草以豆饼和蔗糖为主要原料的液体发酵液中存在一些色素物质.在酶的色谱分离过程中,色素会吸附到各种色谱填料上,不易洗脱,从而污染填料,降低填料的载量、分离度和使用寿命.因此,在酶的色谱分离之前最好先去除多数色素物质.
Sephadex G-25凝胶过滤填料属于惰性载体,其相对分子质量分离范围为100~5000,不带电荷,吸附力弱,容易洗脱,操作条件比较温和,可在相当广的温度范围下使用,并且对分离成分理化性质的保持效果较好.因此,利用其对除去多糖后的粗酶液进行脱色,实验结果见图1.由图1可以看出,纤溶活性组分首先被洗脱下来,色素物质后洗脱出来,可推测蛹虫草的液体发酵产生的纤溶酶的相对分子质量大于5000,大部分色素物质的相对分子质量较小,已和活性蛋白分离开;此外,Sephadex G-25凝胶过滤还除去了较多的杂蛋白,同时又能达到对样品进行交换缓冲体系的目的,去除色素和分离杂蛋白的效果都比较理想.
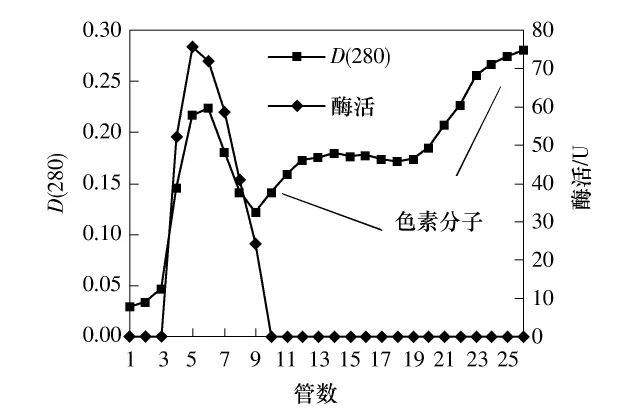
图1 Sephadex G-25凝胶过滤色谱洗脱曲线Fig.1 Elution curves of Sephadex G-25 gel filtration chromatography
2.4 酶的色谱分离
考虑到样品具有体积量较大、有一定的盐浓度、待分离的酶浓度较低等特点,又综合考虑到色谱模式的分离载量、分离度等因素,顺次采用Phenyl-Sepharose HP疏水相互作用色谱、CM-Sepharose FF弱阳离子交换色谱和Superdex 75凝胶色谱对样品中的纤溶酶逐步进行分离.
Phenyl-Sepharose HP填料表面带有低密度苯基疏水基团,其蛋白上样条件为高离子强度状态,适合于盐析后的高盐浓度样品分离,且这种填料对蛋白质的回收率高,蛋白质变性可能性小,流动相中不使用有机溶剂,也有利于蛋白质保持固有的活性.洗脱结果如图2所示.待分离的酶与疏水填料结合较好,上样后的衡洗阶段去除了较多的疏水性弱于目标纤溶酶的杂蛋白;在硫酸铵饱和度从30%到0线性降低的梯度洗脱过程中分离出两个纤溶活性组分,纤溶酶Ⅰ在梯度洗脱的盐饱和度为15%时被洗脱下来,纤溶酶Ⅱ的疏水性强于纤溶酶Ⅰ,与填料结合较牢固,在梯度洗脱接近结束时被洗脱下来;纤溶酶Ⅰ和Ⅱ的活性峰与蛋白峰均对应良好.经此步分离得到的纤溶酶Ⅰ的比酶活达到754.69 U/mg,纯化倍数为28.35,酶活回收率17.38%;纤溶酶Ⅱ的比酶活达到216.31U/mg,纯化倍数为 8.13,酶活回收率为63.58%,分离效果比较理想.
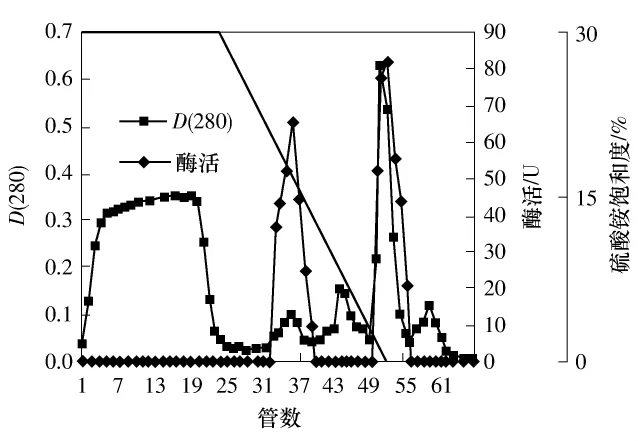
图2 Phenyl-Sepharose HP疏水相互作用色谱洗脱曲线Fig.2 Elution curves of Phenyl-Sepharose HP hydrophobic interaction chromatography
尝试利用蛋白质间等电点不同的特点对纤溶酶继续进行分离.发酵液的等电聚焦活性电泳表明,蛹虫草发酵产生的纤溶酶均为碱性蛋白,因此选择CM-Sepharose FF色谱填料对纤溶酶Ⅰ和Ⅱ继续纯化.CM-Sepharose FF填料具有蛋白载量大、结合能力强、流速快、分辨率较高、物理稳定性好等特点.由于离子交换色谱要求上样条件为低离子强度状态,先用Sephadex G-25凝胶过滤色谱(φ2.6cm×70cm)对纤溶酶Ⅰ和Ⅱ进行脱盐操作,样品冻干浓缩后进行CM-Sepharose FF弱阳离子交换色谱分离.样品和洗脱液的pH值均为6.0,梯度洗脱NaCl浓度范围为0~0.5mol/L.纤溶酶Ⅰ在离子强度为0 ~0.5mol/L的线性梯度洗脱阶段被洗脱下来,说明纤溶酶Ⅰ在pH=6.0的条件下带正电荷,其等电点pI一定大于7.纤溶酶Ⅱ在低离子强度的衡洗阶段先被洗脱下来,未与填料结合,说明纤溶酶Ⅱ在pH=6.0的条件下不带正电荷或带正电荷量较少.纤溶酶Ⅰ和Ⅱ的酶活回收率分别为8.60%和11.43%,比酶活分别为1045.49 U/mg 和 454.83 U/mg,纯化倍数分别为1.38 和 2.10.
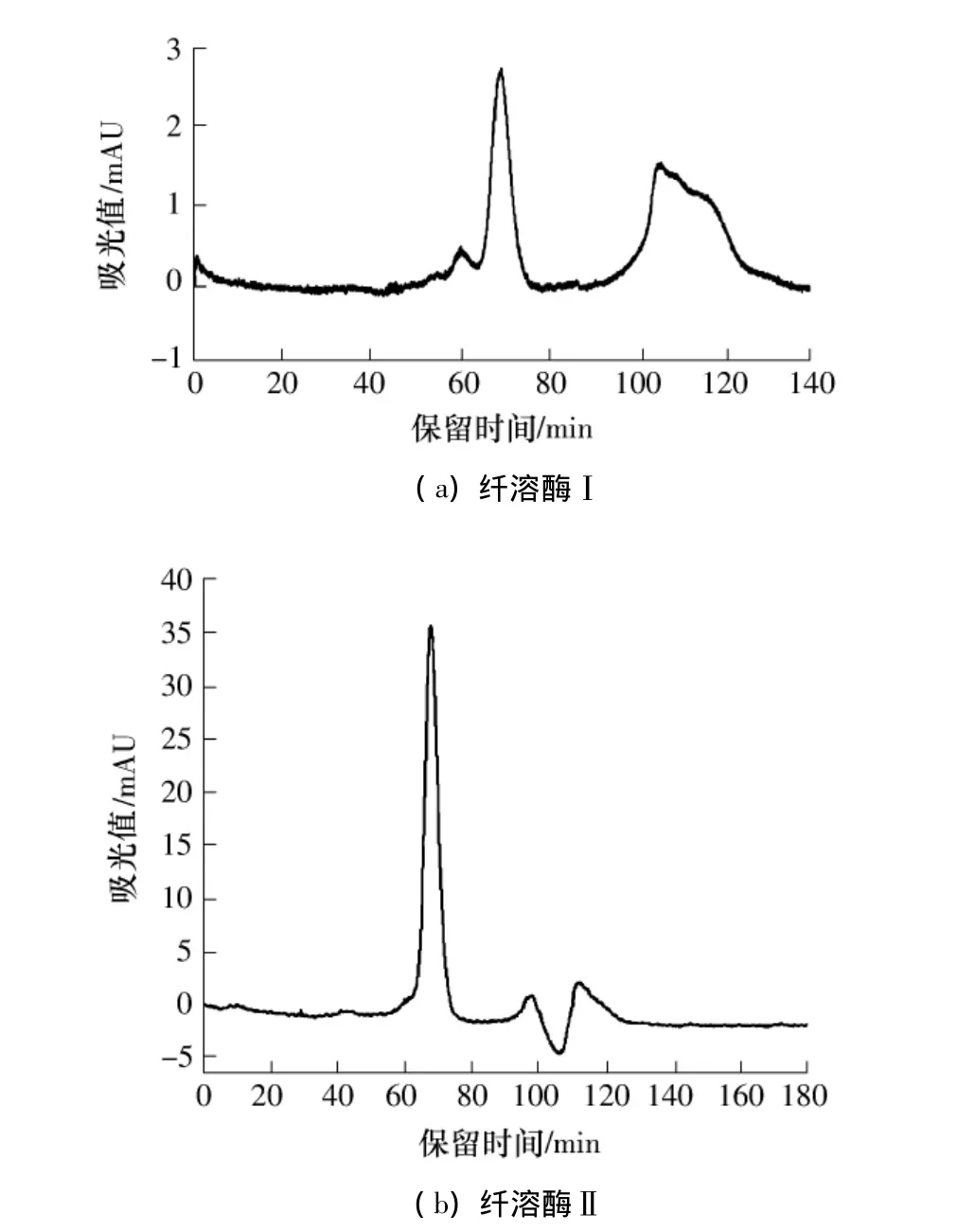
图3 纤溶酶Ⅰ和Ⅱ的Superdex 75凝胶过滤色谱洗脱曲线Fig.3 Elution curves of fibrinolytic enzymeⅠ and Ⅱ by Superdex 75 gel filtration chromatography
用Superdex 75凝胶色谱对纤溶酶Ⅰ和Ⅱ进行精细分离.Superdex 75凝胶填料胶粒直径只有13μm,分辨率高,可分离相对分子量范围为3000~70000.Superdex 75凝胶色谱对纤溶酶Ⅰ和Ⅱ的分离图谱见图3.从图3可看出,Superdex 75凝胶色谱对纤溶酶Ⅰ和Ⅱ的分离效果均比较理想,目标蛋白峰与杂质蛋白峰分开,目标蛋白峰型对称,基线良好,与活性峰完全对应.纯化后的纤溶酶Ⅰ比酶活达到1699.73 U/mg,纯化倍数为 1.62,酶活回收率为0.43%;纤溶酶Ⅱ比酶活达到 800.46 U/mg,纯化倍数为1.76,酶活回收率为 1.02%.
经SDS-PAGE方法检测,纤溶酶Ⅰ和纤溶酶Ⅱ均呈现单一条带,表明样品达到电泳纯.
2.5 酶色谱分离方法的改进
纤溶酶Ⅰ和Ⅱ的酶学性质研究、功能性动物实验以及后续医学实验均需要较多的高纯度样品,因此改善酶的分离效率、提高酶活回收率非常必要.
在上述的纤溶酶Ⅰ和Ⅱ的CM-Sepharose FF弱阳离子交换色谱分离过程中,酶活回收率偏低,酶活损失较多.推测可能是流动相PBS缓冲液的pH与样品的稳定pH相差较多,导致酶活下降较多.尝试改变样品分离条件,期望酶的分离效率和酶活回收率有所改善.
在纤溶酶Ⅰ的分离中,如果提高样品和缓冲液的pH值,则有利于酶空间结构的保持,即有利于酶活的保持,但同时有可能使酶的带正电荷量下降,不利于其与填料的初始结合.如果提高线性洗脱的终点盐浓度,在相同上样量的前提下,可以使活性组分的洗脱体积量减少,酶浓度增加,也有利于酶活的保持.如果将Phenyl-Sepharose HP疏水色谱分离后的样品不进行冻干浓缩操作,脱盐后直接进行CMSepharose FF弱阳离子交换色谱,可能减少样品在冻干浓缩过程中的酶活损失.为此,不改变Phenyl-Sepharose HP疏水色谱分离,提高CM-Sepharose FF弱阳离子交换色谱中PBS缓冲液的pH值至6.5,对纤溶酶Ⅰ进行分离,结果见图4(a).从图4(a)中可以看出,纤溶酶Ⅰ在上样初始条件下仍与填料充分结合,在梯度洗脱中期被洗脱下来,活性峰与蛋白峰对应良好.同时,目标蛋白与其等电点接近的杂蛋白基本分离,使纤溶酶Ⅰ得到了进一步的纯化.纤溶酶Ⅰ比酶活达到1288.45U/mg,酶活回收率为35.53%,较pH值为6.0时提高约3倍.提高PBS缓冲液pH值至6.8和7.0继续优化.
当将缓冲液pH值调节至6.8和7.0时,纤溶酶Ⅰ均不能与填料结合,纤溶酶在这样的pH条件下不带正电荷或正电荷量少,不利于酶的分离.将梯度洗脱NaCl浓度范围调整至0~0.8mol/L,酶活回收率和纯化倍数均有提高,分别为40.35%和32.05%.由此确定酶Ⅰ进行CM-Sepharose FF弱阳离子交换色谱时PBS缓冲液的pH值为6.5,梯度洗脱NaCl浓度范围为0~0.8mol/L.
在纤溶酶Ⅱ的分离中,由于其在pH=6.0条件下只带少量的正电荷,不足以和离子交换色谱填料吸附牢固,如果再降低样品和缓冲液的pH值,势必使其更偏离其最适pH范围,丢失更多酶活的可能性较大.因此,只采取纤溶酶Ⅰ分离的第3个改进措施,即将Phenyl-Sepharose HP疏水色谱分离后的样品不进行冻干浓缩操作,脱盐后直接进行CM-Sepharose FF弱阳离子交换色谱操作,减少样品在冻干浓缩过程中的酶活损失.
图4(b)为改进条件后纤溶酶Ⅱ的离子交换洗脱图谱.由图4(b)可以看出,纤溶酶Ⅱ在衡洗阶段被洗脱下来,但与较多的在该条件下不带电荷或带负电荷的杂蛋白得到了很好的分离,蛋白质浓度峰与活性峰对应良好,同样得到了较好的分离效果.纤溶酶Ⅱ达到比酶活893.76U/mg,酶活回收率为25.48%.
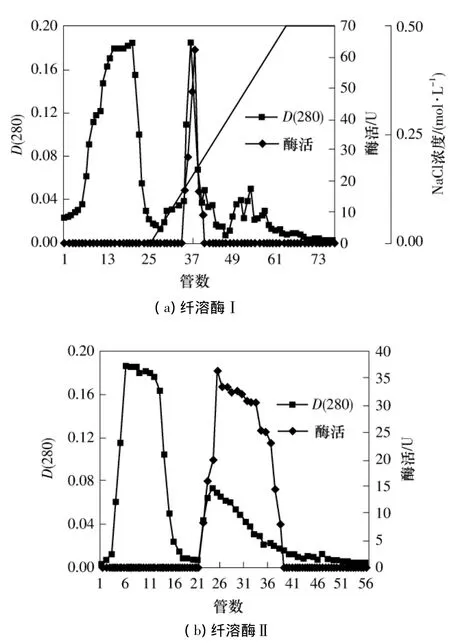
图4 纤溶酶Ⅰ和Ⅱ的CM-Sepharose FF弱阳离子交换色谱洗脱曲线Fig.4 Elution curves of fibrinolytic enzymeⅠandⅡby CMSepharose FF weak-cation exchange chromatography
纤溶酶Ⅰ和Ⅱ经Superdex 75凝胶层析洗脱后,目的蛋白峰与杂质峰分开,对称效果良好,并且与活性峰完全对应,纤溶酶Ⅰ和Ⅱ得到更加精细的纯化,纤溶酶Ⅰ比酶活达到1467.44U/mg,酶活回收率为5.79%,纯化倍数为36.07(见表1).纤溶酶Ⅱ比酶活达到1681.58U/mg,酶活回收率为4.00%,纯化倍数为41.33(见表2).
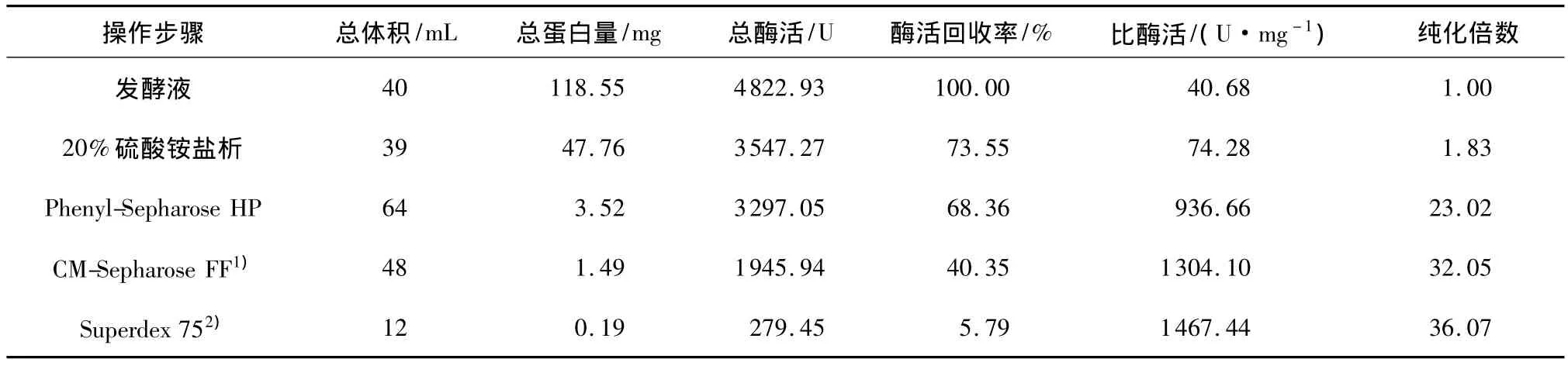
表1 蛹虫草纤溶酶Ⅰ的纯化结果Table 1 Purification results of fibrinolytic enzymeⅠfrom Cordyceps militaris
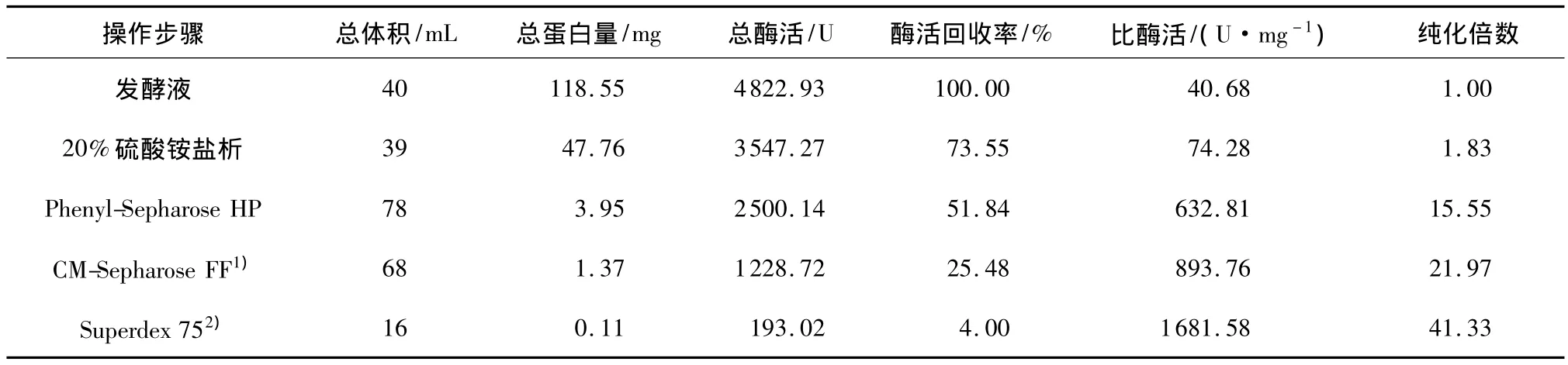
表2 蛹虫草纤溶酶Ⅱ的纯化结果Table 2 Purification resluts of fibrinolytic enzymeⅡfrom Cordyceps militaris
2.6 蛹虫草纤溶酶的纯度检验和相对分子质量确定
要使用一种以上的方法检验蛋白质的纯度.蛹虫草纤溶酶Ⅰ和Ⅱ的最后一步色谱分离采用的凝胶色谱柱为Superdex 75预装柱,该柱内填料的粒度只有13μm,分辨率很高.用该凝胶柱分离纤溶酶Ⅰ和Ⅱ的图谱表明这两个酶均已达到相当高的纯度.纤溶酶Ⅰ和Ⅱ的SDS-PAGE电泳选择的胶浓度为12%,上样浓度为2 mg/mL.如图5所示,提纯后的纤溶酶Ⅰ和Ⅱ均达到电泳纯,利用凝胶成像系统的Labworks软件分析得出两个酶的相对分子质量分别约为28000和32000.Deng等[21]从日本沙蚕中分离出的纤溶酶相对分子质量为28000~32000,Wu等[22]从镰孢菌中提取的纤溶酶相对分子质量为28000,这些酶与本实验中提取的蛹虫草纤溶酶Ⅰ的相对分子质量相近,但Kim等[10]从蛹虫草中提取的纤溶酶相对分子质量达52000.蛹虫草纤溶酶Ⅱ的相对分子质量与枯草芽孢杆菌中提取的纤溶酶(31500)[23]和海洋绿藻中提取的纤溶酶(31000)[24]相近.
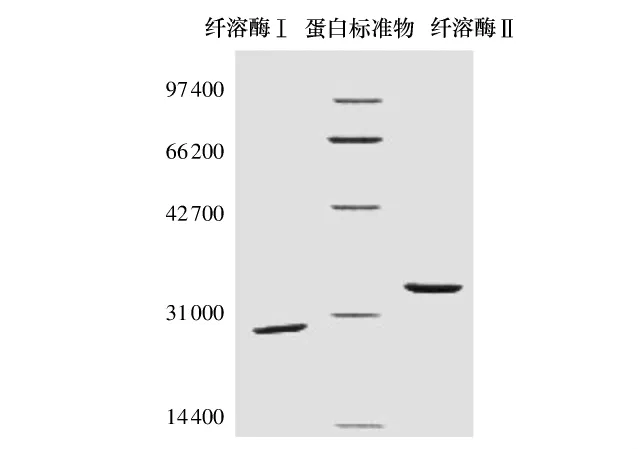
图5 纯化后蛹虫草纤溶酶的SDS-PAGE图谱Fig.5 SDS-PAGE profile of the purified fibrinolytic enzyme from Cordyceps militaris
3 结语
以本课题组已优化的蛹虫草深层发酵生产纤溶酶条件为基础,获得了适合纯化蛹虫草纤溶酶的分离方法.发酵液经过离心除杂后,用改进的硫酸铵盐析除去多糖和部分杂蛋白;得到的样品采用Sephadex G-25凝胶过滤色谱脱色并交换缓冲溶液,经Phenyl-Sepharose HP疏水相互作用色谱分离后得到两种纤溶酶Ⅰ和Ⅱ;然后利用CM-Sepharose FF弱阳离子交换色谱和Superdex 75凝胶过滤色谱进一步分离纯化,最后所得产物均达到电泳纯,蛹虫草纤溶酶Ⅰ和Ⅱ的相对分子质量分别约为28000和32000.提纯后的蛹虫草纤溶酶Ⅰ比酶活为1467.44 U/mg,总纯化倍数为36.07,酶活回收率为5.79%;蛹虫草纤溶酶Ⅱ比酶活达到1681.58U/mg,总纯化倍数为41.33,酶活回收率为 4.00%.
[1] 鲁艳丽,宁喜斌.血栓形成机理及溶血栓药物的研究进展[J].食品研究与开发,2006,27(1):169-172.Lu Yan-li,Ning Xi-bin.The mechanism of thrombus and the advances in research of thrombolitics[J].Food Research and Development,2006,27(1):169-172.
[2] 叶杰,于金兰.溶栓、抗凝在脑梗死中的应用研究进展[J].人民军医,2004,47(12):738-739.Ye Jie,Yu Jin-lan.Research progress of the application of thrombolysis and anticoagulation to cerebral infarction[J].People's Military Surgeon,2004,47(12):738-739.
[3] Alexopoulos C J,Mims C W,Blackwell M.Introductory mycology[M].Beijing:China Agriculture Press,2002:293-294.
[4] 赵荣艳,段毅,郜俊红.蛹虫草的研究和产品开发进展[J].安徽农业科学,2006,34(24):6528-6529.Zhao Rong-yan,Duan Yi,Gao Jun-hong.The research and product development progress of Cordyceps militaris[J].Anhui Agricultural Science,2006,34(24):6528-6529.
[5] 贡成良,潘中华,郑小坚,等.家蚕蛹虫草的延缓衰老作用研究[J].苏州大学学报,2005,25(2):24-27.Gong Cheng-liang,Pan Zhong-hua,Zheng Xiao-jian,et al.Anti-aging effect of silkworm Cordyceps militaris[J].Suzhou University,2005,25(2):24-27.
[6] 秦建春,李晓明,张鞍灵,等.蛹虫草发酵液抗茵活性初步研究[J].西北植物学报,2006,26(2):402-406.Qin Jian-chun,Li Xiao-ming,Zhang An-ling,et al.The antimicrobial activity of fermented liquid from Cordyceps militaris[J].Northwest of Plants,2006,26(2):402-406.
[7] 陈国刚,徐承智,贡成良,等.人工培育家蚕蛹虫草海宁株的药理学研究[J].应用与环境生物学报,2005,11(4):453-458.Chen Guo-gang,Xu Cheng-zhi,Gong Cheng-liang,et al.The pharmacological research of home pupa Cordyceps militaris from Haining[J].Application and Environmental Biological Journals,2005,11(4):453-458.
[8] 刘春泉.北冬虫夏草多糖组分的分离纯化及结构研究进展[J].食品科学,2007,28(1):370-373.Liu Chun-quan.North Cordyceps polysaccharides research progress on separation and structure [J].Food Science,2007,28(1):370-373.
[9] 徐同.蛹虫草人工培育和蛹虫草纤溶酶部分性质的研究[D].上海:华东师范大学生命科学学院,2003:5-6.
[10] Kim J K,Sapkota K,Park S E,et al.A fibrinolytic enzyme from the medicinal mushroom Cordyceps militaris[J].The Journal of Microbiology,2006,44(6):622-631.
[11] 崔莉.蛹虫草纤溶酶的分离纯化、酶学性质及溶栓抗栓作用研究[D].南京:南京农业大学食品科技学院,2008:41-59.
[12] Cui L,Dong M S,Chen X H,et al.A novel fibrinolytic enzyme from Cordyceps militaris,a Chinese traditional medicinal mushroom[J].World Journal of Microbiology Biotechnology,2008,24(4):483-489.
[13] 宿红艳,刘金星,王磊,等.蛹虫草纤溶酶酶学性质的初步研究 [J].食品科学,2009,30(21):221-224.Su Hong-yan,Liu Jin-xing,Wang Lei,et al.Characterization of a novel fibrinolytic enzyme from Cordyceps militaris[J].Food Science,2009,30(21):221-224.
[14] 刘晓兰,郑喜群,邓永平,等.一种真菌纤溶酶及其培制方法:中国,200810137564.4[P].2009-08-12.
[15] Astrup T,Mullertz S.The fibrin plate method for estimating fibrinolytic activity[J].Archive of Biochemistry and Biophysics,1952,40(2):346-351.
[16] Lowry O H,Rosebrough N J,Farr A L,et al.Protein measurement with the Folin phenol reagent[J].Journal of Biological Chemistry,1951,193(1):264-275.
[17] 郭尧君.蛋白质电泳实验技术[M].北京:科学出版社,2005:92-118.
[18] 佰吉顿.蛋白质纯化指南(第二版)[M].北京:科学出版社,2011:331-345.
[19] 李春丽,刘晓兰,陈慧鑫,等.蛹虫草深层培养产菌丝体和胞外多糖的初步研究[J].农产品加工,2010,2(2):22-26.Li Chun-li,Liu Xiao-lan,Chen Hui-xin,et al.Elementary study on the submerged culture conditions for micellium and exopolyasccharides production by Cordyceps militaris[J].Innovational Edition of Farm Products Processing,2010,2(2):22-26.
[20] Lee S H,Hwang H S,Yun J W.Production of polysaccharides by submergedmycelial culture of entomopathogenic fungus Cordyceps takaomontana and their apoptotic effects on human neuroblastoma cells[J].Korean Journal of Chemical Engineering,2009,26(4):1075-1083.
[21] Deng Z H,Wang S H,Li Q,et al.Purification and characterization of a novel fibrinolytic enzyme from the polychaete,Neanthes japonica(Iznka) [J].Bioresource Technology,2010,101(6):1954-1960.
[22] Wu B,Wu L C,Chen D J,et al.Purification and characterization of a novel fibrinolytic protease from Fusarium sp.CPCC 480097[J].Journal of Industrial Microbiology &Biotechnology,2009,36(3):451-459.
[23] Chang C T,Fan M H,Kuo F C,et al.Potent fibrinolytic enzyme from a mutant of Bacillus subtilis IMR-NK1[J].Journal of Agricultural and Food Chemistry,2000,48(8):3210-3216.
[24] Matsubara K,Hori K,Matsuura Y,et al.Purification and characterization of a fibrinolytic enzyme and identification of fibrinogen clotting enzyme in a marine green alga,Codium divaricatum [J].Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology,2000,125(1):137-143.
