根癌农杆菌介导脂肪酶在无孢黑曲霉中的高效表达*
2012-01-24潘力王云艳王斌何攀李俊星
潘力 王云艳 王斌 何攀 李俊星
(华南理工大学生物科学与工程学院,广东广州510006)
黑曲霉(Aspergillus niger)是丝状真菌中的重要类群,具有高效的蛋白表达、分泌和修饰能力,被美国食品及药物管理局(FDA)认定为安全菌株,在食品、医药、饲料、工业酶制剂等领域正受到越来越多的关注[1-4].在基因工程中,外源基因进入黑曲霉细胞后会整合在其染色体上,重组子具有很高的遗传稳定性[5],有利于异源基因的高效表达,因此黑曲霉作为异源蛋白的重组表达系统日益受到重视.黑曲霉作为表达系统的关键技术是遗传转化方法的建立.根癌农杆菌介导的转化(ATMT)具有操作简便、重复性好等优点[6],其效率远高于原生质体转化、电转化等传统方法[7],已成功应用于丝状真菌的遗传转化[8-11].目前,ATMT介导丝状真菌转化局限于基因功能研究[6],钟耀华[12]曾利用 ATMT 转化瑞氏木霉分析其生长代谢突变子.然而,由于遗传筛选标记的限制,利用ATMT介导黑曲霉表达异源蛋白的研究鲜见报道.本研究以在轻工食品行业具有重要应用的米黑根毛霉脂肪酶(RML)为研究对象,在优化遗传筛选标记的基础上,采用根癌农杆菌介导RML表达载体转化无孢黑曲霉,并对转化子表达RML进行初步的发酵条件优化,以期为RML的大规模工业应用奠定基础.
1 材料与方法
1.1 菌种与质粒
无孢黑曲霉SH-1,华南理工大学生物科学与工程学院微生物实验室保藏;根癌农杆菌LBA4404,由广东省农科院惠赠.华南理工大学生物科学与工程学院微生物实验室构建了3种根癌农杆菌工程菌:LBA4404A含pHGW-PT表达载体、潮霉素(HygB)抗性基因、吡啶硫胺素(PT)抗性基因;LBA4404B含pHGW-amdS表达载体、HygB抗性基因、乙酰胺酶基因(amdS);LBA4404C含脂肪酶表达载体pHGWRML、HygB抗性基因、RML基因表达盒(3'端添加His6组氨酸标签)[13].
1.2 培养基
根癌农杆菌LC培养基、黑曲霉诱导培养基(IM培养基)、黑曲霉基础培养基(MM培养基)、乙酰胺培养基参照文献[8]配制.黑曲霉淀粉培养基:牛肉膏3g/L,蛋白胨10 g/L,酵母粉2 g/L,淀粉10 g/L,NaCl 2g/L,琼脂 1.7%,pH=5.5.YPD 培养基:葡萄糖20g/L,酵母提取物10g/L,蛋白胨20g/L.察氏培养基(CD培养基):蔗糖 20 g/L,硝酸钠 3 g/L,KCl 0.5g/L,MgSO40.5 g/L,K2HPO41 g/L、FeSO40.01g/L,琼脂粉 1.5%,pH=5.5.
1.3 试剂与仪器
HygB购自美国Merck公司;PT、乙酰丁香酮、牛血清白蛋白(BSA)、对硝基苯酚辛酸酯(pNPC)购自Sigma-Aldrich公司;三丁酸甘油酯购自百灵威公司;其它试剂为国产分析纯.主要仪器包括德国Eppendorf公司PCR仪,美国Thermo Scientific SORVALL高速冷冻离心机,美国Bio-RAD公司蛋白、核酸电泳仪,美国Pall公司纯水仪,美国GE公司蛋白质纯化系统AKTATM purifier,瑞士TECAN公司Sunrise多功能酶标仪等.
1.4 黑曲霉药物敏感性试验
制备100 μg/mL 潮霉素、0.1 μg/mL 吡啶硫胺素的水溶液.参照文献[8]制备含0.01 mol/L乙酰胺的培养基.各取200μL黑曲霉菌种涂布分别加有100μg/mL HygB、0.1μg/mL PT的 CD 固体培养基.取200μL黑曲霉菌种涂布含有0.01 mol/L乙酰胺的固体培养基.各取200μL黑曲霉菌种涂布不加上述药物的CD培养基平板,作为对照.30℃培养4天后观察黑曲霉在药物作用下的生长情况.
1.5 ATMT法介导的黑曲霉转化体系的建立
参照文献[8]报道的转化方法.将在淀粉培养基平板上活化后的黑曲霉单菌落转移至CD液体培养基中34℃培养5天待用.将含有待转化质粒的根癌农杆菌在LC培养基平板(含20 μg/mL利福平和100μg/mL壮观霉素)上活化,挑取较大的单菌落接种于LC液体培养基(含上述药物),28℃、250r/min培养24 h;取1.5 mL根癌农杆菌培养液离心弃上清,加入5mL IM液体培养基(含5 μL 0.2 mol/L乙酰丁香酮)重悬菌体,28℃、100 r/min避光培养4~5h,待菌体D(600)值为1.0左右时取出待用.将100μL黑曲霉培养物与100 μL根癌农杆菌培养物混合均匀后涂布于含0.2 mmol/L乙酰丁香酮的IM培养基平板上,22.5℃避光培养3天;将培养物转移至含0.2 mol/L头孢噻肟和100 μg/mL潮霉素的MM培养基平板,30℃培养4~6天,待转化子长出后提取基因组DNA进行聚合酶链式反应(PCR)鉴定,所用引物见表1.
1.6 根癌农杆菌介导的脂肪酶RML转化黑曲霉
1.6.1 脂肪酶表达载体pHGW-RML转化黑曲霉
脂肪酶表达载体pHGW-RML转化黑曲霉的方法参见1.5.筛选标记为HygB抗性基因.
1.6.2 RML转化子的PCR鉴定和表观酶活检测
将在筛选平板上出现的转化子,用灭菌牙签转接至含0.5%(体积分数)三丁酸甘油酯的CD培养基平板上,30℃培养3~5天,观察转化子周围有无水解圈出现.提取转化子的基因组DNA作为模板,对筛选标记基因、RML基因进行PCR扩增,以鉴定RML表达载体是否已整合在黑曲霉基因组上,所用引物见表1.

表1 PCR引物序列Table 1 Sequences of PCR primers
1.6.3 RML转化子蛋白的提取及鉴定
将在CD培养基(含0.08%琼脂)中培养5~7天的黑曲霉RML转化子菌液经离心浓缩后获得RML转化子种子培养液(D(600)值>2.0).吸取2mL种子液接种50mL YPD液体培养基,30℃、250r/min振荡培养3天,发酵液用四层擦镜纸过滤除去培养基及菌丝,滤液离心得蛋白粗提液.蛋白粗提液经超滤浓缩并测定浓度后备用.蛋白粗提液的亲和层析纯化参照镍柱产品使用说明及分子克隆方法[14]进行,测定所得RML蛋白样品的浓度,并采用10%分离胶进行变性聚丙烯酰胺凝胶电泳(SDS-PAGE)检测.
1.6.4 RML转化子发酵条件的初步优化及脂肪酶酶活测定
对转化子表达脂肪酶的发酵优化主要针对3个因素:碳源、温度和pH.碳源选用葡萄糖,用量分别为2%、3%、4%和5%;培养温度分别为30、33和36℃;pH 值选择4.5、5.5 和 6.5.其它培养基成分与 YPD培养基相同,样品于250r/min恒温振荡培养5~8天.自第3天开始取样测定脂肪酶活力,以确定合适的发酵培养条件.脂肪酶活力测定方法:将脂肪酶底物pNPC溶于水中,添加0.5%Triton作乳化剂,经匀浆制备浓度为2.5mmol/L的底物溶液.将500 μL底物溶液、20 μL RML 转化子发酵液和 480 μL 50mmol/L Tris-HCl缓冲液混合,配制1 mL酶活反应体系,于45℃预热后反应10 min,加入20 μL 5%三氯乙酸终止反应.取200μL反应液至96孔板,用酶标仪测定D(405)值.脂肪酶活力单位(U)定义为每分钟水解底物pNPC生成1μmol对硝基苯酚所需的酶量.
2 结果与讨论
2.1 黑曲霉筛选标记的确定
在含100μg/mL潮霉素的CD培养基平板上,黑曲霉SH-1的生长受到完全抑制,而在不加HygB的平板上黑曲霉生长旺盛(见图1(a)、1(b)),说明黑曲霉对HygB敏感.同样,0.1μg/mL的PT可以抑制黑曲霉在CD平板上的生长,而在不加PT的平板上黑曲霉生长正常(见图1(a)、1(c)).因此HygB、PT的抗性基因可以作为黑曲霉遗传转化的筛选标记.在以乙酰胺为唯一氮源的培养基平板上,黑曲霉SH-1生长十分缓慢(见图1(a)、1(d)),说明黑曲霉利用乙酰胺作为氮源的能力较弱.来源于构巢曲霉的乙酰胺酶能有效分解乙酰胺提供氮源,而序列分析表明黑曲霉的乙酰胺酶基因(amdS)与构巢曲霉amdS基因只有22.31%的同源性,导致黑曲霉利用乙酰胺的能力十分有限,这为黑曲霉的遗传转化提供了一个很好的筛选标记.

图1 黑曲霉SH-1对潮霉素B、吡啶硫胺素、乙酰胺的生长敏感性Fig.1 Growth sensitivity of A.niger SH-1 tohygromycin B,pyrithiamine and acetamide
2.2 以HygB抗性基因为筛选标记的黑曲霉遗传转化体系的建立
本研究以HygB抗性基因作为筛选标记,利用ATMT法介导表达载体 pHGW-PT、pHGW-amdS转化黑曲霉SH-1.在筛选平板上获得4个具有HygB抗性的pHGW-PT转化子(见图2(a)),其在含PT的平板上生长旺盛,而宿主菌基本没有生长(见图2(b)),经PCR扩增在转化子中获得了HygB、PT抗性基因的 PCR产物(见图3(a)、3(b)).pHGW-amdS转化宿主菌得到3个转化子(见图4(a)),其在乙酰胺培养基平板上生长旺盛而野生型宿主菌则生长较差(见图4(b)),经PCR扩增在转化子中得到了HygB抗性基因和amdS基因的PCR产物(见图5(a)、5(b)).以上结果表明,以HygB抗性基因作为筛选标记可以有效地获得转化子,间接证明了PT抗性基因和amdS基因可以作为遗传筛选标记.由此建立了以HygB为筛选标记的黑曲霉遗传转化体系.
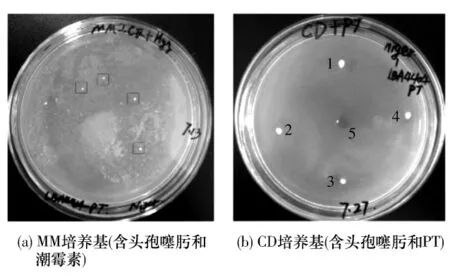
图2 黑曲霉SH-1的pHGW-PT表达载体转化Fig.2 Transformation of A.niger SH-1 with pHGW-PT expression vector

图3 pHGW-PT转化子的PCR鉴定Fig.3 PCR identification of pHGW-PT transformants
2.3 黑曲霉RML转化子的鉴定
用pHGW-RML表达载体转化黑曲霉后,在含头孢噻肟和潮霉素的筛选平板上出现4个转化子(见图6(a)),将其转移至含三丁酸甘油酯的CD培养基平板,培养5天后转化子菌落周围出现底物水解圈,而宿主菌则没有水解圈(见图6(b)),表明RML基因已在黑曲霉中表达.以所得转化子基因组DNA为模板,经PCR获得了HygB抗性基因、RML基因的PCR产物(见图7(a)、7(b)),将扩增得到的RML基因的PCR产物(644 bp)进行测序,测序结果与RML基因原始序列完全一致,表明所得黑曲霉RML转化子是阳性克隆.由于所用宿主为不产孢子的无孢黑曲霉,有利于根癌农杆菌介导的遗传转化的顺利进行;实验结果证明,转化效率较高.
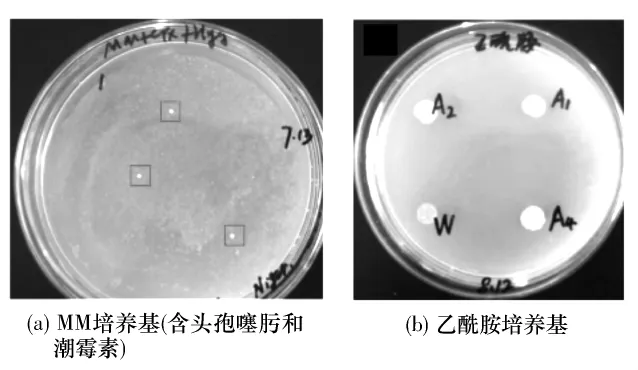
图4 黑曲霉SH-1的pHGW-amdS表达载体转化Fig.4 Transformation of A.niger SH-1 with pHGW-amdS expression vector
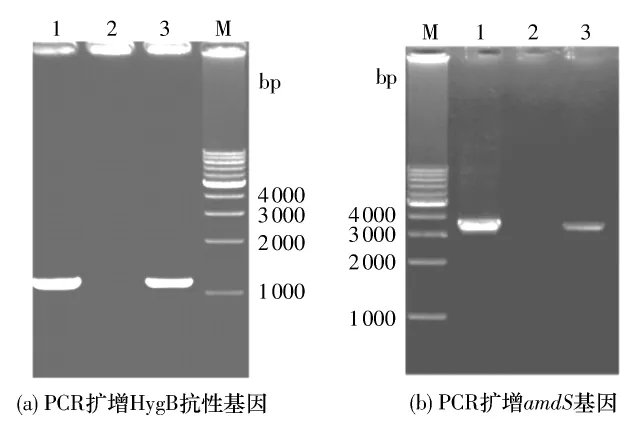
图5 pHGW-amdS转化子的PCR鉴定Fig.5 PCR identification of pHGW-amdS transformants
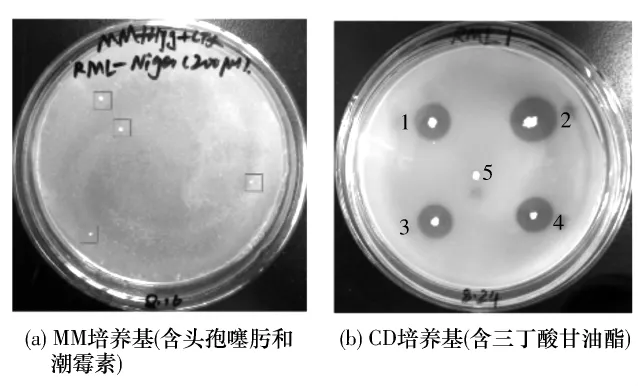
图6 黑曲霉RML转化子的底物水解鉴定Fig.6 Hydrolyzing verification of A.niger transformants bearing RML gene
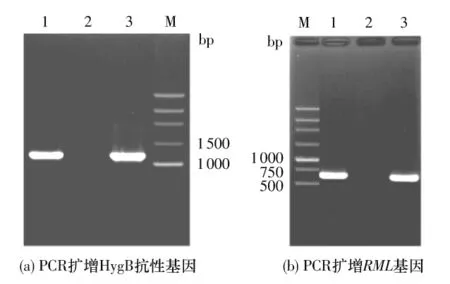
图7 黑曲霉RML转化子的PCR鉴定Fig.7 PCR identification of A.niger RML transformants
2.4 RML蛋白的亲和层析及SDS-PAGE鉴定
将活化的RML转化子在YPD培养基中培养3天后收集发酵液上清,经超滤浓缩后进行亲和层析,洗脱峰非常明显,说明带有His6组氨酸标签的RML蛋白与镍柱可以牢固结合并有效洗脱,纯化效果较好(见图8(a)).将纯化后的RML蛋白样品进行SDS-PAGE电泳,在相对分子质量33000处出现了显著的单一目的蛋白条带,与RML蛋白的大小吻合[15](见图8(b)),因此本研究构建的黑曲霉RML转化子成功表达了重组脂肪酶.
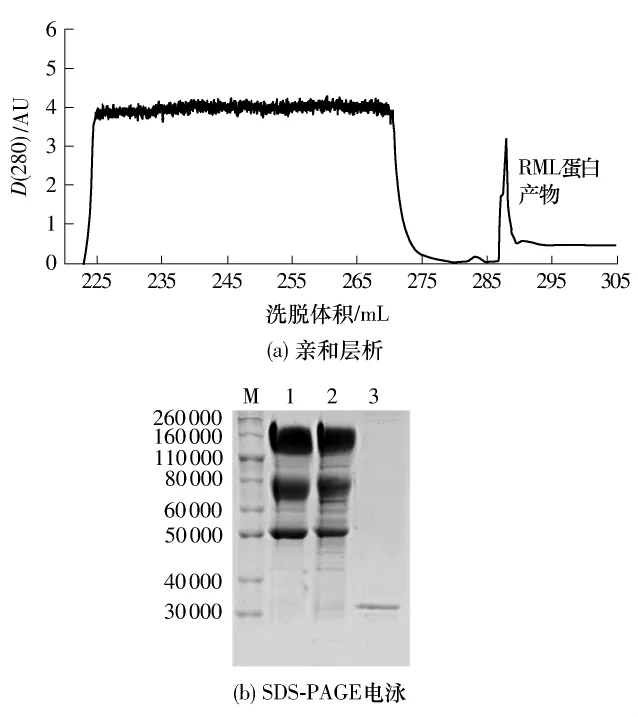
图8 重组脂肪酶的亲和层析纯化及SDS-PAGE电泳鉴定Fig.8 Affinity chromatography of recombinant lipase and its verification by SDS-PAGE
2.5 黑曲霉RML转化子发酵条件优化
丝状真菌的培养温度一般是30℃.本研究选择30、33和36℃ 3个温度梯度进行试验(pH=5.5,葡萄糖用量为2%),培养时间设定为6天,结果表明30℃培养时黑曲霉发酵液脂肪酶酶活最高(3.3 U/mL),因此选择30℃作为最适的培养温度.丝状真菌生长pH 值一般选择5.5,本研究选择 4.5、5.5 和 6.5 进行试验(培养温度为30℃,葡萄糖用量为2%),培养时间设定为6天,结果表明在pH=4.5时,发酵液的脂肪酶酶活最高(6.4 U/mL),因此选择pH=4.5为最佳pH值.
对于碳源(葡萄糖)用量的优化,选择2%、3%、4%和5%4个梯度配制YPD培养基,培养温度和pH按照上述优化后的条件:30℃、pH=4.5.转化子发酵培养至第7天时,葡萄糖用量为5%的发酵液的脂肪酶酶活达到最高(15 U/mL).在培养过程中发现,第4天时葡萄糖用量为2%的发酵液的酶活最高,第5天时葡萄糖用量为3%的发酵液的酶活最高,第6天时葡萄糖用量为4%的发酵液的酶活最高,而在第7天时葡萄糖用量为5%的发酵液的酶活达到最高.推测原因可能是初始葡萄糖浓度过高导致产生“葡萄糖效应”即代谢物阻遏效应,从而影响了基因的表达.因此,在转化子发酵过程中维持培养基中葡萄糖的浓度在一个合适的水平,对于脂肪酶的高效表达十分重要.经优化,用对硝基苯酚比色法测定RML转化子的酶活,其最高可以达到15U/mL,是其在酵母中表达水平(0.3 U/mL[16]、1.4U/mL[17])的10倍以上.江慧芳等[18]研究表明脂肪酶酶活的测定方法不同会导致测定结果在数值上存在差异,本研究采用的对硝基苯酚比色法测定的脂肪酶酶活在数值上仅为橄榄油-碱滴定法的1%左右.徐苏炜等[19]在毕赤酵母中表达RML基因,用橄榄油-碱滴定法测定的脂肪酶酶活为102U/mL;Brocca等[20]重组表达来源于皱褶假丝酵母的脂肪酶lip1,采用碱滴定法测定的酶活为150 U/mL;将其换算为对硝基苯酚比色法测定的酶活则只有1.02 U/mL和1.50U/mL,远小于本研究获得的重组黑曲霉的脂肪酶酶活,表明黑曲霉重组表达系统是非常有潜力的异源蛋白表达系统.
3 结语
将植物基因工程的技术应用于丝状真菌,建立了根癌农杆菌介导的黑曲霉转化体系,对提高工业微生物育种效率作了有益的尝试.利用该黑曲霉转化体系表达脂肪酶RML,经PCR鉴定、酶活检测、镍柱亲和层析及SDS-PAGE电泳检测等成功获得了脂肪酶RML的黑曲霉转化子,通过发酵条件优化实现了RML的高效表达,转化子的RML酶活是其在酵母中表达水平的10倍以上,为RML在油脂、食品、生物柴油、医药和日化等诸多领域的应用奠定了基础,也为异源蛋白在黑曲霉中的高效表达提供了研究线索.在此基础上,本研究将利用所获得的脂肪酶开展油脂转化生产生物柴油等工作,为重组脂肪酶的工业应用进行工艺探索.
[1] Baker S E.Aspergillus niger genomics:past,present and intothe future [J].MedicalMycology,2006,44(Suppl1):S17-S21.
[2] 黄文,杨洪江,秦慧彬.农杆菌介导转化黑曲霉分生孢子及产孢缺陷突变子T-DNA插入位点分析[J].微生物学报,2011,51(2):270-275.Huang Wen,Yang Hong-jiang,Qin Hui-bin.Agrobacterium tumefaciens mediated transformation of Aspergillus niger conidiospores and sequence analysis of T-DNA insertion site in conidiation-defective mutant[J].Acta Microbiologica Sinica,2011,51(2):270-275.
[3] 魏宝阳,高国赋,田云,等.一株黑曲霉(Aspergillus niger)对孟加拉红和水溶性色浆的脱色特性研究[J].环境科学学报,2011,31(3):492-498.Wei Bao-yang,Gao Guo-fu,Tian Yun,et al.Decoloring properties of Aspergillus niger to rose bengal and watersoluble color paste [J].Acta Scientiae Circumstantiae,2011,31(3):492-498.
[4] Rose S H,Zyl WHv.Exploitation of Aspergillus niger for the heterologous production of cellulases and hemicellulases[J].The Open Biotechnology Journal,2008,2:167-175.
[5] O’Donnell D,Wang L,Xu J,et al.Enhanced heterologous protein production in Aspergillus niger through pH control of extracellular protease activity [J].Biochemical Engineering Journal,2001,8(3):187-193.
[6] Michielse C B,Hooykaas P J J,Hondel C A M J J V D,et al.Agrobacterium-mediated transformation as a tool for functional genomics in fungi[J].Current Genetics,2005,48(1):1-17.
[7] Sugui J A,Chang Y C,Kwon-Chung K J.Agrobacterium tumefaciens-mediated transformation of Aspergillus fumigatus:an efficient tool for insertional mutagenesis and targeted gene disruption [J].Applied and Environmental Microbiology,2005,71(4):1798-1802.
[8] Michielse C B,Hooykaas P J J,Hondel C A M J J V D,et al.Agrobacterium-mediated transformation of the lamentous fungus Aspergillus awamori[J].Nature Protocols,2008,3(10):1671-1678.
[9] de Groot M J A,Bundock P,Hooykaas P J J,et al.Agrobacterium tumefaciens-mediated transformation of filamentous fungi[J].Nature Biotechnology,1998,16(9):839-842.
[10] Gouka R J,Gerk C,Hooykaas P J J,et al.Transformation of Aspergillus awamori by Agrobacterium tumefaciensmediated homologous recombination [J].Nature Biotechnology,1999,17(6):598-601.
[11] Meyer V,Mueller D,Strowig T,et al.Comparison of different transformation methods for Aspergillus giganteus[J].Current Genetics,2003,43(5):371-377.
[12] 钟耀华.农杆菌介导的瑞氏木霉T-DNA插入突变及生长代谢突变子分析[D].济南:山东大学生命科学学院,2007:40.
[13] 王斌,潘力,郭勇.丝状真菌米曲霉外源基因表达系统的构建[J].华南理工大学学报:自然科学版,2009,37(6):84-90.Wang Bin,Pan Li,Guo Yong.Construction of heterologous gene expression system for filamentous Aspergillus oryzae[J].Journal of South China University of Technology:Natural Science Edition,2009,37(6):84-90.
[14] Sambrook J,Russell D W.Molecular cloning:a laboratory manual[M].3rd ed.New York:Cold Spring Harbor Laboratory Press,2001:318-319.
[15] Huge-Jensen B,Andreasen F,Christensen T,et al.Rhizomucor miehei triglyceride lipase is processed and secreted from transformed Aspergillus oryzae [J].Lipids,1989,24(9):781-785.
[16] Zhang W-G,Han S-Y,Wei D-Z,et al.Functional display of Rhizomucor miehei lipase on surface of Saccharomyces cerevisiae with higher activity and its practical properties[J].Journal of Chemical Technology and Biotechnology,2008,83(3):329-335.
[17] 江逢春,林影,叶燕锐.利用Sed1p锚定蛋白在毕赤酵母表面展示米黑根毛霉脂肪酶及其应用[J].微生物学通报,2010,37(10):1506-1511.Jiang Feng-chun,Lin Ying,Ye Yan-rui.Surface display of Rhizomucor miehei lipase in Pichia pastoris using Sed1p as an anchor protein and its application [J].Microbiology China,2010,37(10):1506-1511.
[18] 江慧芳,王雅琴,刘春国.三种脂肪酶活力测定方法的比较及改进[J].化学与生物工程,2007,24(8):72-75.Jiang Hui-fang,Wang Ya-qin,Liu Chun-guo.Comparison and improvement of three determination methods for lipase activity[J].Chemistry & Bioengineering,2007,24(8):72-75.
[19] 徐苏炜,林影,韩振林,等.米黑根毛霉脂肪酶基因在毕赤酵母中的高效表达[J].食品与发酵工业,2008,34(11):10-15.Xu Su-wei,Lin Ying,Han Zhen-lin,et al.High level expression of Rhizomucor miehei lipase gene in Pichia pastoris[J].Food and Fermentation Industries,2008,34(11):10-15.
[20] Brocca S,Schmidt-Dannert C,Lotti M,et al.Design,total synthesis,and functional overexpression of the Candida rugosa lip1 gene coding for a major industrial lipase[J].Protein Science,1998,7(6):1415-1422.
