香豆素希夫碱的合成及其金属离子识别性能*
2012-01-24汪凌云叶德成曹德榕
汪凌云 叶德成 曹德榕
(华南理工大学化学与化工学院,广东广州510640)
香豆素类衍生物是一类具有广泛用途的化合物,可用作医药、农药、荧光增白剂(激光染料),也可用于有机光敏染料太阳能电池和荧光传感器等[1-7].其中,兼具香豆素和希夫碱多种特性的香豆素希夫碱化合物引起了人们的研究兴趣,已有香豆素希夫碱化合物用于荧光探针、医药、杀虫剂、染料、光学材料等方面的报道[2,6].但以 3-氨基香豆素为原料的香豆素希夫碱化合物鲜见报道,主要原因是:3-氨基香豆素合成产率较低,限制了对它的研究和应用.3-氨基香豆素具有止痛、镇静、抗菌等功效,在合成的很多抗生素(如新生霉素、氯新生霉素)中存在3-氨基香豆素骨架,因此,3-氨基香豆素及其衍生物是一类很有研究价值和应用价值的化合物.
常见的3-氨基香豆素合成方法有希夫碱法[8]、希夫碱水解法[9]、Lossen 重排法[10]、Boc 保护法[11]等.Meng等[12]采用 Cu(I)催化的“一锅煮”方法可简单、有效地合成氨基香豆素及其衍生物.本研究以2,4-二羟基苯甲醛和 N-乙酰甘氨酸为原料,通过Perkin反应得到3-氨基-7-羟基香豆素,分别与两种芳香醛缩合得到2种新型的香豆素希夫碱化合物,对其结构、光物理性能和金属离子识别性能通过傅里叶红外光谱(FT-IR)、核磁共振谱(NMR)、紫外–可见光谱(UV-Vis)和荧光光谱等方法进行了表征.
1 实验材料和方法
1.1 仪器和试剂
熔点用Yanaco MP-500D型熔点测定仪测定,温度未校正;核磁共振在美国Varian公司的Mercury Plus 300上进行;红外光谱在日本Shimadzu公司的FTIR-8400S型傅里叶变换红外分光光度计上测得,采用溴化钾压片;紫外–可见吸收光谱和荧光光谱分别在日本Shimadzu公司的3150 PC仪和美国Perkin Elemer公司的LS255型荧光分光光度计上测得,均以乙腈为溶剂.所用试剂、溶剂均为市售分析纯.
1.2 化合物1的合成
在100 mL三口烧瓶中加入1.194 g(10 mmol)N-乙酰甘氨酸、1.408 g(10 mmol)2,4-二羟基苯甲醛、50mL新蒸乙酸酐和2.46 g无水醋酸钠,抽真空,通氮气保护,加热至145℃回流10h,稍冷后倒入装有100mL冰水的大烧杯中,有棕黄色沉淀生成,过滤,将固体加到15 mL浓盐酸/乙醇(体积比为2∶1)的混合液中并加热回流2h,再倒入50mL冰水中,用30%NaOH调节pH值至6,过滤收集沉淀,柱层析分析提纯(洗脱剂为乙酸乙酯/石油醚体积比为8∶11的混合物)洗脱,得到化合物1.
1.3 化合物2的合成
在100mL的三口烧瓶中加入1.930g(10mmol)4-N,N-二乙基氨基水杨醛、3.201g(20mmol)丙二酸二乙酯以及30 mL无水乙醇,室温搅拌至完全溶解后,再加入1.0 mL六氢吡啶,加热回流反应6 h.冷却至室温,旋蒸去溶剂,然后加入20 mL浓盐酸和20mL冰醋酸,继续升温回流反应6h.反应液冷至室温后,倒入100 mL冰水中,用40%NaOH溶液调节溶液的pH值到5左右,有大量的土黄色粉末析出.继续搅拌30min,粗产品过滤,水洗,真空干燥,用甲苯重结晶,得到化合物2.
1.4 化合物3的合成
向250mL三口瓶中加入8 mL POCl3,氮气保护下缓慢滴加8 mL新蒸N,N-二甲基甲酰胺(DMF),1h内滴加完毕,反应温度控制在55℃,待反应液变成深红色后加入溶有3.109 g化合物2的1,2-二氯乙烷溶液80 mL,加热回流12 h,最后溶液变成黑红色,自然冷却,用20%NaOH溶液调节pH值为5~6,有固体析出,过滤,柱层析分析提纯(洗脱剂为乙酸乙酯/二氯甲烷/石油醚体积比为1∶8∶6的混合物)洗脱,得化合物3.
1.5 香豆素希夫碱化合物的合成
化合物4a:向50 mL三口烧瓶中加入0.177 g(1mmol)化合物 1、0.247 g(1 mmol)化合物 3 和20mL无水乙醇,氮气保护下回流反应4h,冷却至室温后过滤,粗产品用DMF和水的混合溶剂(体积比为1∶3)重结晶,干燥后得到化合物4a.
化合物4b:向50 mL三口烧瓶中加入0.177 g(1mmol)化合物 1、0.167g(1.2mmol)2,4-二羟基苯甲醛和20mL无水乙醇,在氮气保护下回流反应4h,冷却至室温后抽滤,粗产品用DMF和水的混合溶剂(体积比为1∶3)重结晶,真空干燥后得到化合物4b.
2 结果与讨论
本研究通过N-乙酰甘氨酸与2,4-二羟基苯甲醛在新蒸乙酸酐和无水醋酸钠催化下合成3-N-乙酰基-7-乙酸酯基香豆素中间体,不经分离直接在浓盐酸/乙醇条件下水解得到 3-氨基-7-羟基香豆素(化合物1);以六氢吡啶为催化剂,4-N,N-二乙基氨基水杨醛与丙二酸二乙酯经Perkin反应得到7-N,N-二乙基氨基香豆素(化合物2),化合物2在DMF/POCl3条件下得到3-醛基-7-N,N二乙基氨基香豆素(化合物3).化合物1分别与两种芳香醛基化合物3-醛基-7-N,N二乙基氨基香豆素(化合物3)和2,4-二羟基苯甲醛经缩合反应合成了2个新型的香豆素希夫碱化合物(4a和4b),其合成路线如下:
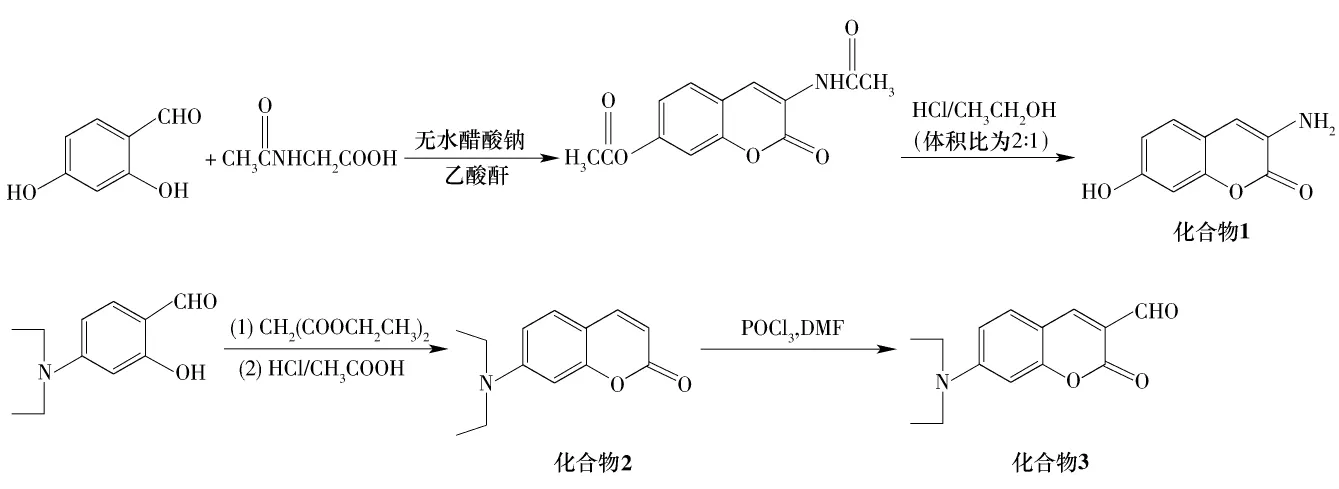
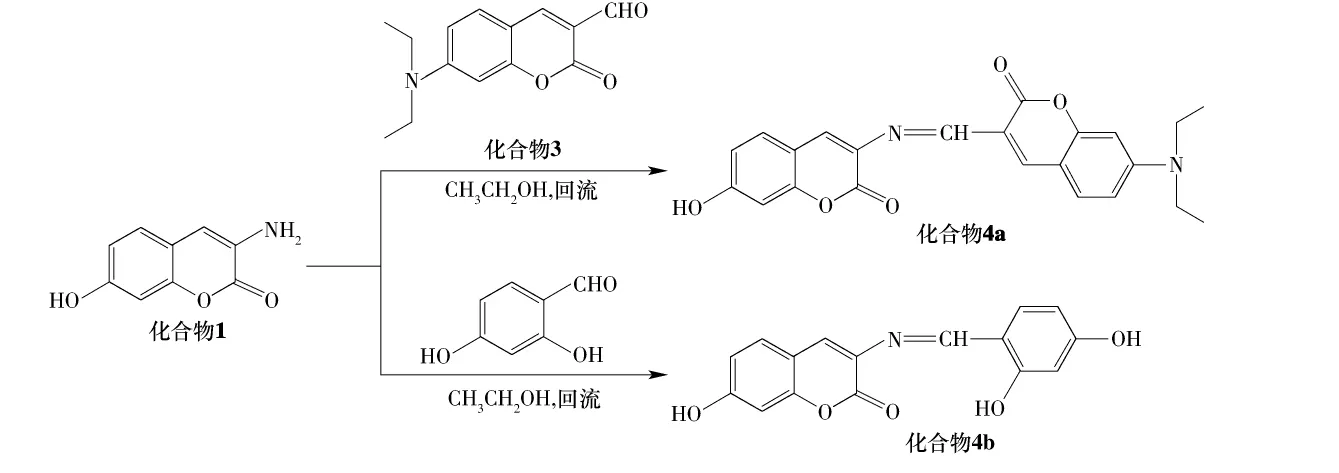
2.1 化合物1的合成与表征
化合物1通过N-乙酰甘氨酸与2,4-二羟基苯甲醛发生Perkin反应和水解反应得到.3-N-乙酰基-7-乙酸酯基香豆素中间体在浓盐酸/乙醇条件下水解得到化合物1过程中,由于化合物1结构中既有氨基又有羟基,pH值过高易形成钠盐,pH值过低易形成铵盐,且二者都易溶于水,不易从水中析出,因此pH值的调控十分关键.本研究用30%NaOH水溶液调节pH值为6,过滤收集沉淀,并通过柱层析的方法提纯得到0.898 g化合物1,产率为51.2%,熔点为240~242℃.核磁共振1H NMR(CD3SOCD3,400MHz,δ):9.83(s,1H,—OH),7.25(d,1H,J=8Hz,Ar—H),6.70 ~6.66(m,3H,Ar—H),5.22(d,2H,J=8Hz,—NH2).
2.2 化合物3的合成与表征
本研究中,4-N,N-二乙基氨基水杨醛与丙二酸二乙酯在六氢吡啶催化下得到1.751 g 7-N,N-二乙基氨基香豆素(化合物2),产率为81.0%,熔点为233~234℃.
由于化合物2结构中内酯环酯基的吸电子效应,使得化合物2与DMF/POCl3的反应活性不高,所以采取了延长反应时间的方法合成3-醛基-7-N,N-二乙基氨基香豆素(化合物3),得到2.554g鲜红的化合物3,产率为71.8%,熔点为165~167℃.化合物3 的1H NMR(CDCl3,400 MHz,δ)结果如下:10.13(s,1H,—CHO),8.25(s,1H,Ar—H),7.42(d,1H,J=8Hz,Ar—H),6.65(d,J=8Hz,1H,Ar—H),6.49(s,1H,Ar—H),3.47(q,4H,J=8Hz,—CH2—),1.26(t,6H,J=8Hz,—CH3).
2.3 香豆素希夫碱化合物4a和4b的合成与表征
化合物1分别与两个芳香醛基化合物(化合物3和2,4-二羟基苯甲醛)经缩合反应得到0.365 g化合物4a和0.212g化合物4b,由于2,4-二羟基苯甲醛羰基邻位羟基空间位阻效应及对位羟基的供电子效应,使得4b的产率比4a低,其产率分别为71.0%和90.0%.4a和4b的结构通过电喷雾电离质谱、红外谱图、核磁谱图进行了确认,数据如下.
化合物4a 电喷雾电离质谱:m/z 405.3(M+H+);FT-IR(KBr,cm-1):3277(O—H),3062(Ar—H),1718(C ═O),1620(C ═N),1506、1456、1420(C ═C);1H NMR(CD3SOCD3,400 MHz,δ):10.54(s,1H,—OH),9.04(s,1H,—N ═CH),8.56(s,1H,Ar—H),7.81(s,1H,Ar—H),7.70(d,1H,J=12Hz,Ar—H),7.58(d,1H,J=8 Hz,Ar—H),6.81(t,2H,J=8 Hz,Ar—H),6.75(s,1H,Ar—H),6.61(s,1H,Ar—H),3.49(q,4H,J=8 Hz,—CH2CH3),1.16(t,6H,J=8Hz,—CH2CH3).
化合物4b 电喷雾电离质谱:m/z 298.1(M+H+);FT-IR(KBr,cm-1):3217(O—H),3062(Ar—H),1707(C ═O),1616(C ═N),1544、1493、1483(C ═C);1H NMR(CD3SOCD3,400 MHz,δ):13.36(s,1H,—OH),10.57(s,1H,—OH),10.36(s,1H,—OH),9.04(s,1H,—N ═CH),7.94(s,1H,Ar—H),7.55(d,1H,J=8Hz,Ar—H),7.42(d,1H,J=8 Hz,Ar—H),6.84(d,1H,J=8 Hz,Ar—H),6.77(s,1H,Ar—H),6.43(s,1H,Ar—H),6.31(s,1H,Ar—H).
化合物4a和4b的光谱性能通过紫外–可见光谱和荧光光谱进行了表征,结果见图1.由图1(a)可见,在乙腈溶液中,化合物4a和4b(均为10.0μmol/L)均在346nm处出现了较弱的吸收峰,为化合物4a和4b中香豆素环的紫外吸收峰,4a在465 nm处出现的强而宽的吸收峰为含7-N,N二乙基氨基香豆素希夫碱部分与香豆素环共同作用所产生的大共轭结构→*跃迁的吸收峰;而化合物4b最大吸收峰在377nm处,比4a蓝移了88 nm,且其最大摩尔消光系数比4a小得多.4a的摩尔消光系数是4b的2.34倍,可能是由于助色团所产生的电子效应程度不同和更短的共轭结构所致.与香豆素的紫外数据(其最大紫外吸收峰在300nm左右)比较可知,在香豆素3位和7位分别引入共轭取代基和羟基有效地增加了分子的共轭程度,使得化合物4b的紫外吸收较香豆素红移近77nm,由于4a具有更长的共轭结构,其紫外最大吸收峰比香豆素红移了近165nm.
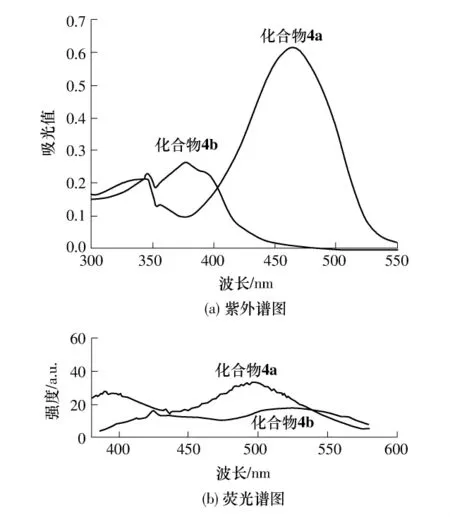
图1 化合物4a和4b的UV-Vis和荧光谱图Fig.1 UV-Vis and fluorescence spectra of compounds 4a and 4b
由图1(b)可知,在乙腈溶液中化合物4a和4b(1.0μmol/L)只有较弱的荧光,这在很大程度上归因于希夫碱C═N结构在光激发下的顺反异构化,产生了分子内的非辐射衰减从而使得荧光发射减弱,化合物4a和4b的最大荧光发射波长分别为492nm和526nm.
2.4 化合物4a和4b对金属离子的识别性能
有不少文献报道香豆素希夫碱化合物可对金属离子、阴离子、中性分子等进行检测[13-16],向化合物4a的乙腈溶液中分别加入常见的金属离子K+、Na+、Mg2+、Ca2+、Ba2+、Cd2+、Cu2+、Fe3+、Hg2+、Ni2+、Sb3+和Zn2+,其紫外光谱的变化如图2所示.

图2 化合物4a的乙腈溶液中加入不同金属离子的UVVis吸收光谱Fig.2 UV-Vis absorption spectra of compound 4a upon addition of various metal ions in acetonitrile solution
由图2可见:当在化合物4a中加入等摩尔量(10.0μmol/L)的上述金属离子后,K+、Na+、Mg2+、Ca2+、Ba2+、Cd2+、Cu2+、Fe3+、Hg2+、Sb3+、Zn2+的加入未引起化合物4a溶液的紫外吸收峰形状变化,只是吸收强度发生微小的变化;而Ni2+的加入使得化合物4a溶液在346nm和465nm处的吸收峰强度降低,同时在486 nm和516 nm处出现2个新的吸收峰,原因可能是:化合物4a通过香豆素环的2个羰基O原子和1个C═N双键的N原子与金属离子发生配位,配位时,2个香豆素环位于C═N双键的同一侧,因此对金属离子的离子半径有一定的要求,如果金属离子半径太大,不易进入到半闭合的2个香豆素环区域进行配位,因此,离子半径小的金属离子有利于配位.实验所用金属离子中,Mg2+、Fe3+、Ni2+的离子半径较小且比较接近,分别为0.066、0.064 和0.069nm;Mg2+的最外层电子数为 8,一般来说,因为碱金属、碱土金属的普通配合物稳定性很差,可能使得Mg2+不易与化合物4a配位,而Fe3+的外围电子为3d5,处于半充满状态,比较稳定,也不易与化合物4a配位,因此只有Ni2+可与化合物4a形成稳定配合物形式,如下所示:通过Ni2+对香豆素内酯羰基和亚胺N原子的络合,增加了荧光团分子的极性,限制了C═N的自由旋转,降低了从基态到激发态电子跃迁的能量,使得紫外吸收光谱的最大吸收波长红移,达到选择性识别Ni2+的目的.同时,化合物4a溶液的颜色也由黄色变成红色.以上结果表明,化合物4a对Ni2+有较好的识别作用,有可能作为一种Ni2+比色探针.
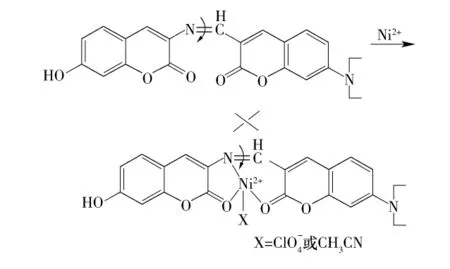
向化合物4b的乙腈溶液中分别加入同样的12种金属离子,其溶液紫外吸收峰形状没有变化,吸收强度均降低,表明化合物4b对上述金属离子没有选择性识别的作用.
3 结论
以3-氨基-7-羟基香豆素(化合物1)为芳香氨基化合物,分别与2个芳香醛基化合物(化合物3和2,4-二羟基苯甲醛)经缩合反应得到了2个新型的香豆素希夫碱化合物 4a和 4b,并通过 FT-IR、1H NMR对化合物结构进行了表征.对化合物4a和4b的分子结构分析发现,在紫外吸收和荧光光谱中,由于化合物4a具有更长的共轭链结构,化合物4a比4b表现出更大程度的最大吸收峰红移,此外,结构在光激发下的顺反异构化使得化合物4a和4b具有较弱的荧光.金属离子检测的初步研究结果表明,化合物4a对Ni2+具有较好的选择性识别作用,有可能作为一种Ni2+比色探针.
[1] Fu Q,Cheng L L,Zhang Y,et.al.Preparation and reversible photo-crosslinking photo-cleavage behavior of 4-methylcoumarin functionalized hyperbranched polyester[J].Polymer,2008,49(23):4981-4988.
[2] Li H Y,Gao S,Xi Z.A colorimetric and“turn-on”fluorescent chemosensor for Zn(II)based on coumarin Shiffbase derivative [J].Inorganic Chemistry Communications,2009,12(4):300-303.
[3] Bryan M W,Joseph G C.Coumarin dyes for dye-sensitized solar cells:a long-range-corrected density functional study[J].Journal of Chemical Physics,2008,129(21):214703-214711.
[4] Ma W H,Xu Q.A Hg2+-selective chemodosimeter based on desulfurization of coumarin thiosemicarbazide in aqueous media[J].Spectrochimica Acta Part A:Molecular and Biomolecular Spectroscopy,2010,76(2):248-252.
[5] Lin W Y,Lin Y,Cao X W,et al.A coumarin-based chromogenic sensor for transition-metal ions showing iondependent bathochromic shift[J].European Journal of Organic Chemistry,2008(29):4981-4987.
[6] 王辉,郑伟华,谢凤妮,等.香豆素席夫碱衍生物的合成及抗肿瘤活性研究[J].有机化学,2011,31(5):708-714.Wang Hui,Zheng Wei-hua,Xie Feng-ni,et al.Synthesis and biological evaluation of coumarin Schiff base derivatives as novel antitumor inhibitors[J].Chinese Journal of Organic Chemistry,2011,31(5):708-714.
[7] 钟瑞敏,张振明,王羽梅,等.杨梅叶芳香精油的成分鉴定及抗氧化活性[J].华南理工大学学报:自然科学版,2006,34(3):49-53.Zhong Rui-min,Zhang Zhen-ming,Wang Yu-mei,et al.Chemical compound identification and antioxidant activity of essential oil from Myrica rubra Var.astropurea Tsen.leaves[J].Journal of South China University of Technology:Natural Science Edition,2006,34(3):49-53.
[8] Khoo L E.Synthesis of substituted 3-aminocoumarins from ethyl N-2-hydroxyarylideneglycinates[J].Synthetic Communications,1999,29(14):2533-2538.
[9] Kokotos C,Tzougraki C.Synthesis and study of substituted coumarins,a facile reparation of D,L-o-tyrosine [J].Journal of Heterocyclic Chemistry,1986,23(1):87-92.
[10] 孙一峰,宋化灿,许晓航,等.3-氨基香豆素及其衍生物的合成[J].中山大学学报:自然科学版,2002,41(6):42-45.Sun Yi-feng ,Song Hua-can,Xu Xiao-hang ,et al.Synthesis of 3-aminocoumarin and its derivatives[J].Acta Scientiarum Naturalium Universitatis Sunyatseni,2002,41(6):42-45.
[11] Kudale A A,Kendall J,Warford C C.Hydrolysis-free synthesis of 3-aminocoumarins[J].Tetrahedron Letters,2007,48(29):5077-5080.
[12] Meng T,Zou Y Q,Khorev O,et al.Simple and efficient copper(Ⅰ)-catalyzed access to three versatile aminocoumarin-based scaffolds using isocyanoacetate [J].Advanced Synthesis& Catalysis,2011,353(6):918-924.
[13] Jung H S,Han J H,Kim Z H,et al.Coumarin-Cu(Ⅱ)ensemble-based cyanide sensing chemodosimeter[J].Organic Letters,2011,13(19):5056-5059.
[14] Zhuang X Q,Liu W M,Wu J S,et al.A novel fluoride ion colorimetric chemosensor based on coumarin[J].Spectrochimica Acta Part A:Molecular and Biomolecular Spectroscopy,2011,79(5):1352-1355.
[15] Yan M H,Li T R,Yang Z Y,et al.A novel coumarin Schiff-base as a Zn(II)ion fluorescent sensor[J].Inorganic Chemistry Communications,2011,14(3):463-465.
[16] Wu J S,Liu W M,Zhuang X Q,et al.Fluorescence turn on of coumarin derivatives by metal cations[J].Organic Letters,2007,9(1):33-36.
