miR-145抑制VSMC增殖的作用及其相关信号通路研究
2012-01-24王泽慧边云飞肖传实
王泽慧,边云飞,肖传实
血管平滑肌细胞(VSMC)的异常增殖是高血压血管重构以及血管增殖性疾病,如动脉粥样硬化、经皮腔冠状动脉介入治疗术(PCI)后再狭窄、血管移植术后新生内膜增生等发生发展的主要病理基础。
microRNA可以调节多种基因的表达。近年来发现miR-145是正常动脉中含量最丰富的miRNA,且主要聚集在VSMC[1]。miR-145在原代培养的VSMC中含量最丰富而在去分化的VSMC中的表达是下调的[2]。本实验室前期已经成功构建了大鼠miR-145重组慢病毒载体并在去分化型VSMC中过表达,但是miR-145是否能抑制去分化型VSMC增殖及其机制仍不清楚。故本实验以体外培养的大鼠原代VSMC为模型,应用PDGF-BB作为外界刺激因子诱导VSMC增殖,同时用构建好的大鼠miR-145重组慢病毒载体浸染目的细胞,CCK-8法检测细胞增殖情况,并在分子水平探讨miR-145是否通过抑制PDGF激活MAPK途径从而抑制VSMC增殖,从而为其抑制VSMC增殖的作用机制提供新的思路及实验依据。
1 材料与方法
1.1 材料 山西医科大学实验动物中心提供健康SD大鼠,体重110g~130g;DMEM细胞培养基、胎牛血清购自Hyclone公司;PDGF-BB购自美国PEPROTECH公司;CCK-8试剂购自碧云天公司;TRIzol、逆转录试剂盒、RT-PCR试剂盒均购自日本TaKaRa公司;引物设计与合成由上海吉玛公司完成;蛋白提取试剂盒购自北京普利莱公司;PVDF膜购自北京索莱宝公司;磷酸化ERK1/2和总ERK1/2抗体购自北京博奥森公司;磷酸化JNK和总JNK抗体、磷酸化p38MAPK和总p38MAPK抗体均购自美国Cell signaling technology公司;羊抗兔二抗购自Santa公司;marker购自富酶泰斯生物技术(深圳)有限公司;Ecl-plus发光试剂盒购自武汉博士德公司;其他试剂均系进口或国产分析纯。
1.2 方法
1.2.1 大鼠原代VSMC培养 采用组织块贴壁法培养VSMC,传代后对VSMC进行抗αSM-actin免疫细胞化学染色鉴定。选择3~8代进行实验。
1.2.2 实验分组 将细胞分为4组。空白对照组:培养的大鼠原代VSMC不做任何处理。PDGF-BB组:大鼠原代VSMC中加 入 终 浓 度 为 10g/mLPDGF-BB。PDGF-BB+ miR-145组:细胞转染miR-1 4 5慢病毒载体7 2h后加入终浓度为1 0 g/mLDGF-BB。miR-NC组:细胞转染阴性慢病毒载体。
1.2.3 CCK-8法测细胞增殖 收集对数期细胞种96孔板,每孔加入100μL细胞,边缘孔用无菌PBS填充,加入各组中的药物及慢病毒,每孔100μL,每组设5个复孔。5%CO2,37℃孵育48h。每孔加入10μLCCK-8溶液继续培养1h~4h。酶标仪在450nm波长处测每孔的光密度值。
1.2.4 细胞RNA提取和RT-PCR反应 使用Trizol试剂盒提取细胞总RNA,逆转录反应得到对应细胞的cDNA模板,采用SYBR Green法进行Real-time PCR检测,反应体系为20 μL,包含上下游引物、DNA 模板、Taq DNA polymerase和ddH2O。定量反应条件:95℃预变性30s,95℃变性5s,60℃退火31s,进行40个循环。各组PCR均重复3次。使用凝胶成像系统分析结果。mRNA的相对表达量用2-△△Ct方法来表示,其中△Ct=Ct目标mRNA-CtGAPDH,△△Ct=△Ct处理-△Ct对照。
1.2.5 Western印迹方法检测 ERK1/2 和 p-ERK1/2等的表达 用Bradford法测蛋白浓度。5%SDS聚丙烯酰胺凝胶电泳分离蛋白质,转移至硝酸纤维膜(PVDF膜),依次加入兔抗鼠ERK1/2和p-ERK1/2抗体(1∶2 00)、兔抗鼠JNK和p-JNK抗体(1∶2 000)、兔抗鼠p38MAPK和p-p38MAPK(1∶2 000)浸泡滤膜,4℃过夜,洗涤后加入碱磷酶标记的羊抗兔IgG(1∶3 000),洗膜后ECL化学发光试剂检测。定量分析采用分子生物学图像分析系统。
1.3 统计学处理 采用SPSS13.0软件,用均数±标准差(±s)表示,采用单因素方差分析,多重比较采用LSD法。
2 结 果
2.1 miR-145对PDGF诱导VSMC增殖的影响 CCK-8结果显示,与空白对照组比较,miR-NC组OD值无统计学意义;PDGF组OD值明显升高(P<0.05),PDGF可促进VSMC增殖。与PDGF-BB组比较,PDGF-BB+miR-145组OD值明显下降(P<0.05),提示miR-145可抑制PDGF诱导的VSMC增殖。详见表1。
表1 miR-145对VSMC增殖影响的CCK-8结果(±s)
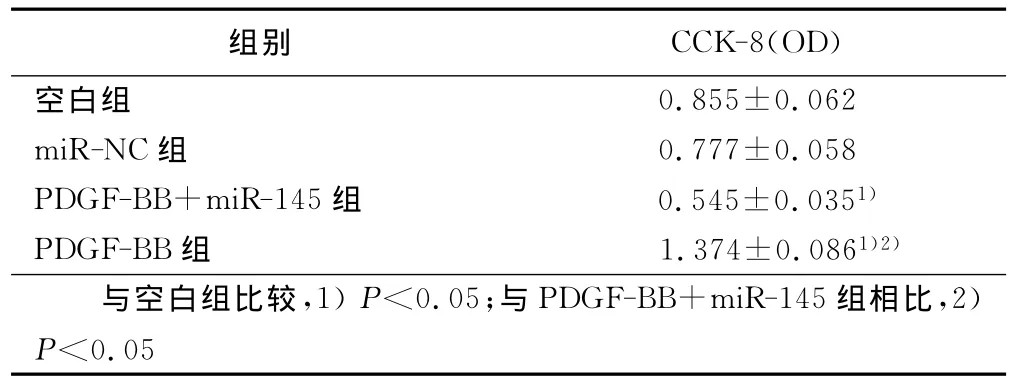
表1 miR-145对VSMC增殖影响的CCK-8结果(±s)
组别 CCK-8(OD)空白组0.855±0.062 miR-NC组 0.777±0.058 PDGF-BB+miR-145组 0.545±0.0351)PDGF-BB组 1.374±0.0861)2)与空白组比较,1)P<0.05;与PDGF-BB+miR-145组相比,2)P<0.05
2.2 miR-145对VSMC相关基因的影响 RT-PCR结果显示:与空白对照组比较,miR-NC组PCNA、c-Jun及SM22amRNA的表达无统计学意义,PDGF组PCNA、c-Jun mRNA的表达分别上调1.37倍和2.68倍(P<0.05),而SM22amRNA的表达下调80%(P<0.05)。提示PDGF可促进 VSMC增殖抑制VSMC分化;与 PDGF-BB组比较,PDGF-BB+miR-145组 PCNA、c-Jun mRNA 的表达分别下调66.4%和77.2%(P<0.05),而SM22amRNA 的表达上调4.4倍(P<0.05)。提示miR-145可抑制PDGF诱导的VSMC增殖而促进VSMC分化。
2.3 miR-145对PDGF诱导的p-ERK/ERK 蛋白表达的影响
Western-blot结果显示:PDGF-BB(10ng/mL)诱导 VSMC后,p-ERK水平明显上调,与对照组相比有统计学意义(P<0.05)。转染 miR-145干预72h后再加入 PDGF-BB刺激,p-ERK水平明显下调,与PDGF组相比差异有统计学意义(P<0.05)。空质粒组与对照组相比无统计学意义。详见图1。
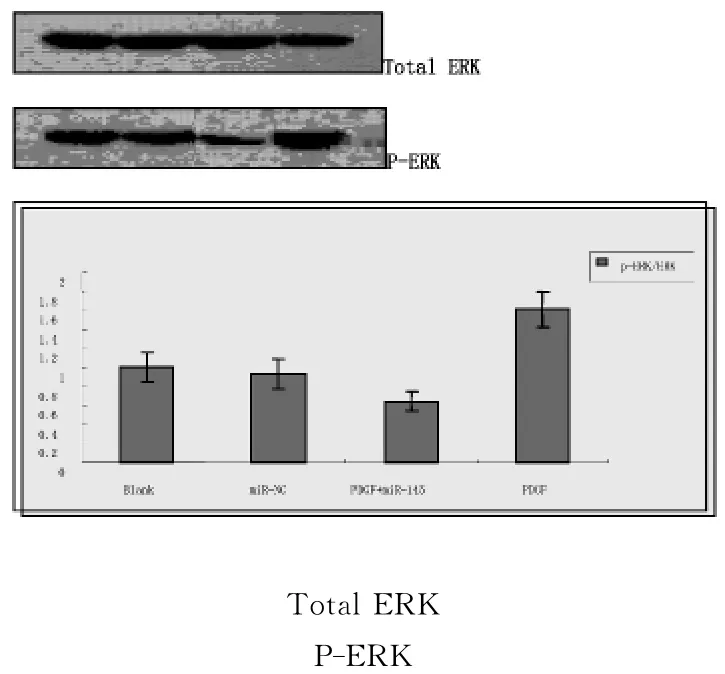
图1 miR-145对PDGF诱导的p-ERK/ERK蛋白表达的影响
2.4 miR-145对PDGF诱导的p-JNK/JNK蛋白表达的影响Western-blot结果显示:PDGF-BB(10ng/mL)诱导 VSMC后,p-JNK水平明显上调,与对照组相比差异有统计学意义(P<0.05)。转染 miR-145干预72h后再加入PDGF-BB刺激,p-JNK 水平明显下调,与PDGF组相比差异有统计学意义(P<0.05)。空质粒组与对照组相比无统计学意义。详见图2。
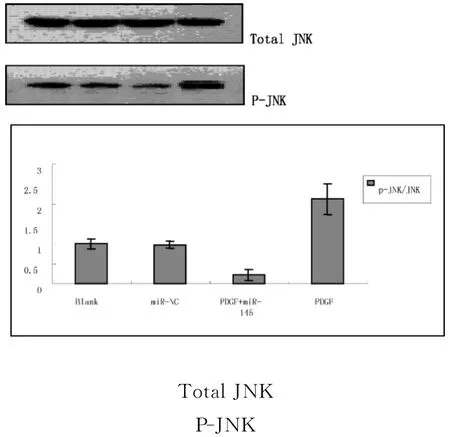
图2 miR-145对PDGF诱导的p-JNK/JNK蛋白表达的影响
2.5 miR-145对 PDGF 诱导的 p-p38MAPK/p38MAPK 蛋白 表 达 的 影 响 Western-blot结 果 显 示 :PDGF-BB(1 0 ng/mL)诱导VSMC后,p-p38MAPK水平明显上调,与对照组相比差异有统计学意义(P<0.05)。转染miR-145干预72h后再加入PDGF-BB刺激,p-p38MAPK水平明显下调,与PDGF组相比差异有统计学意义(P<0.05)。空质粒组与对照组相比无统计学意义。详见图3。
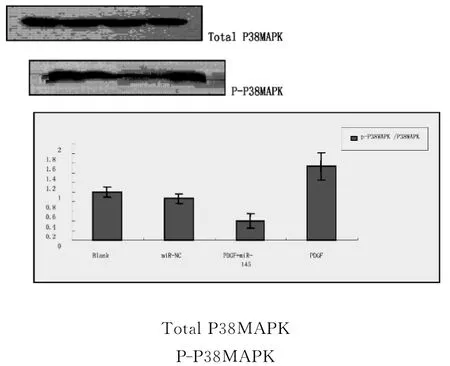
图3 miR-145对PDGF诱导的p-p38MAPK/p38MAPK蛋白表达的影响
3 讨 论
VSMC由分化表型向去分化表型转化是VSMC增殖与迁移的关键性起始步骤,这是许多血管增生性疾病如:动脉粥样硬化、高血压和经皮冠状动脉介入治疗(PCI)术后再狭窄等疾病共同的细胞病理基础之一。microRNA是近些年来研究的热点之一,而miR-145受到关注是由于它在许多癌症中的表达下调,能够抑制癌细胞增殖,是一种新发现的抑癌基因[3,4]。然而,miR-145能否抑制VSMC的增殖仍不清楚。miR-145是VSMC一个重要的表性标记物和表型调节剂,能够抑制新生内膜的形成[1]。但是抑制新生内膜形成的具体机制尚未阐明。因此,进一步研究miR-145抑制VSMC增殖的机制是本次研究的重点。
细胞增殖是一系列基因有序调控的结果,在许多病理情况下,外界环境造成某些生长因子(如PDGF)增多,通过刺激信号转导网络调节某些基因表达增多,使VSMC的增殖失控,引起一系列病理改变[5]。MAPK是刺激脊柱类动物细胞增殖、分化的信号在细胞内传递的交汇点或共同通路[6,7]。PDGF能够吸引血管中层平滑肌向内膜下迁移,使VSMC从收缩型变为合成型,合成型(即去分化型)VSMC有很强的增殖能力及更高的MAPK水平[8]。PDGF通过受体酪氨酸酶途径激活静止期VSMC的 MAPK[9],MAPK 激活转录因子,增加 VSMC的DNA合成,促进细胞增殖[10]。miR-145能否通过抑制去分化型VSMC中的MAPK信号通路,进而抑制VSMC的增殖尚不清楚。本实验测CCK-8比较PDGF组和转染miR-145慢病毒载体再给PDGF组的VSMC增殖情况;RT-PCR说明miR-145抑制增殖的机制与VSMC相关基因的表达有关;同时做western blot说明miR-145抑制PDGF诱导的VSMC增殖的机制与其抑制MAPK通路中的p-ERK/ERK、p-JNK/JNK、p-p38MAPK/p38MAPK蛋白的表达有关。
[1]Cheng Y,Liu X,Yang J,et al.MicroRNA-145,a novel smooth muscle cell phenotypic marker and modulator,controls vascular neointimal lesion formation[J].Circ Res,2009,105(2):158-166.
[2]Zhang Chunxiang.microRNA-145in vascular smooth muscle cell biology a new therapeutic target for vascular disease[J].Cell Cycle,2009,8(21):3469-3473.
[3]Liu X,Sempere LF,Galimberti F,et al.Uncovering growth suppressive microRNAs in lung cancer[J].Clin Cancer Res,2009,15:1177-1183.
[4]Cho WC,Chow AS,Au JS.Restoration of tumour suppressor hsamiR-145inhibits cancer cell growth in lung adenocarcinoma patients with epidermal growth factor receptor mutation[J].Eur J Cancer,2009,45:2197-2206.
[5]秦旭平,廖端芳,李元建.血管平滑肌细胞增殖及其调控[J].中国动脉硬化杂志,2001,9(5):450-454.
[6]王智昊,吴扬,王英凯.血管平滑肌细胞的增殖因素及机制[J].吉林大学学报(医学版),2011,5(37):561-566.
[7]Berk BC,Corson MA.AngiotensinⅡsignal transduction in vascular smooth muscle[J].Circ Res,1997,80:607.
[8]Li X.Vascular smooth muscle cells grown on Matrigel.A model of the contractile phenotype with decreased activation of mitogen-activated protein kinase[J].J Biol Chem,1994,269:19653-19658.
[9]Langan,EM.Regulation of MAP kinase activity by growth stimuli in vascular smooth muscle[J].J Surg Res,57,215-220.
[10]尹小龙,吕俊升.丝裂原激活蛋白激酶与血管平滑肌细胞增殖的信号转导[J].国外医学:生理、病理科学与临床分册,1997,17(2):113-115.
