用噬菌体肽库筛选IBDV单克隆抗体的模拟表位①
2012-01-23李向红陈芳芳黄成斌余为一安徽农业大学安徽省人兽共患病重点实验室合肥230036
李向红 陈芳芳 黄成斌 余为一 (安徽农业大学安徽省人兽共患病重点实验室,合肥230036)
由传染性法氏囊炎病毒(Infectious bursal disease virus,IBDV)引起的IBD是鸡的一种急性、高度接触性传染病。IBDV主要侵害3~12周龄雏鸡或青年鸡的法氏囊,严重感染可导致发病鸡死亡;存活鸡则因全身性免疫抑制,使之免疫能力下降,易感染其他传染病。目前该病呈世界性分布,是危害养禽业的三大疫病之一。
IBDV属双RNA病毒科(Bimaviridae family)的双RNA病毒属(Avanbimavirus)。基因组包括A,B两节段。A片段编码VP2-4-3和VP5组成的多聚蛋白;其中VP2和VP3为主要结构蛋白,VP4为病毒自身蛋白酶,而VP5只能在IBDV感染的细胞中被检测[1]。B片段编码 VP1蛋白,为 RNA依赖的RNA聚合酶。另有研究表明,VP2与病毒毒力和细胞嗜性有关[2]。迄今,在IBDV的抗原表位研究中,至少发现在VP2中存在3个构象依赖性中和抗原表位,2个线性中和抗原表位,在VP3上也发现了2个线性的抗原表位[3-7]。但更多的IBDV的抗原表位序列有待进一步研究。
自Smith[8]第一次成功地将外源基因插入丝状噬菌体f1的基因Ⅲ,创建了噬菌体展示技术以来,该技术已广泛应用于抗原检测和模拟表位的研究领域[9-11]。该法是利用基因克隆技术将多肽编码基因插入线性噬菌体基因组中,使之以融合蛋白的形式表达在噬菌体外壳蛋白上。本研究以实验室制备保存的IBDV及VP2蛋白制备的单克隆抗体[12]作为靶分子,应用噬菌体12肽库进行筛选,获得与单克隆抗体特异性结合的噬菌体,通过序列测定和比对,分析其抗原模拟表位,为进一步研究IBDV的抗原性质和免疫特点奠定基础。
1 材料与方法
1.1主要试剂和耗材 噬菌体随机12肽库购于New England Biolabs公司;辣根过氧化物酶(HRP)标记的鼠抗M13单克隆抗体购自GE Healthcare公司;96孔酶标板购自Coster公司。IBDV,VP2蛋白及3株IBDV单克隆抗体(H53,VP2单克隆抗体V1和V38)由本实验室保存,其它试剂均为国产分析纯。
1.2单克隆抗体的纯化及其鉴定 采用辛酸-饱和硫酸铵法纯化单克隆抗体腹水,通过SDS-PAGE对其纯度进行鉴定。采用间接ELISA方法测定纯化后单克隆抗体的效价。
1.3噬菌体肽库的生物淘洗 将纯化的抗IBDV单克隆抗体(100 μg/ml)包被于96孔酶标板,4℃孵育过夜。参照噬菌体肽库说明书进行第一轮淘洗,将淘洗后洗脱物加入到20 ml ER2738培养物中(菌体处于对数前期)进行扩增,滴度实验测定噬菌体的数量,然后依次按上述步骤进行第2、3、4轮的亲和筛选。加入的噬菌体量均为2×1011pfu,第2、3、4轮用于筛选的包被单克隆抗体浓度分虽为50、30和10 μg/ml,TBST 中 Tween-20 的浓度增至 0.5%,其它步骤与第一轮筛选相同。
1.4间接ELISA检测噬菌体多肽对单抗的结合活性 将5 μg/ml的单抗100μl/孔包被96孔酶联板,4℃过夜。2%牛血清白蛋白(BSA)封阻液,室温振荡1小时。0.1%TBST洗涤6次,拍干。分别加入经四轮淘选后从平板上挑取的30个克隆扩增液100 μl。室温振荡作用1小时,洗涤6次,拍干。加入1∶5 000稀释的辣根过氧化物酶(HRP)标记的鼠抗M13单克隆抗体100 μl,室温振荡结合1小时,TBST洗板六次,拍干,OPD底物缓冲液显色5分钟,加终止液100 μl后测定OD492值。单抗包被加原始肽库作阴性对照,单抗包被加 TBS作空白对照,P/N≥2.1判为阳性。
1.5竞争ELISA鉴定高亲和力噬菌体 将3株单克隆抗体包被96孔酶标板,4℃过夜。以IBDV及VP2蛋白作为竞争抑制物,分别与对应单克隆抗体筛出的阳性噬菌体同时加入并作用60分钟,洗涤,加入1∶5 000稀释的HRP标记的鼠抗M13单克隆抗体孵育30分钟后显色。以单抗包被加TBST作空白对照,在492 nm处测A值。按照公式计算抑制率:抑制率(%)=(1-加竞争物A492nm值/未加竞争物A492nm值)×100%。
1.6DNA序列测定及分析 将竞争ELISA阳性噬菌体克隆进行扩增,取500 μl噬菌体扩增液,提取其DNA送上海生工测序。测序结果运用DNAStar软件进行多肽分析。
2 结果
2.1纯化单克隆抗体腹水的鉴定及其效价测定
首先,采用SDS-PAGE电泳检测经辛酸-饱和硫酸铵法纯化的3株单抗的纯度。如图1所示,这些纯化的样品在电泳中均出现2条带,分别为IgG的轻链与重链(图1)。应用凝胶分析软件对蛋白质条带进行光密度扫描,三株单克隆抗体的纯度分别为99.5%、98.6%和99.1%。通过间接ELISA测定样品效价,均达1.6×10-5。这些表明,经处理的单克隆抗体达到较高的纯度和活性,能够保证亲和筛选过程中与噬菌体的特异性结合。
2.2多轮淘洗获得30株噬菌体 利用纯化抗体从噬菌体肽库中筛选具相应抗原表位噬菌体株。为了筛选高亲和力噬菌体,本研究采用逐步减少抗体包被量、缩短孵育时间和加大其洗脱强度,经过4轮的淘选,回收率逐渐增大。表1结果表明,所淘选的噬菌体得到了选择性的富集。

图1 3株单克隆抗体纯化的SDS-PAGE图谱Fig.1 Three strains of purified McAb in SDS-PAGE
2.3间接ELISA鉴定噬菌体阳性株 对获得的高亲和力噬菌体采用间接ELISA进行鉴定,即从最后一轮淘洗和复制的3个针对不同单抗的噬菌体LB/IPTG/Xgal平板(<100个噬菌斑/培养皿)上,分别随机挑取蓝色噬菌体斑进行扩增以进行特异性结合鉴定。从30个样品中得到22个阳性噬菌体克隆(P/N≥2.1,图2)。
2.4竞争ELISA鉴定阳性噬菌体株与相应抗体的特异性结合 对上述22个阳性株进一步用竞争ELISA缩小其筛选范围。结果,有14个噬菌体株的抑制率达50%以上。其中50% ~60%有8个;61%~70%有6个。IBDV及VP2抗原蛋白能够抑制所筛选的噬菌体与特异性抗体结合的结果表明,这些噬菌体展示的多肽含有IBDV抗原的模拟表位,与相应抗体产生特异性结合。
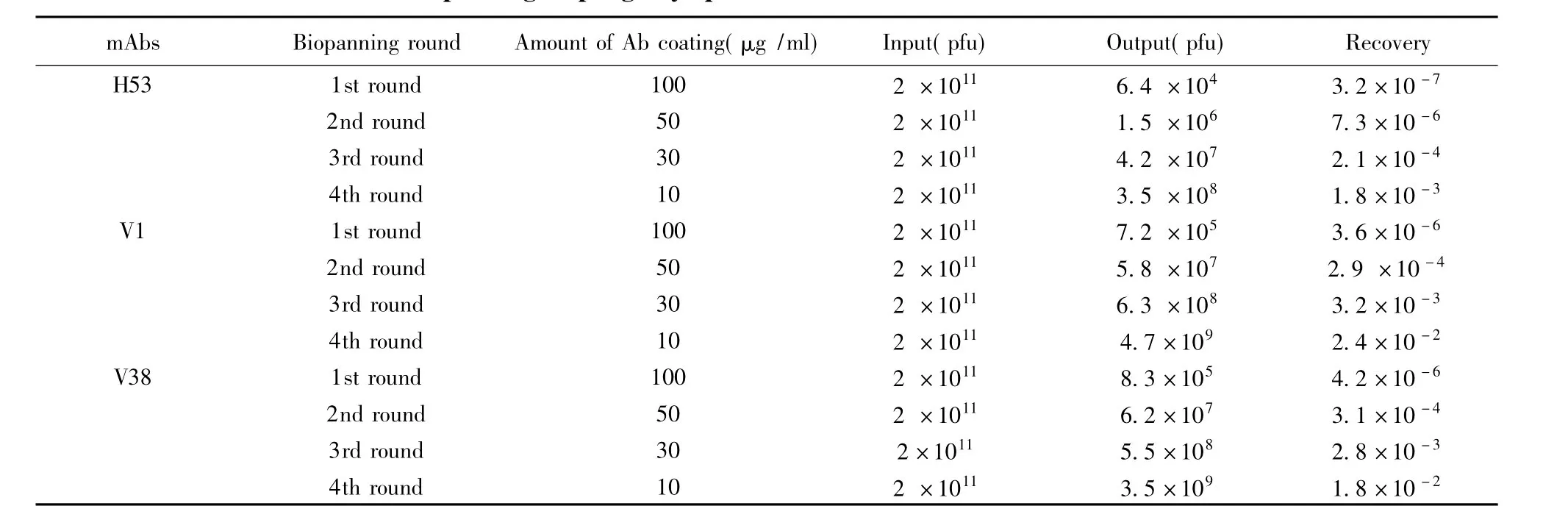
表1 特异性单克隆抗体多轮筛选和富集噬菌体Tab.1 Enrichment and multi-biopanning of phage by specific mAbs

图2 ELISA检测噬菌体克隆与单克隆抗体结合力Fig.2 Determination of the binding of phage clones to McAb by ELISA

表2 与单抗结合阳性的噬菌体克隆的氨基酸序列Tab.2 Amino acid sequences of the positive phage clones binding with McAbs
2.5测序、序列比对和分析 为确定这些竞争抑制阳性的噬菌体展示的多肽序列,将最后筛选的14株噬菌体 (5株H53、4株V1和5株V38)DNA进行测序,并用DNAStar软件分析出其12肽序列(表2)。得出 H53模拟表位的共有序列为 XILRXXXXXXHM,V1模拟表位的共有序列为RXLRLXXPIXQX,V38模拟表位的共有序列为XRXXRXXRRPRP(X为任意氨基酸)。进一步将这些序列分别与GenBank中IBDV多聚蛋白(GenBank登录号:AAC06016.1)和VP2蛋白(GenBank登录号:AAV88108.1)的氨基酸序列进行比对。结果显示,H53单克隆抗体筛选出来的共有序列ILR与多聚蛋白的921~923位氨基酸一致。V1筛选出来的共有序列RLXXPI与VP2蛋白173~178位氨基酸高度同源,但没有连续三个及以上氨基酸残基一致。V38筛选出来的共有序列RPR与VP2蛋白的196~198位氨基酸一致。3个表位序列与IBDV结构蛋白一级结构的氨基酸序列没有连续3个以上的氨基酸残基相同,推测是构象依赖型表位。在14个多肽中R、P、L的含量较高,推测其为构成IBDV表位序列的关键氨基酸。
3 讨论
3.1单克隆抗体纯化方法的选择 靶分子的纯度及活性将直接影响与肽库中噬菌体的特异性结合,是筛选高质量噬菌体的前提。本研究采用辛酸-饱和硫酸铵法纯化单抗,其生物活性及回收率较DEAE-纤维素层析高[13]。本研究所用3株单抗的亚类均为IgG2b,适合用辛酸-饱和硫酸铵法提纯。图1的电泳图表明,纯化的单克隆抗体纯度较高,而且经测定其效价达1.6×10-5。总之,采用该方法提纯的单克隆抗体,可满足噬菌体12肽库筛选对靶分子的要求。
3.2抗原表位分析 本研究将H53及V1,V38单克隆抗体作为靶分子对噬菌体12肽库进行亲和筛选,通过逐轮降低抗体包被浓度,缩短孵育时间及提高洗涤强度来获得高特异性及高亲和力的噬菌体克隆。四轮淘洗后,通过阳性鉴定及竞争抑制实验挑选出能被竞争性抑制的噬菌体克隆,测序分析后获得三个表位序列。H53筛选的模拟表位序列位于多聚蛋白921~923处,推测H53筛选出的抗原模拟表位位于VP3蛋白上。其中短肽序列KILRIPLIINHM重复出现3次且与多聚蛋白的921~952位氨基酸同源性较高,推测构象表位的氨基酸位于921~952区域内。V38筛选出来的表位位于VP2蛋白的196~198位氨基酸处,软件分析可知此区域氨基酸抗原指数较高,RPR可能就是IBDV抗原表位的关键的氨基酸。V1筛选出来的多肽共有序列中RLXXPI序列与VP2蛋白173-178位氨基酸同源性达60%,但没有连续3个及以上的氨基酸残基一致,推测构象型表位中R、L、P、I是构成抗原表位的关键氨基酸。也可能是因为本实验选用的是噬菌体12肽库,多肽段较长,使淘选到的模拟表位在一级结构上与IBDV结构蛋白一致的可能性降低。3个模拟表位序列中碱性氨基酸含量较丰富,即使模拟表位与真实表位的氨基酸序列不完全一致,也可以推测出IBDV的表位序列氨基酸跟碱性氨基酸有关。
3.3应用噬菌体肽库的局限性 与其他研究抗原表位的方法相比,应用噬菌体肽库筛选的优点是可以模拟抗体与抗原表位氨基酸残基之间的相互作用。噬菌体展示技术不仅可以模拟线性结构和一定的空间结构,而且还可以模拟被修饰后的蛋白质抗原表位。但是,该方法也存在局限性。一是肽库的库容量小,目前常用的噬菌体肽库中不同多肽序列的数量一般限制在109,可能缺乏与病毒抗原表位一致的多肽序列。二是有些肽段由于疏水基团等因素影响蛋白的折叠而不能在噬菌体正确表达,使得展示在噬菌体外壳蛋白上的多肽数量受到限制,一些与靶分子亲和力较强的多肽也可能因此而丢失,导致筛选分析后得不到正确的抗原表位序列。
1 Mundt E,Beyer J,Muller H.Identification of a novel viral protein in infectious bursal disease virus infected cells[J].J Gen Virol,1995;76(2):437-443.
2 Brandt M,Yao K,Liu M et al.Molecular determinants of virulence,cell tropism,and pathogenic phenotype of infectious bursal disease virus[J].J Virol,2001;75(24):11974-11982.
3 Yamaguchi T,Lwata K,Kobayashi M et al.Epitope mapping of capsid proteins VP2 and VP3 of infectious bursal disease virus [J].Arch Virol,1996;141(8):1493-1507.
4 Cui X L,Nagesha H S,Holmes I H.Mapping of conformational epitopes on capsid protein VP2 of infectious bursal disease virus by fd-tet phage display[J].J Virol Meth,2003;114(1):109-112.
5 Cui X L,Nagesha H S,Holmes I H.Identification of crucial residues of conformational epitopes on VP2 protein of infectious bursal disease virus by phage display[J].J Virol Meth,2003;109(1):75-83.
6 Wang X N,Zhou J Y,Zhang G P.Identification of neutralizing epitopes on the VP2 protein of infectious bursal disease virus by phage displayed heptapeptide library screening and synthetic peptide mapping[J].Viral Immunol,2005;18(3):549-557.
7 Deng X Y,Gao Y L,Gao H L et al.Antigenic structure analysis of VP3 of infectious bursal disease virus[J].Virus Research,2007;129(1):35-42.
8 Smith G P.Filamentous fusion phage:novel expression vectors that display cloned antigens on the virion surface[J].Science,1985;228(4705):1315-1317.
9 王子晔,冯 娟,马雪梅.利用噬菌体肽库筛选与HIV-1p24抗原结合的多肽[J].中国生物工程杂志,2011;31(5):104-107.
10 Scott J K,Smith G P.Searching for peptide ligands with an epitope library[J].Science,1990;249(1):386-390.
11 王细文,梁 平,韩本立.应用噬菌体随机肽库研究蛋白质抗原表位的进展[J]. 免疫学杂志,2000;16(4):313-314.
12 黄成斌,潘 玲,余为一.两种来源的IBDV抗原制备单克隆抗体的比较[J].安徽农业科学,2010;38(28):15679-15680,
15682.
13 周 玉,李岩松,潘风光et al.小鼠腹水IgG类单克隆抗体纯化方法的研究[J].黑龙江畜牧兽医,2006;10(1):14-16.
