肺炎链球菌溶血素经死亡受体/Fas途径和线粒体途径诱导RAW264.7细胞凋亡①
2012-01-23董姗姗李忱伟何於娟李岱容
董姗姗 王 虹 贺 潇 李忱伟 董 杰 姜 慧 袁 军 何於娟 李岱容
(重庆医科大学检验医学院临床检验诊断学教育部重点实验室,重庆400016)
肺炎链球菌溶血素(Pneumolysin,Ply)是肺炎链球菌的重要毒力因子,是一种氨基酸序列高度保守的52 kD的可溶性蛋白。Ply是胆固醇依赖的溶细胞素家族成员,在靶细胞膜上通过寡聚体化而形成一种大的环形穿膜孔,所形成的寡聚物与毒素的溶细胞活性以及过度的细胞调节活动有关[1]。在肺炎链球菌与宿主细胞的相互作用中,肺炎链球菌所释放的Ply可直接杀伤靶细胞或导致靶细胞凋亡。
固有免疫是生物在长期进化中逐渐形成的,是机体抵御病原体入侵的第一道防线。细胞凋亡是宿主对病原菌产生固有免疫反应的表现之一,已有研究表明,在肺炎链球菌引起的脑膜炎模型中,溶血素可以诱导神经元细胞和小神经胶质细胞的凋亡,从而加重对宿主的损害。树突状细胞、单核-巨噬细胞、中性粒细胞等是主要的固有免疫细胞。目前大多数研究主要针对Ply诱导树突状细胞、耳蜗毛细胞及神经元细胞凋亡及死亡[2-4],而Ply对小鼠单核巨噬细胞增殖和凋亡的研究鲜有报道。本文通过研究Ply对小鼠单核巨噬细胞白血病细胞株RAW264.7细胞体外生长的影响,探讨Ply诱导单核巨噬细胞凋亡的机制,为进一步研究Ply触发宿主瞬时和早期固有免疫应答机制奠定基础。
1 材料与方法
1.1材料 小鼠单核巨噬细胞白血病细胞株RAW264.7购自中国科学院上海细胞生物学研究所;纯化的Ply蛋白由本实验室表达[5];DMEM培养基,胎牛血清均为美国Hyclone公司产品;二甲基亚砜(DMSO)、噻唑蓝(MTT)均为美国Sigma公司产品;Annexin V/FITC试剂盒、Caspase试剂盒购自Biovision公司;Bax、Bcl-2、Fas多克隆抗体、即用型免疫组化SABC试剂盒、盐酸二氨基联苯胺(DAB)显色试剂购自武汉博士德生物工程有限公司;苏木素染液购自上海如吉生物科技发展有限公司。
1.2方法
1.2.1细胞培养 小鼠单核巨噬细胞白血病细胞RAW264.7常规培养于含10%胎牛血清的DMEM培养基(含100 U/ml青霉素、100 U/ml链霉素)中,37℃,相对湿度95%,5%CO2培养箱中培养,每2~3天传代一次,注意观察细胞生长状态,取对数生长期细胞进行实验。
1.2.2细胞形态观察 将对数生长期的RAW264.7细胞用含10%胎牛血清的DMEM培养基配成密度为1×105个/ml的单细胞悬液,取5 ml接种于培养瓶中,待贴壁后,加入1 μg/ml Ply蛋白,培养24小时后,倒置显微镜观察细胞形态变化。
1.2.3MTT增殖实验 取对数生长期RAW264.7细胞配制成密度为1×104个/ml细胞悬液,接种于96孔板,每孔加200 μl,常规培养24小时待细胞贴壁后加入不同浓度Ply蛋白(终浓度为0.1、0.5、1、2.5、5 μg/ml),另设加入等量培养液的对照组,每个实验组做5个重复孔。分别培养24、48、72、96小时后每孔加入MTT溶液(5 mg/ml)20 μl,37℃继续培养4小时,用1 ml注射器吸弃孔内培养上清液。每孔加入150 μl DMSO,振荡使结晶溶解后,用酶标仪测定不同作用时间下细胞的吸光度(A492),实验重复5次,计算Ply对细胞生长的影响。细胞增殖 抑 制 率 (%) =(1-A药物/A对照) ×100%。IC50=e{lg最大剂量-[lg(最大剂量/相邻剂量)][阳性反应率之和-(3-最大阳性反应率-最小阳性反应率)/4]}。
1.2.4Annexin V-FITC/PI双标法检测凋亡细胞百分率 以0.25%胰蛋白酶消化对数生长期细胞,制成单细胞悬液,计数并调整细胞浓度为1×106个/ml,接种于 6 孔板,设阴性对照组,0.5 μg/ml和 1 μg/ml Ply蛋白组,贴壁后加入相应蛋白,置于37℃、5%CO2孵育1小时和3小时后收集各组细胞参照说明书进行操作,Annexin V-FITC和PI双染后流式细胞仪检测。
1.2.5分光光度法对Caspase-3、8、9进行活性检测 收集 1 μg/ml Ply蛋白作用 24小时后的RAW264.7细胞,PBS洗2次,加入50 μl Lysis Butter和0.5 μl DTT,置冰上作用40分钟,离心收集上清液,加入 50 μl 2 × Reaction Butter和 0.5 μl DTT,再分别加入5 μl Caspase-3、8、9底物,37 ℃避光孵育4小时,用酶标仪测定405 nm波长下的吸光度值(A405nm),通过与标准曲线对比,得到各组的Caspase-3、8、9 相对酶活力单位。
1.2.6免疫细胞化学法检测Bax、Fas、Bcl-2蛋白的表达 收集1 μg/ml Ply蛋白作用24小时后的RAW264.7细胞,PBS洗涤3遍;4%多聚甲醛25℃固定细胞爬片30分钟,加入新鲜配制的3%H2O2,室温孵育10分钟,PBS洗3遍,每次2分钟;滴加5%BSA封闭液,室温封闭30分钟,甩去多余液体;滴加1∶200稀释的 Bax、Bcl-2、Fas抗体,同时用 PBS代替一抗做阴性对照,4℃过夜;37℃孵育1小时,滴加生物素标记二抗,37℃孵育30分钟,PBS洗3遍,每次2分钟;滴加试剂SABC,37℃孵育20分钟,PBS洗3遍,每次2分钟;DAB显色,滴加100 μl新鲜配制的DAB显色工作液,室温显色3~10分钟,显微镜下控制反应时间,使用蒸馏水终止显色;苏木素复染,酒精脱水,二甲苯透明,树脂封片;晾干后,显微镜下观察,以胞质和(或)胞膜出现棕黄色颗粒为阳性。Nikon 80i显微镜计算机图像分析软件key-NIS-Elimements BR3.2选取10个高倍视野(×400倍),计算每个视野阳性细胞的光密度值及平均光密度值,并计算比值:比值=处理组平均光密度值/对照组平均光密度值,比值反映蛋白 Bax、Fas、Bcl-2表达水平的高低。
1.3统计学方法 本实验所有数据用±s表示,采用t检验分析,使用SAS8.0统计软件进行分析,P<0.05表示差异有统计学意义。
2 结果
2.1倒置显微镜观察RAW264.7细胞形态改变 用1 μg/ml Ply蛋白处理RAW264.7细胞24小时后,倒置显微镜下观察细胞形态改变,结果显示,对照组细胞紧密排列,与培养瓶壁牢牢粘附,部分细胞伸出触角;Ply蛋白处理组细胞数量显著减少,大多数细胞未贴壁,部分细胞发生皱缩变小变圆,核质浓缩,细胞增殖明显受抑(图1)。
2.2Ply蛋白抑制 RAW264.7细胞生长 0.1、0.5、1、2.5、5 μg/ml Ply 蛋白分别作用于 RAW264.7细胞后,MTT检测Ply对细胞生长的影响。随着作用时间的延长,对细胞的生长抑制作用逐渐增强,具有明显的时效和量效关系(P<0.01),见图2。
2.3流式细胞仪检测RAW264.7细胞凋亡率 流式细胞仪分析结果显示,0.5 μg/ml Ply蛋白处理RAW264.7细胞1小时和3小时的凋亡率分别为25.52%和 40.86%,1 μg/mlPly蛋 白 处 理RAW264.7细胞1小时和3小时的凋亡率分别为32.90%和51.56%,随着Ply蛋白浓度的增加和处理时间的延长,RAW264.7细胞凋亡率逐渐增加,与对照组比较有统计学差异(P<0.05),见图3。
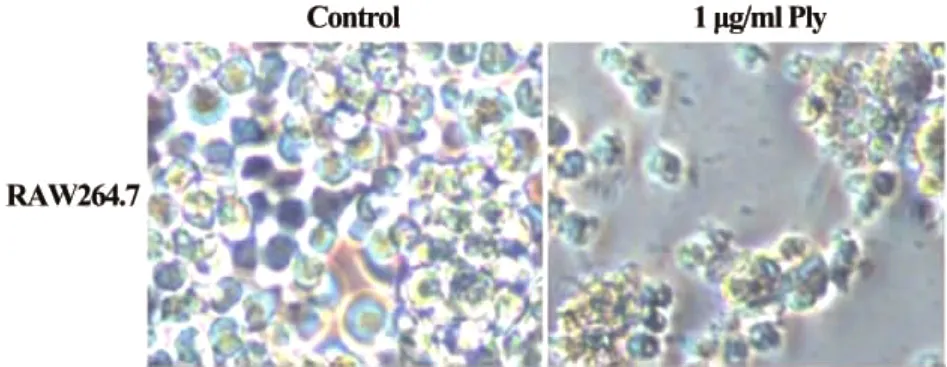
图1 倒置显微镜观察RAW264.7细胞形态改变(×200)Fig.1 Cell morphology changes observed by inverted microscope(×200)
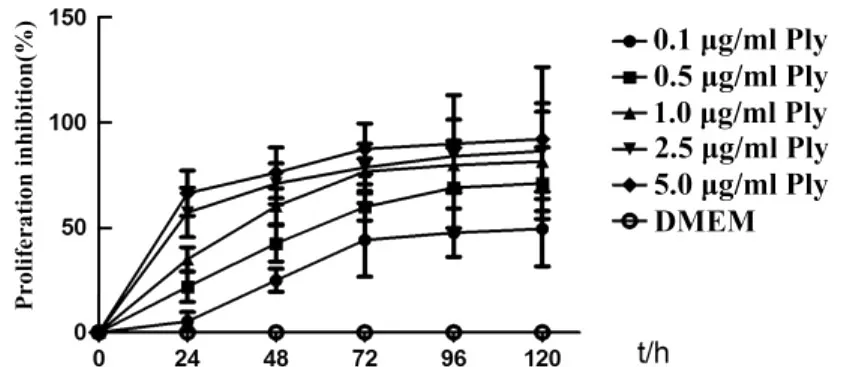
图2 Ply蛋白对RAW264.7细胞增殖的影响Fig.2 Effect of Ply on RAW264.7 proliferation
2.4Caspase-3、8、9 的活性检测 1 μg/ml Ply 蛋白处理RAW264.7细胞24小时,Caspase-3、8、9活性均比对照组升高,差异有统计学意义(P<0.05),见图4。
2.5凋亡相关蛋白 Bax、Fas、Bcl-2的表达 Bax、Fas、Bcl-2蛋白主要定位于细胞浆和细胞膜,阳性染色呈棕黄色颗粒。结果显示,Bax、Fas表达较对照组增强,Bcl-2表达减弱(图5),图像分析软件key-NIS-Elimements BR3.2打分显示变化有统计学意义(P<0.01),见表1。
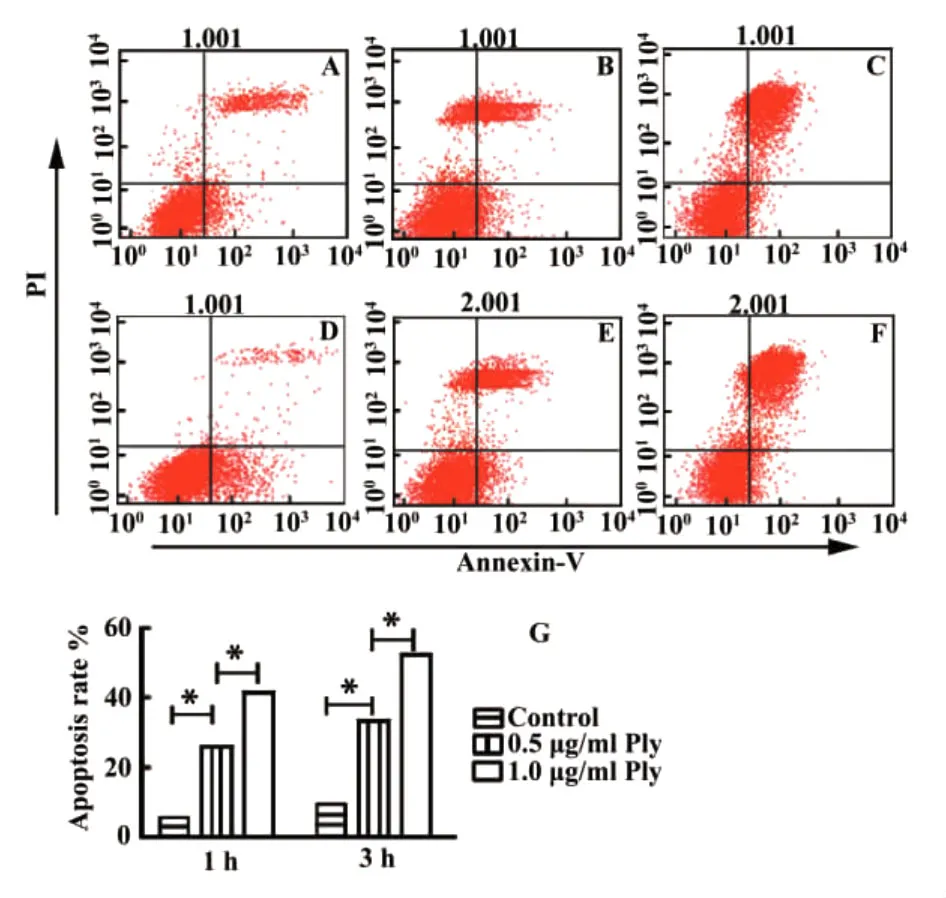
图3 不同浓度Ply蛋白作用1小时和3小时后对RAW264.7细胞凋亡的影响Fig.3 Effects of Ply with different concentrations and different incubation times(1 h and 3 h)on RAW264.7 apoptosis respective

图4 Ply蛋白作用24小时对RAW264.7细胞Caspase活性的影响Fig.4 Effect of Ply on Caspase activity of RAW264.7(24 h)

图5 RAW264.7细胞Bax、Fas、Bcl-2蛋白的表达(×400)Fig.5 Expressions of Bax,Fas and Bcl-2 of RAW264.7(×400)
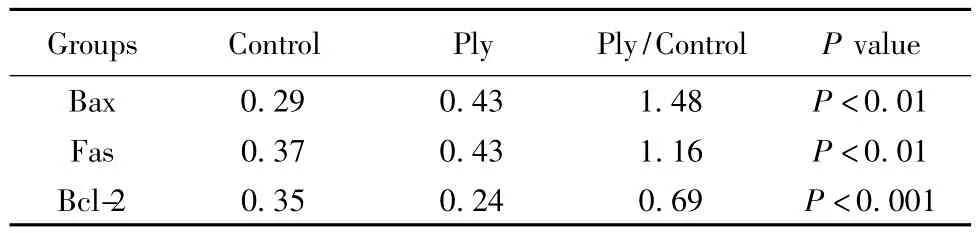
表1 RAW264.7细胞Bax、Fas、Bcl-2蛋白表达的图像分析Tab.1 Image analysis of Bax,Fas and Bcl-2 proteins expression of RAW264.7
3 讨论
溶血素(Pneumolysin,Ply)是肺炎链球菌一个重要的毒力因子,具有溶细胞活性、补体激活和诱导细胞凋亡等多种生物学功能[1-4],但其具体在细菌感染宿主的哪些环节发挥作用,目前尚不十分清楚。
凋亡是细胞的一种程序性死亡,在生理情况下是机体组织清除衰老和受损细胞的一种自杀方式,作用在于调节细胞增殖和死亡处于动态平衡状态。但当机体受到细菌等病原体刺激时,凋亡就成为宿主对病原菌产生先天性免疫反应的表现之一。当病原体对机体的刺激达到一定强度,正常细胞凋亡过度,就会对机体造成损害。已有研究表明,在肺炎链球菌引起的脑膜炎模型中,溶血素可以诱导神经元细胞和小神经胶质细胞的凋亡,从而加重对宿主的损害[4]。而肺泡巨噬细胞在小鼠肺部含量非常丰富,并且在小鼠对肺炎链球菌的天然免疫中起着重要的作用。有研究显示Ply可诱导肺泡巨噬细胞凋亡[6],但其具体分子机制尚不十分清楚。
本研究通过倒置显微镜进行细胞形态观察,显示Ply蛋白处理组细胞呈现出明显的凋亡形态学改变,细胞增殖明显受抑;MTT增殖实验表明不同浓度的Ply蛋白分别作用于RAW264.7细胞后,随着作用时间的延长,对细胞的生长抑制作用逐渐增强,具有明显的时效和量效关系,表明Ply蛋白可以明显抑制RAW264.7细胞的生长;流式细胞仪测定凋亡率也提示随着Ply浓度和处理时间的延长,RAW264.7细胞的凋亡率显著增加;以上结果均证实Ply蛋白在体外可引起RAW264.7细胞的凋亡。
对于哺乳动物来说,细胞凋亡的主要途径有两条:死亡受体/Fas途径和线粒体途径。不管是死亡受体途径还是线粒体途径,都是由Caspase的活化而启动的[7]。
Caspase是一类在凋亡的启动过程中起关键作用的半胱氨酸家族蛋白酶,其中Caspase-8介导死亡受体/Fas途径;Fas蛋白是肿瘤坏死因子受体超家族成员,它主要是与FasL蛋白结合激活Caspase-8,引起细胞凋亡,这一通路即为死亡受体途径[7-9]。Caspase-9介导线粒体途径,Bcl-2家族蛋白主要调控线粒体途径,包括促进凋亡的Bax等蛋白和抑制凋亡的 Bcl-2等蛋白[10-12]。Caspase-3是Caspase-8和Caspase-9共同的下游分子。
RAW264.7细胞的溶血素蛋白处理组与对照组相比,处理组细胞的 Caspase-3、8、9活性均增高,Bax、Fas表达增高,Bcl-2表达降低。Caspase-8与Fas表达增高,提示Ply诱导RAW264.7细胞凋亡有经过Fas途径;Caspase-9与Bax表达增高,Bcl-2表达降低,说明也有线粒体途径的激活。两条途径的激活都使得下游分子Caspase-3表达升高。因此我们认为死亡受体/Fas途径和线粒体途径共同参与了Ply诱导的RAW264.7细胞凋亡。
综上所述,Ply可以诱导RAW264.7细胞的凋亡,诱导凋亡的机制可能是通过死亡受体/Fas途径和线粒体途径双重机制的介导加以实现,具体机制有待进一步研究。
1 Aras K,Jeffrey N W,James C P et al.The role of Streptococcus pneumoniae virulence factors in host respiratory colonization and disease[J].Nature Reviews,2008;6(4):288-301.
2 Jesus C,Clifford M S.Two distinct mechanisms for induction of dendritic cell apoptosis in response to intact streptococcuspneumoniae[J].J Immunol,2003;171:2354-2365.
3 Maryline B,Aziz H,Liam S et al.The mechanism of pneumolysin-induced cochlear hair cell death in the rat[J].J Physiol,2005(Pt 1);211-227.
4 Johann S B,Olaf H,Miriam S et al.Pneumolysin causes neuronal cell death through mitochondrial damage[J].Infection And Immunity,2007;75(9):4245-4254.
5 贺 潇,袁 军,王 虹et al.肺炎链球菌溶血素的体外表达及活性鉴定[J].第三军医大学学报,2011;33(3):237-240
6 Marriott H M,Ali F,Read R C et al.Nitric oxide levels regulate macrophage commitment to apoptosis or necrosis during pneumococcal infection[J].FASEB J,2004;18(10):1126-1128
7 Kruidering M,Evan G I.Caspase-8 in apoptosis:the beginning of"the end"? [J].IUBMB Life,2000;50(2):85-90.
8 Kim K S.Multifunctional role of Fas-associated death domain protein in apoptosis[J].J Biochem Mol Biol,2002;35(1):1-6.
9 Kim K B,Choi Y H,Kim I K et al.Potentiation of Fas-and TRAIL-mediated apoptosis by IFN-gamma in A549 lung epithelial cells:enhancement of caspase-8 expression through IFN response element[J].Cytokine,2002;20(6):283-288.
10 Chung J,Yoon Y O,Lee J S et al.Inulin induces dendritic cells apoptosis through the caspase-dependent pathway and mitochondrial dysfunction[J].Biol Pharm Bull,2011;34(4):495-500.
11 Blood A,Edwards C J,Ishii H H et al.Epstein-Barr virus-mediated protection against etoposide-induced apoptosis in BJA-B B cell lymphoma cells:role of Bcl-2 and caspase proteins[J].Arch Virol,2004;149(2):289-302.
12 Ochs K,Lips J,Profittlich S et al.Deficiency in DNA polymerase beta provokes replication-dependent apoptosis via DNA breakage,Bcl-2 decline and caspase-3/9 activation[J].Cancer Res,2002;62950:1524-1530.
