乌灵菌粉抗大鼠戊四唑诱导癫痫的作用
2012-01-23陈冠锋任光丽张力三胡兴越
陈冠锋,任光丽,张力三,胡兴越
乌灵菌粉抗大鼠戊四唑诱导癫痫的作用
陈冠锋1,任光丽2,张力三1,胡兴越1
(1.浙江大学医学部附属邵逸夫医院神经内科,浙江杭州310016;2.宁波李惠利医院神经内科,浙江宁波312300)
目的:研究乌灵菌粉对大鼠戊四唑的癫痫点燃过程和点燃后学习能力的影响及其可能的机制。方法:将SD大鼠随机分为4组:戊四唑点燃模型组(模型对照组),低剂量乌灵菌粉组(0.3 g·kg-1),高剂量乌灵菌粉组(0.6 g·kg-1)和空白对照组。各组大鼠隔日腹腔注射亚惊厥剂量戊四唑(35 mg·kg-1),空白对照组注射生理盐水,共12次。乌灵菌粉于每次戊四唑注射前30 min灌胃。采用放射状八臂迷宫(四臂放食物)测试大鼠学习能力。化学荧光法测定大鼠脑内组胺含量。结果:(1)与模型对照组相比,低剂量乌灵菌粉组第7次注射戊四唑后发作级别显著降低,第6次注射戊四唑后肌阵挛潜伏期明显延长,第7次注射戊四唑后癫痫泛化潜伏期明显延长(P<0.05);高剂量乌灵菌粉组第6、7和8次注射戊四唑后癫痫发作级别明显降低,第8和9次注射戊四唑后肌阵挛潜伏期显著延长,第6次注射戊四唑后癫痫泛化潜伏期明显延长(P<0.05);(2)与空白对照组相比,模型对照组在放射状八臂迷宫训练3天后工作记忆和参考记忆错误次数均明显增加(P<0.05),乌灵菌粉部分逆转了这种戊四唑点燃癫痫诱发的学习能力受损;(3)模型对照组海马、皮层、丘脑和下丘脑组胺含量较空白对照组明显下降(P<0.05),低剂量乌灵菌粉组海马、高剂量乌灵菌粉组海马、丘脑和下丘脑组胺含量较模型对照组上升(P<0.05)。结论:乌灵菌粉延缓大鼠戊四唑癫痫点燃的形成过程,改善癫痫大鼠的学习能力,增强脑内组胺能神经可能是其作用机制之一。
中药疗法;乌灵菌粉;癫痫;戊四唑;组胺
[JZhejiang Univ(Medical Sci),2012,41(6):647-652.]
癫痫是常见的发作性中枢神经系统疾病之一。据统计,癫痫发病率为5‰~7‰,全球约有9 000万癫痫患者,我国约有650万~910万[1-2]。癫痫反复发作导致神经生理或生化异常,引起包括认知、行为等脑高级功能受损[3],约有30%的癫痫患者有认知功能缺陷,20%~25%的患者有明显缺陷[4]。在儿童中尤学习障碍表现较突出,2012年最新发表于《Pediatrics》杂志报道指出,有癫痫发作的儿童人群并发注意缺陷、行为问题及精神发育迟滞较无癫痫发作的儿童人群高4~20倍[5]。癫痫反复发作给社会和家庭带来了沉重的经济负担及其它一系列负面效应。尽管随着现代医学的快速发展,目前已有数十种抗癫痫药物(Antiepileptic drugs,AEDs)可供选用,仍有超过30%的癫痫患者没能用这些AEDs得到很好的控制,发展为难治性癫痫;另一方面,很多癫痫患者承受了西药带来的巨大副作用,如皮疹、肝肾功能受损、认知功能损害等;癫痫的外科手术使患者承受了巨大的风险、高昂的费用。而中
药作为我国治疗癫痫的重要方法之一,有悠久的历史,早在《黄帝内经》就对该病的病名及病因有明确记载。至今,中医对癫痫发病机制及治疗方法的认识日臻完善,并在疗效方面取得了很大的成就。不管是单味中药还是中药汤剂均具有肯定的效果[6-7],且中药治疗癫痫具有疗效确定、副作用少等优点。乌灵参系炭棒菌科炭棒菌属(Xylaria)真菌,是生长在土栖白蚁巢中的一种真菌的菌核。据四川中药志记载,乌灵参具有利尿、补心神、治失眠、治疗吐血及产后失血等药用价值。最近有研究提示,乌灵菌粉可能具有抗癫痫作用[8],但机制不明。本实验以戊四唑点燃癫痫为慢性癫痫动物模型,结合本课题组先前研究方法,拟观察乌灵菌粉对大鼠慢性癫痫形成过程及慢性癫痫发作后学习能力的影响。
1 材料和方法
1.1 实验材料 清洁级雄性SD大鼠40只,体重220~300 g(浙江大学医学院实验动物中心提供,合格证号22-9601018),分笼分组饲养,自由进水,每天给12 h的光照(光照时间:8:00~20:00),行为学观察在10:00~17:00进行;戊四唑(Sigma公司),乌灵菌粉(由浙江佐力药业股份公司提供)。
1.2 动物分组 将SD大鼠随机分成4组。低剂量乌灵菌粉组(n=10):每次注射戊四唑前30 min大鼠行乌灵菌粉灌胃,剂量0.3 g·kg-1。高剂量乌灵菌粉组(n=10):每次注射戊四唑前30 min大鼠行乌灵菌粉灌胃,剂量0.6 g·kg-1。模型对照组(n=10):每次注射戊四唑前30 min大鼠行生理盐水灌胃,生理盐水体积与前面两组相同。空白对照组(n=10):将模型对照组中的戊四唑换成生理盐水,其余与模型对照组相同。
1.3 慢性癫痫模型的建立[9-10]大鼠腹腔注射亚惊厥剂量的戊四唑(35 mg·kg-1),每48 h注射1次,共12次。每次注射后,大鼠单独放于透明玻璃笼子内,并观察其行为变化30 min。癫痫发作级别按Racine标准[11],分6级:0=无反应;1=耳朵和面部抽动,包括眨眼、动须、节奏性咀嚼;2=肌阵挛,但无直立;3=肌阵挛,且两前肢抬起;4=侧身倒地;5=背部倒地,全身强直-阵挛发作或死亡。记录从戊四唑注射到发生肌阵挛及癫痫泛化的潜伏时间,并作为乌灵菌粉影响癫痫点燃形成过程的分析指标,分别称肌阵挛潜伏期(latency to the onset of myoclonic jerks,LTMJ)和癫痫泛化潜伏期(latency to the onset of generalized seizures,LTGS),如果超过30 min不发生上述发作,则记录为1 800 s。
1.4 学习能力测定 采用放射状八臂(四臂放食物)迷宫测定学习能力。迷宫中央区直径30 cm,向四周以等角度和等长度延伸八条臂(50 cm×12 cm),整个迷宫高出地面40 cm。取4级以上发作为成功点燃模型。模型制作成功24 h后,大鼠先在迷宫中适应2 d,每天1次。适应时3至4只大鼠同时置于迷宫中,自由活动和摄取食物10 min。适应后进行每天3次的测定。每次测定中,八臂中只有四臂放置了食物(分别为3、5、6和8号臂),整个实验过程均维持此顺序。大鼠放在迷宫中央区,此时中央区四周用门关住15 s后将门打开,大鼠可选择进入任意一臂,以摄取食物。大鼠进入有食物的臂且摄取了食物为一次正确选择,否则为错误选择。记录参数为错误选择的次数。重新进入放食物臂称为工作记忆错误(working memory error,WME),进入不放食物臂称为参考记忆错误(reference memory error,RME)。
1.5 组胺含量的测定[10]大鼠完成学习能力测定后断头取脑,并立即移至冰上,分离皮质、海马、下丘脑和丘脑四个部分,置于-80℃冰箱中备用。组胺含量测定采用化学荧光法:在被测脑组织中加入适当体积的0.4 mol·L-1高氯酸匀浆,离心。提取1 ml上清液至7 ml离心管内,该离心管内事先放有0.125 ml的5 mol·L-1氢氧化钠,0.375 g 氯化钠及 2.5 ml正丁醇。振荡离心后将上层正丁醇移至另一7 ml离心管内,加入 0.1 mol·L-1氢氧化钠 1.25 ml,再振荡离心。2 ml正丁醇移至7 ml的离心管内,该离心管内事先放有0.1 mol·L-1盐酸0.625 ml及正庚烷3.75 ml,振荡离心。取水层0.5 ml,加入 1 mol·L-1氢氧化钠 0.1 ml和0.2%邻苯二醛(OPT,荧光剂)0.025 ml,4 min后加入3 mol·L-1盐酸 0.05 ml中止反应,激发波长340 nm,发射波长450 nm处测定其荧光强度。
1.6 统计学处理 采用SPSS 13.0统计学软件进行数据的分析处理。数据均以平均值±标准误(¯x±σ)表示。组间比较用单因素方差分析(one-way analysis of variance,ANOVA)法,两两比较采用Bonferroni法。P<0.05认为有显著性差异。
2 结果
2.1 乌灵菌粉对大鼠戊四唑癫痫点燃过程的影响 如表1所示,乌灵菌粉延缓了大鼠戊四唑点燃癫痫的形成过程。首先发作级别组间比较,低剂量乌灵菌粉组在第7次戊四唑注射后癫痫发作级别较模型对照组显著下降(P<0.05),高剂量乌灵菌粉组在第6~8次戊四唑注射后癫痫发作级别较模型对照组显著下降(P<0.05);第二,LTMJ组间比较,低剂量乌灵菌粉组在第6次、高剂量乌灵菌粉组在第8~9次较模型对照组延长(P<0.05);第三,LTGS组间比较,低剂量乌灵菌粉组在第7次、高剂量乌灵菌粉组在第6次较模型对照组延长(P<0.05)。但两种剂量均不能最终阻止点燃的发生。

表1 乌灵菌粉对大鼠戊四唑点燃癫痫形成过程的影响(¯x±σ)Table1 Effects of Wuling mycelia on the seizure development of pentylenetetrazole-kindling epilepsy in rats
2.2 乌灵菌粉对戊四唑点燃癫痫诱发的大鼠学习障碍的作用 如表2所示,戊四唑点燃癫痫明显损害了大鼠的学习能力,模型对照组WME在第3~8天测试中、RME在第4~8天测试中高于空白对照组(P<0.05)。乌灵菌粉使戊四唑点燃癫痫大鼠的学习能力改善,低剂量乌灵菌粉组WME在第7天测试中低于模型对照组(P<0.05),高剂量乌灵菌粉组WME在第7~8天测试中、RME在第6~8天测试中的低于模型对照组(P<0.05)。

表2 乌灵菌粉对戊四唑点燃癫痫诱发的大鼠学习障碍的作用(¯x±σ)Table2 Effects of Wuling mycelia on learning impairment in pentylenetetrazole-kindled rats
2.3 乌灵菌粉对戊四唑点燃癫痫大鼠脑内组胺含量的影响 如表3所示,戊四唑点燃癫痫大鼠脑内组胺含量下降,模型对照组在四个脑区(海马、皮层、下丘脑、丘脑)的组胺含量均较空白对照组下降(P<0.05)。乌灵菌粉使戊四唑点燃癫痫大鼠的脑内组胺含量上升,低剂量乌灵菌粉组在海马区,高剂量乌灵菌粉组在海马、下丘脑、丘脑区的组胺含量较模型对照组明显提高(P <0.05)。
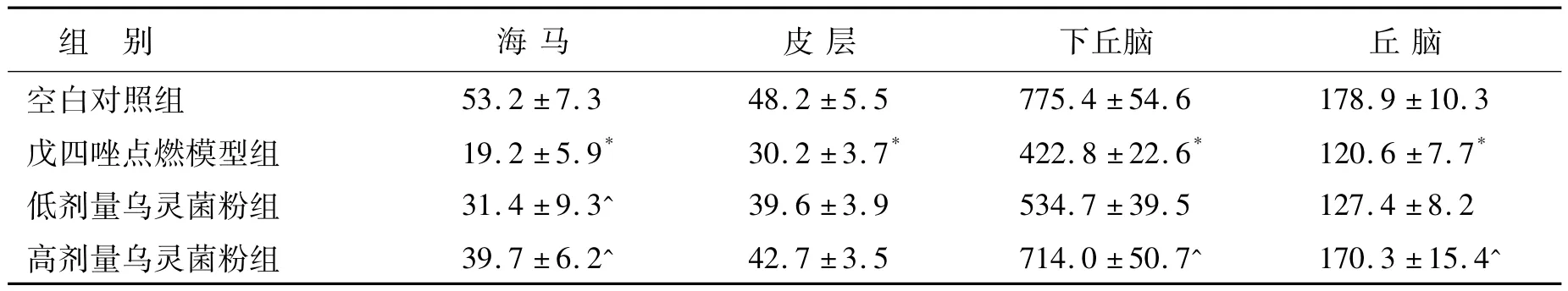
表3 乌灵菌粉对戊四唑点燃癫痫大鼠脑内组胺含量的影响(n=5,单位ng·g-1组织,¯x±σ)Table 3 Effects of Wuling mycelia on histamine content of brain in pentylenetetrazole-kindled rats(n=5,ng·g-1 tissue)
3 讨论
乌灵菌粉富含谷氨酸、γ-氨基丁酸(GABA)、组氨酸等多种氨基酸[12-13],药理研究表明[14],乌灵菌粉促进神经细胞摄取 GABA、增加GABA的合成酶(谷氨酸脱羧酶)和大脑皮层GABA受体结合活性。而GABA是中枢神经系统重要的抑制性神经递质之一,其作用是降低神经元活性,抑制神经细胞过度激活,发挥中枢镇静作用。这可能是乌灵菌粉延缓大鼠戊四唑癫痫点燃形成过程的原因。另外,GABA参与脑细胞三羧酸循环,提高葡萄糖代谢时葡萄糖磷酸酯酶的活性,增加乙酰胆碱的生成,促进脑细胞代谢和功能恢复。研究也发现,乌灵菌粉能增加神经细胞的能量储备,减少能量消耗,保护神经细胞免受各种应激的损伤[15],也可促进大鼠海马神经再生[16]。而海马与学习、记忆、情感等高级认知功能密切相关,这可能是乌灵菌粉改善癫痫大鼠学习能力的机制之一。
本实验发现大鼠戊四唑点燃后脑内各区组胺含量明显下降,而乌灵菌粉则使组胺含量重新上升,尤在海马区低剂量乌灵菌粉组和高剂量乌灵菌粉组,上升的程度均有统计学显著性意义。组胺是一种单胺类物质,通过其特异性受体,即 H1、H2和 H3受体发挥多种生理功能[17]。其中组胺H3受体主要分布在中枢神经系统,参与调节包括谷氨酸、GABA、乙酰胆碱及组胺本身等神经递质合成和释放[18]。我们先前的研究提示,神经组胺具有抗癫痫作用[18-19],其抗癫痫作用与 H1和 H3受体有关。因此,不难推测组胺神经的活化参与了乌灵菌粉的抗癫痫作用。另外,我们的研究结果和文献报道均证实活化脑内组胺能神经具有改善认知功能的作用[10-20]。所以,我们认为活化脑内组胺能神经可能是乌灵菌粉抗癫痫作用的机制之一。
另外,本实验发现高剂量乌灵菌粉组在减轻戊四唑点燃癫痫大鼠的发作级别及改善学习能力方面,比低剂量乌灵菌粉组更加明显,但本次研究统计学上未显示有显著性意义。因此,乌灵菌粉作用的剂量相关程度尚需更多的实验论证。
总之,乌灵菌粉不仅可延缓大鼠戊四唑点燃癫痫的形成,还可改善癫痫诱发的学习能力障碍,活化脑内组胺能神经可能是其作用机制之一。
[1] NGUGI A K,KARIUKI S M,BOTTOMLEY C,et al.Incidence of epilepsy a systematic review and meta analysis [J].Neurology,2011,77(10):1005-1012.
[2] WANG Xue-feng(王学峰).Neurology(神经病学)[M].第二版.Beijing:People's Medical Publishing House,2010:282-311.
[3] VINGERHOETS G.Cognitive effects of seizures[J].Seizure,2006,15(4):221-226.
[4] HONG Zhen,HUANG Mao-sheng,WANG Bei(洪震,黄茂盛,王 蓓).Analysis of cognitive function status in patients with epilepsy [J].Journal of Clinical Electroneurophysiology(临床神经电生理学杂志),2002,11(2):88-90.
[5] RUSS S A,LARSON,HALFON N.A national profile of childhood epilepsy and seizure disorder[J].Pediatrics,2012,129(2):256-264.
[6] ZHU Bai-ke,WANG Jing-jing(朱百科,王净净).Study Progress in the Anti-epilepsy M echanism of Single TCM [J].Guiding Journal of Traditional Chinese Medicine and Pharmacy(中医药导报),2008,14(7):110-112.
[7] HE Juan,MA Shi-lei(贺 娟,马师蕾).Influence of Repeated Seizures and Large Dosage Antiepileptic Drug on Phosphorylated cAMP Response Element Binding Protein in Rat's Hippocampus and Effect of Caoguo Zhimu Decoction on It[J].Chinese Journal of Integrated Traditional and Western Medicine(中国中西医结合杂志),2007,27(9):819-821.
[8] LU Hang,FAN Min(陆 行,樊 敏).Effect of Wuling mycelia on 13 cases of refractory epilepsy patients[J].Zhejiang Journal of Integrated Traditional Chinese and Western Medicine(浙江中西医结合杂志),2004,14(6):367-368.
[9] ZHANG L S,CHEN Z,REN K,et al.Effects of clobenpropit on pentylenetetrazole-kindled seizures in rats[J].Eur J Pharmacol,2003,482(1-3):169-175.
[10] ZHANG Li-san,MA Yuan-ying,LI Qing,et al(张力三,马袁英,李 青,等).Effects of endogenous histamine on memory impairment induced by pentylenetetrazole-kindled epilepsy in rats[J].Journal of Zhejiang University:Medical Sciences(浙江大学学报:医学版),2006,35(6):630-634.
[11] RACINE R J.Modification of seizure activity by electrical stimulation Ⅱ Motor seizure [J].Electroencephalogr Clin Neurophysil,1972,32:281.
[12] LIAO Ming-long,YU Jie(廖名龙,郁 杰).Wu ling capsule[J].Chinese Journal of New Drugs(中国新药杂志),2000,9(11):797.
[13] MA Cheng,WENG Rong-an,ZHANG Ping(马橙,翁榕安,张 平).Advances on studies of Xylaria nigripes [J].Journal of Fungal Research(菌物研究),2009,7(1):59-62.
[14] MA Zhi-zhang,ZUO Ping-ping,CHEN Wan-ru,et al(马志章,左萍萍,陈宛如,等).Studies on the sedative and sleeping effects of Wuling mycelia and its pharmacological mechanism [J].Chinese Pharmaceutical Journal(中国药学杂志),1999,34(6):374-377.
[15] ZHANG Yan,WANG Wan-hua(张 炎,王万华).Evaluation on results of fluoxetine combined with Wuling capsule for treatment of PSD [J].Chinese Journal of Hemorheology(中国血液流变学杂志),2005,15(4):574-576.
[16] LI De-qiang,LI Xu-juan,DUAN Jin-feng,et al(李德强,李旭娟,段金凤,等).Wuling Capsule promotes hippocampal neurogenesis by improving expression of connexin 43 in rats exposed to chronic unpredictable mild stress[J].Journal of Chinese Integrative Medicine(中西医结合学报),2010,8(7):662-669.
[17] HAASH,PANULA P.The role of histamine and the tuberomamillary nucleus in the nervous system[J].Nat Rev Neurosci,2003,4(2):121-130.
[18] ZHANG L S,CHEN Z,REN K,et al.Effects of clobenpropit on pentylenetetrazole-kindled seizures in rats[J].Eur J Pharmacol,2003,482(1-3):169-175.
[19] ZHANG L S,CHEN Z,HUANGY W,et al.Effects of endogenous histamine on seizure development of pentylenetetrazole induced kindling in rats[J].Pharmacology,2003,69(1):27-32.
[20] ZHANG Li-san,JIN Chun-lei,Li Qing,et al(张力三,金春雷,李 青,等).Influence of chronic epilepsy on spatial memory retrieval in rats[J].Journal of Zhejiang University:Medical Sciences(浙江大学学报:医学版),2004,33(3):205-208.
Effects of Wuling mycelia on pentylenetetrazole-induced epilepsy in rats
CHEN Guan-feng1,REN Guang-li2,ZHANG Li-san1,HU Xing-yue1
(1.Department of Neurology,Sir Run Run Shaw Hospital,Zhejiang University School of Medicine,Hangzhou 310016,China;2.Department of Neurology,Lihuili Hospital,Ningbo 312300,China)
Objective:To investigate the effects and mechanisms of Wuling mycelia on seizure development and learning ability induced by pentylenetetrazole-kindling epilepsy in rats.Methods:SD rats were randomly divided into four groups:pentylenetetrazole-kindling model group(model group),low dose Wuling mycelia(0.3 g·kg-1)group(LD-WM group),high dose Wuling mycelia(0.6 g·kg-1)group(HD-WM group)and control group.The rats were intraperitoneal injected with a subconvulsivedose(35 mg·kg-1)of pentylenetetrazole(saline in control group)every 48 h for 12 times.Wuling mycelia was intragastrically applied 30 min before pentylenetetrazole injection.An 8-arm radial maze(4 arms baited)was used to measure the learning ability.Histamine was measured by chemical fluorometric enzyme immunoassay.Results:Compared with the model group,the kindling stage of LD-WM group degraded significantly after 7th injection,the latency to the onset of myoclonic jerks(LTMJ)and the latency to the onset of generalized seizures(LTGS)prolonged after the 6th and 7th injection,respectively(P <0.05).The kindling stage of HD-WM group also degraded markedly after the 6th to 8th injection,and the LTMJand the LTGS extended after the 8th to 9th and 6th injection,respectively(P <0.05).Compared with the control group,the frequency of working memory error(WME)and reference memory error(RME)of the model group in the 8-arm radial maze increased through 3-d training(P <0.05).The memory tests showed that the impairment induced by pentylenetetrazole was partially reversed by Wuling mycelia.Compared with the control group,brain histamine contents(hippocampus,cortex,thalamus and hypothalamus)were significantly lower in model group(P <0.05).But compared with the model group,hippocampal histamine contents in LD-WM group and hippocampal,thalamic and hypothalamic histamine contents in HD-WM group were elevated(P <0.05).Conclusion:Wuling mycelia can delay the kindling and ameliorate the ability of learning in rats with pentylenetetrazoleinduced epilepsy and the enhancement of neuronal histamine activity may be one of possible mechanisms.
Drug therapy(TCD);Wuling mycelia;Epilepsy;Pentylenetetrazole;Histamine
R 971.6
A
1008-9292(2012)06-0647-06
http:∥www.journals.zju.edu.cn/med
10.3785/j.issn.1008-9292.2012.06.007
2012-03-12
2012-05-24
浙江省自然科学基金项目(Y2090184);浙江省中医药局青年基金(2006Y005).
陈冠锋(1980-),男,在职研究生,主治医师,从事神经内科临床工作.
张力三(1977-),男,硕士,主治医师,从事癫痫的基础研究和临床工作;E-mail:zls09@zju.edu.cn
[责任编辑 张荣连]
