聚乙烯亚胺/环糊精聚合物偶合雷公藤内酯醇的体外抗肿瘤活性研究
2012-01-23胡天楠王启闻胡奇达王训师汤谷平
胡天楠,王启闻,金 雪,胡奇达,王训师,徐 桑,周 峻,汤谷平
聚乙烯亚胺/环糊精聚合物偶合雷公藤内酯醇的体外抗肿瘤活性研究
胡天楠,王启闻,金 雪,胡奇达,王训师,徐 桑,周 峻,汤谷平
(浙江大学化学生物和药物研究所,浙江杭州310028)
目的:合成并表征雷公藤内酯醇-聚乙烯亚胺-环糊精聚阳离子复合物,考察雷公藤内酯醇-聚乙烯亚胺-环糊精在几种不同癌细胞上的抗癌活性和siRNA携带能力。方法:通过N,N'-羰基二咪唑将雷公藤内酯醇偶合到聚乙烯亚胺-环糊精载体材料上,制成雷公藤内酯醇-聚乙烯亚胺-环糊精纳米复合物。用1H-NMR、FT-IR和XRD对该材料进行了谱学表征,用MTT、划痕实验和伊红-苏木精染色实验对其细胞毒性和体外抗肿瘤活性进行了评估,并用凝胶电泳实验、粒径和表面电势的测定及携带siRNA的细胞荧光染色实验,初步研究了聚合物的siRNA压缩能力与携带能力。结果:合成了雷公藤内酯醇-聚乙烯亚胺-环糊精聚阳离子复合物,且雷公藤内酯的接入率为10%(w/w)。聚合物在N/P为5时具有较好的siRNA压缩能力,形成粒径约为(300±15)nm和表面电荷为(8±2.5)mV的微粒,细胞毒性实验、划痕实验及HE染色实验表明雷公藤内酯醇-聚乙烯亚胺-环糊精聚合物毒性降低,具有较好的抑制细胞转移能力,能有效携带siRNA并进入细胞中。结论:雷公藤内酯醇-聚乙烯亚胺-环糊精可在体外抑制癌细胞的生长和迁移,并可携带siRNA进入细胞内部,有望用于肿瘤的基因/药物协同治疗。
环糊精类/化学;聚乙烯亚胺/化学;雷公藤内酯/治疗应用;抗肿瘤药/药理学;纳米复合物;聚乙烯亚胺;环糊精;雷公藤内酯醇;抗肿瘤活性
[JZhejiang Univ(Medical Sci),2012,41(6):610-619.]
雷公藤内酯醇是传统中药雷公藤的有效成分,对肿瘤、系统性红斑狼疮等疾病具有独特的治疗效果[1-2]。研究和临床用药显示雷公藤内酯醇毒性较大,治疗窗口较窄[3],因此,对其进行药物剂型的修饰,在保证其疗效的同时,降低其毒副作用,是一项有意义的研究。
将药物连接在高分子载体材料上制成缓释制剂,可以防止药物“暴释”产生的急性毒性。缓释和靶向药物在血管内有透过性增强及滞留效应(enhanced permeability and retention effect,EPR),可以被动靶向到炎症或肿瘤组织,减少全身毒性[4]。
本研究以聚乙烯亚胺-环糊精为载体材料,将雷公藤内酯醇经活化后偶合于载体材料上,制成雷公藤内酯醇-聚乙烯亚胺-环糊精复合物,对所合成的复合物药物进行了表征,考察其体外细胞毒性和抗癌活性。聚乙烯亚胺-环糊精是一种阳离子载体,可以携带DNA或siRNA,实验发现在其偶合雷公藤内酯后可携带siRNA,具有实现药物-基因协同释放的可能,为进一步实现药物-基因协同释放打下了一定的研究基础[5]。
1 材料与方法
1.1 材料 聚乙烯亚胺(PEI 600 Da),环糊精(CyD),甲基噻唑基四唑(methyl thiazolyl tetrazolium,MTT),N,N'-羰基二咪唑(N,N'-carbonyldiimidazole,CDI)购自 Aldrich-Sigma 公司。雷公藤内酯醇(triptolide,TPL)购自成都普瑞法生物科技公司。异硫氰酸荧光素(fluorescein isothiocyanate,FITC)标记的 siRNA购自Qiagen公司。人胚胎肾上皮细胞系HEK-293、人肝癌细胞系 BEL-7402、SMC-7721购自南京凯基生物科技公司,由实验室保种。其它实验所用试剂均为分析纯。
1.2 雷公藤内酯醇-聚乙烯亚胺-环糊精的合成聚乙烯亚胺-环糊精的合成方法参照文献[6-7]。将聚乙烯亚胺-环糊精(56.1 mg)溶于25 ml DMSO中备用;称取雷公藤内酯醇9.8 mg(0.027 mmol),溶于5 ml DMSO 中;CDI 9.9 mg(0.061 mmol),溶于 5 ml DMSO 中;将雷公藤内酯醇溶液与CDI溶液一起加入50 ml圆底烧瓶中,避光、充氮气保护,再加入100μl三乙胺为催化剂,反应1.5 h。将已配好的聚乙烯亚胺-环糊精溶液慢慢滴入上述反应体系,在氮气保护避光条件下反应过夜。将反应液取出,用MW 8 000~14 000透析膜在流动纯水中透析48 h。冷冻干燥3 d,得到产物。
1.3 雷公藤内酯醇-聚乙烯亚胺-环糊精的表征核磁共振表征 分别取聚乙烯亚胺-环糊精、雷公藤内酯醇-聚乙烯亚胺-环糊精3~5 mg,用1 000μl D2O溶解。室温下用 Brunker Avance 400 DMX核磁共振光谱仪进行分析。红外光谱分析:分别取聚乙烯亚胺-环糊精、雷公藤内酯醇-聚乙烯亚胺-环糊精1~2 mg制成KBr盐片,室温下用 Thermo Nicolet AVATER 330傅里叶红外光谱仪进行分析。粉末X射线衍射分析:将聚乙烯亚胺-环糊精、雷公藤内酯醇-聚乙烯亚胺-环糊精和雷公藤内酯醇单体在D/Max-2550Pc上进行粉末X-衍射谱分析。
1.4 雷公藤内酯醇-聚乙烯亚胺-环糊精的细胞毒性与抗肿瘤活性实验细胞培养 将HEK-293细胞置于含10% 小牛血清的DMEM培养液中,将BEL-7402、SMC-7721细胞置于含10%小牛血清的RPMI1640培养液中,于37℃、5%CO2饱和湿度的培养箱中贴壁培养。
MTT法检测细胞毒性:将 HEK-293、BEL-7402、SMMC-7721细胞接种到96孔板上,细胞数为 1.0 × 104细胞/孔,37℃、5%CO2培养箱培养24 h。雷公藤内酯醇-聚乙烯亚胺-环糊精用无血清的培养液DMEM或1640配制成浓度梯度(0.1、0.2、0.5、1、2 μg/ml)的溶液,由核磁氢谱分析提示雷公藤内酯醇接入率约为10%,作为对比,雷公藤内酯醇单体用无血清的培养液DMEM或 1640配制成浓度梯度(0.01、0.02、0.05、0.1、0.2 μg/ml)的溶液。吸去每孔中培养液,加入含不同药物浓度的培养液,每孔0.2 ml,3 复孔,共温育 4 h 后,吸去培养液,加入含有10%MTT(0.5 mg/ml)的有血清培养液100μl,培养3 h后翻板弃去培养液,每孔加入100μl DMSO检测细胞的代谢活动。细胞活性=样本OD/空白对照组OD×100%。
肿瘤细胞迁移能力的影响:将BEL-7402细胞用含10%小牛血清的RPMI-1640培养液配成浓度为1.5×105个/ml的细胞悬液,以1 ml/孔接种于24孔板中,于37℃、5%CO2饱和湿度的孵箱中继续培养16~24 h,使之形成单层细胞。用10μl移液枪在单层细胞上划“一”字划痕,用PBS清洗三次,在倒置相差显微镜下拍照。用无血清培养液,配制浓度为0.1、0.2、0.5、1、2 μg/ml的雷公藤内酯醇-聚乙烯亚胺-环糊精溶液,和浓度为 0.01、0.02、0.05、0.1、0.2 μg/ml的雷公藤内酯醇单体溶液,另配制 0.1、0.2、0.5、1、2 μg/ml的未接入雷公藤内酯醇的聚乙烯亚胺-环糊精溶液作为阴性对照。将以上溶液分别加入划过的24孔板中,每孔1 ml,于37℃、5%CO2饱和湿度的孵箱中培养24 h后换成含10%小牛血清的RMPI1640培养液,继续孵育24 h。在倒置相差显微镜下拍照,并将照片与加药前的划痕照片对比。
细胞形态学实验:分别将 HEK-293、BEL-7402、SMMC-7721三种细胞配成浓度为2.5×104个/ml的细胞悬液,接种于24孔板中。用无血清培养液配制浓度为 0.1、0.5、2 μg/ml的雷公藤内酯醇-聚乙烯亚胺-环糊精溶液和浓度为 0.01、0.05、0.2 μg/ml的雷公藤内酯醇单体溶液,另配制 0.1、0.5、2 μg/ml的未接入雷公藤内酯醇的聚乙烯亚胺-环糊精溶液作为阴性对照,分别加入接种有三种细胞的24孔板中,每孔1 ml,置于37℃、5%CO2饱和湿度的孵箱中继续培养。24 h后,吸出孔中液体,用PBS清洗后甲醛固定10 min,按顺序加入苏木精和伊红染色,清洗后加入少量PBS在倒置相差显微镜下观察并拍照。
1.5 雷公藤内酯醇-聚乙烯亚胺-环糊精的siRNA压缩能力与携带能力凝胶滞缓实验将聚乙烯亚胺-环糊精、雷公藤内酯醇-聚乙烯亚胺-环糊精与siRNA(浓度为1μg/μl)按一定的N/P(PEI的氮元素摩尔数:siRNA中磷元素摩尔数)混合,加入1%琼脂糖(含有0.5μg/μl溴化乙啶)制备的凝胶孔中,在1×TAE缓冲液中80 V电泳45 min。电泳结束后,在紫外灯下观察载体材料阻滞siRNA的合适N/P比。
粒径和表面电势的测定:将聚乙烯亚胺-环糊精、雷公藤内酯醇-聚乙烯亚胺-环糊精与质粒混合,制备不同N/P的复合物(含siRNA 1 μg),用水稀释至 1 ml,在 Malvern Zetasizer粒径检测仪上测试粒径与表面电势。
携带siRNA的细胞摄取实验:将聚乙烯亚胺-环糊精、雷公藤内酯醇-聚乙烯亚胺-环糊精与FITC标记的siRNA混合,制备N/P为30/1的复合物(含siRNA 1μg),用无血清培养液稀释至1 ml,加入孔中,于 37℃、5%CO2饱和湿度的孵箱中孵育。4 h后,吸去24孔板中液体,加入甲醛固定10 min,并用Hoechest染料染色后,置于激光共聚焦显微镜下观察并拍照。
2 结果
2.1 雷公藤内酯醇-聚乙烯亚胺-环糊精的合成结果 雷公藤内酯醇-聚乙烯亚胺-环糊精的合成路线如图1所示。整个反应体系为非水体系,实验选用DMSO作为溶剂,三乙胺为催化剂。在反应体系中活化剂N,N-羰基咪唑与雷公藤内酯醇的摩尔比为2.25∶1,反应表明本实验条件可以确保雷公藤内酯醇完全活化。活化后的雷公藤内酯醇与聚乙烯亚胺-环糊精的摩尔比为1∶1.15,为使反应完全,雷公藤内酯活化物滴加入聚乙烯亚胺-环糊精体系的速度需控制,以防止局部过浓现象。反应物经过透析和冰冻干燥后得白色的絮状物。
2.2 化学结构表征结果 氢核磁共振表征结果:图2A是聚乙烯亚胺-环糊精的图谱,在化学位移2.5~2.8和4.8范围内有环糊精上亚甲基和次甲基(-CH2、-CH-)的吸收峰;图2B是雷公藤内酯醇-聚乙烯亚胺-环糊精的图谱,从图上可以看出,除了仍保留聚乙烯亚胺-环糊精的特征吸收峰外,在化学位移0.72(二重峰)、0.85(二重峰)、0.94(单峰)处有吸收信号,分别对应于雷公藤内酯醇的16、17和20位碳上的甲基,根据雷公藤内酯醇上的甲基H与环糊精1位碳H的计算,雷公藤内酯的接入率为10%。
傅里叶红外光谱表征结果:图3A是聚乙烯亚胺-环糊精、雷公藤内酯醇-聚乙烯亚胺-环糊精和雷公藤内酯醇单体的红外光谱图。从图中可以看出,与未接入雷公藤内酯醇的聚乙烯亚胺-环糊精相比,雷公藤内酯醇-聚乙烯亚胺-环糊精在1752 cm-1处出现了一个羰基峰,其为雷公藤内酯醇内酯环上的羰基产生的吸收。从红外图谱吸收峰可以说明雷公藤内酯醇已偶合于载体材料。

图2 聚乙烯亚胺-环糊精(A)和雷公藤内酯醇-聚乙烯亚胺-环糊精(B)的1H-NMR谱图Fig.2 1H-NMR spectra of PEI-CyD(A)and TPL-PEI-CyD(B)
X射线衍射分析结果:图3B为聚乙烯亚胺-环糊精、雷公藤内酯醇-聚乙烯亚胺-环糊精和雷公藤内酯醇单体的粉末XRD图谱,由图可知聚乙烯亚胺-环糊精(a)为无定形化合物,雷公藤内酯醇(b)为结晶型化合物,雷公藤内酯醇偶合于聚乙烯亚胺-环糊精后,其结构也为无定形,但是衍射峰的峰位发生了位移,表明雷公藤内酯醇已经偶合于载体材料上。

图3 聚乙烯亚胺-环糊精、雷公藤内酯醇-聚乙烯亚胺-环糊精和雷公藤内酯醇单体的红外图谱(A)和粉末XRD图谱(B)Fig.3 FT-IR spectra of TPL,TPL-PEI-CyD,PEI-CyD(A);XRD image of TPL,TPL-PEI-CyD,PEI-CyD(B)
2.3 雷公藤内酯醇-聚乙烯亚胺-环糊精的细胞毒性与抗肿瘤活性 MTT细胞毒性实验结果MTT实验是评价材料对正常细胞毒性和对肿瘤细胞抗癌活性的重要手段。实验选取HEK-293细胞、BEL-7402和SMMC-7721肝肿瘤细胞为研究对象进行实验,分别测试了雷公藤内酯和雷公藤内酯醇-聚乙烯亚胺-环糊精对细胞的毒性。图4是MTT的实验结果,从图上可以看出,雷公藤内酯醇在接入聚乙烯亚胺-环糊精后,对正常细胞的毒性明显降低,对癌细胞的抑制率则无显著变化,表明雷公藤内酯醇-聚乙烯亚胺-环糊精在一定程度上降低雷公藤内酯醇毒性的同时保留其抗癌活性。
划痕实验结果:实验选取人肝癌细胞BEL-7402细胞作为实验对象,分别测试了不同浓度的聚乙烯亚胺-环糊精、雷公藤内酯醇-聚乙烯亚胺-环糊精和雷公藤内酯醇对肿瘤细胞迁移的影响。如图5A和5B所示,聚乙烯亚胺-环糊精本身对肿瘤细胞的迁移没有显著影响,雷公藤内酯醇则可以抑制肿瘤细胞的迁移。雷公藤内酯醇-聚乙烯亚胺-环糊精抑制肿瘤细胞迁移的能力比雷公藤内酯醇更强,抑制肿瘤迁移的作用就越明显,这可能与雷公藤内酯醇与载体材料连接后更易被细胞内化有关。
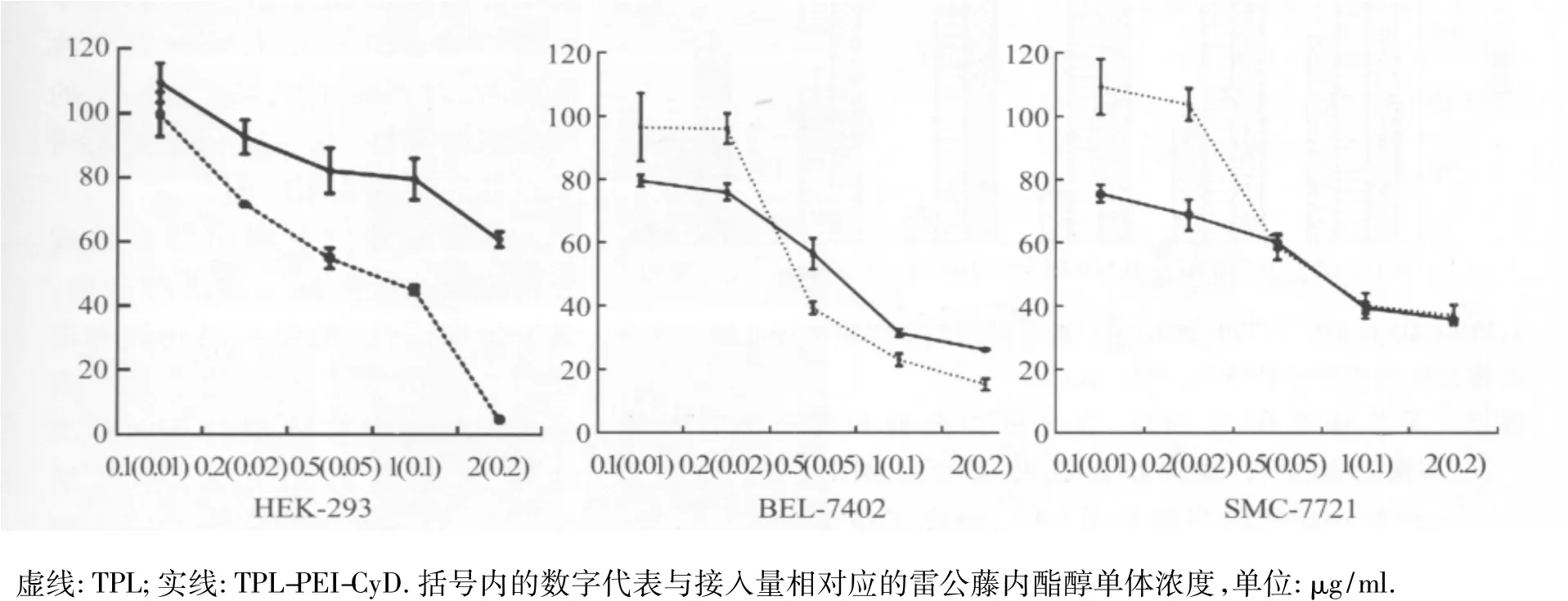
图4 雷公藤内酯醇和雷公藤内酯醇-聚乙烯亚胺-环糊精在HEK-293、BEL-7402和SMMC-7721肝肿瘤细胞上的细胞毒性实验Fig.4 Cytotoxicity of TPL and TPL-PEI-CyD by MTT assay in HEK-293,BEL-7402 and SMMC-7721 cell lines
细胞形态学实验结果:图6是不同浓度的聚乙烯亚胺-环糊精、雷公藤内酯醇和雷公藤内酯醇-聚乙烯亚胺-环糊精在SMMC-7721细胞上的HE染色实验结果,从图6中与可以看出,聚乙烯亚胺-环糊精在实验设置的浓度下对细胞均无明显影响,但雷公藤内酯醇在浓度较低时就呈现出很明显的细胞毒性。与单体相比,雷公藤内酯醇-聚乙烯亚胺-环糊精的毒性要小一些,在低浓度时几乎与聚乙烯亚胺-环糊精相同,只有在高浓度时才呈现出明显的细胞毒性。
2.4 雷公藤内酯醇-聚乙烯亚胺-环糊精的siRNA压缩能力与携带能力凝胶滞缓实验结果 图7A是聚乙烯亚胺-环糊精和雷公藤内酯醇-聚乙烯亚胺-环糊精的琼脂糖凝胶电泳滞缓实验照片。实验结果显示,聚乙烯亚胺-环糊精在N/P为3∶1时能压缩siRNA,而雷公藤内酯醇-聚乙烯亚胺-环糊精则在N/P为5∶1时可以缩合siRNA。可以推测,当雷公藤内酯醇偶合于聚乙烯亚胺-环糊精载体材料上后,载体材料表面的氨基数减少,同时,由于雷公藤内酯醇的接入使雷公藤内酯醇-聚乙烯亚胺-环糊精/siRNA微粒的致密程度有所降低,使雷公藤内酯醇-聚乙烯亚胺-环糊精结合siRNA的能力略有减弱。但总的来说,雷公藤内酯醇-聚乙烯亚胺-环糊精保留了较好的基因压缩能力,有利于携带核酸进入细胞。
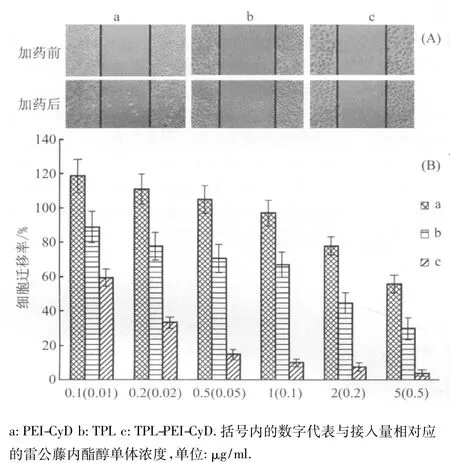
图5 聚乙烯亚胺-环糊精、雷公藤内酯醇和雷公藤内酯醇-聚乙烯亚胺-环糊精在人肝癌细胞BEL-7402细胞上抑制细胞迁移实验结果(A),细胞迁移率(B)Fig.5 Results of cell wound healing assay in BEL-7402 cell line using PEI-CyD,TPL and TPL-PEI-CyD(A);The rate of cell migration(B)
粒径与表面电势的测定结果:在基因转染过程中,载体材料与siRNA复合物所形成微粒的大小和表面电势与基因转染效率有很大关系。图7B是雷公藤内酯醇-聚乙烯亚胺-环糊精携带siRNA后的粒径大小和表面电荷的结果,由实验结果可知其粒径随N/P的增加而降低,当N/P=30时,复合物的粒径约在300±15nm左右,复合物的表面电势则稳定在(8±2.5)mV左右,可以满足非病毒基因载体高效转染的需要。
携带siRNA的细胞吞噬实验结果:为考察雷公藤内酯醇-聚乙烯亚胺-环糊精的siRNA携带能力,我们用聚乙烯亚胺-环糊精和雷公藤内酯醇-聚乙烯亚胺-环糊精材料携带了标记FITC的siRNA进行细胞吞噬实验,以HEK-293细胞为研究对象。经过4h吞噬后用Hoechest染料对细胞核染色,在激光共聚焦显微镜下观察两种聚合物对siRNA的吞噬情况。结果如图8所示,上图为PEI-CyD材料,下图为偶合雷公藤内酯醇的PEI-CyD聚合物,由图可知两者都均可以携带siRNA进入细胞中,并分布于细胞质中。
3 讨论
近年来,具有抗肿瘤活性的天然药物引起了研究者的极大兴趣,如紫杉醇[6],已被商品化并被广泛用于临床肿瘤化疗中。然而,许多天然产物在具有很高抗肿瘤活性的同时,对正常细胞也产生一定的细胞组织毒性,在一定程度上妨碍了这些药物的临床应用。
从雷公藤中分离出的有效成分雷公藤内酯醇是一种天然药物,其抗肿瘤活性、免疫抑制功能和毒性引起了研究者的广泛关注。雷公藤内酯醇已被证明对不同种类的癌细胞有较好的抗肿瘤活性[1,7-9],对一些多药耐药的癌细胞也有疗效[1,10],其还能增强肿瘤细胞对其他化疗药物的敏感性[11-15]。此外,雷公藤内酯醇还具有较强的免疫活性,在多种自身免疫病(如类风湿性关节炎、系统性红斑狼疮)的动物模型中有较好疗效[16]。但雷公藤内酯醇毒性较大,毒性呈剂量依赖性,在动物实验中,高于治疗剂量2到4倍的用量即可致死[17],显示其治疗窗口较窄。鉴于其在肿瘤(尤其是白血病)和自身免疫病动物模型中的良好疗效,从上世纪60年代起,中国和美国的研究人员就尝试将雷公藤内酯醇商品化[18],但终因治疗窗口太窄未能成功。针对雷公藤内酯醇活性高、毒性大的特点,很多研究者试图通过改造雷公藤内酯醇的化学结构,筛选活性相对较高且毒性较低的衍生物。雷公藤内酯醇分子中14位羟基是最容易修饰的基团之一,通过它可以引入多种基团。已有的研究表明,通过对14位羟基进行取代反应引入亲水基团不仅可以解决雷公藤内酯醇水溶性差的问题,还可以大大降低雷公藤内酯醇的毒性[17]。Zhang等在研究中将雷公藤内酯醇的14位羟基活化后,通过丁二酸酐与溶菌酶键合,制得了雷公藤内酯醇-溶菌酶复合物,该复合物降低了雷公藤内酯醇的全身毒性,并可以利用肾脏截留大分子的能力,使雷公藤内酯醇被动靶向到肾脏,提高了其药效,是很有应用前景的一次尝试[19]。

图6 聚乙烯亚胺-环糊精、雷公藤内酯醇-聚乙烯亚胺-环糊精和雷公藤内酯醇单体在 SMMC-7721细胞株的伊红-苏木精染色实验Fig.6 HE staining images of PEI-CyD,TPL-PEI-CyDand TPL in SMMC-7721 cell line

在本研究中,我们尝试将雷公藤内酯醇的14位羟基活化后,与聚乙烯亚胺-环糊精偶合,制备了雷公藤内酯醇-聚乙烯亚胺-环糊精复合物。红外光谱、核磁共振氢谱与X射线衍射结果表明,雷公藤内酯醇用N,N-羰基二咪唑(CDI)活化后,可以偶合于聚乙烯亚胺侧链上的氨基,且雷公藤内酯的药物结合率达10%(w/w)左右。研究以人胚胎肾上皮细胞系 HEK-293、人肝癌细胞系 BEL-7402、SMC-7721为实验细胞,用细胞毒性实验、划痕实验和HE染色实验分别从细胞存活率、细胞迁移和细胞形态学等方面证明,与雷公藤内酯醇单体相比,雷公藤内酯醇-聚乙烯亚胺-环糊精复合物毒性降低,但仍保留了较好的抗肿瘤活性。
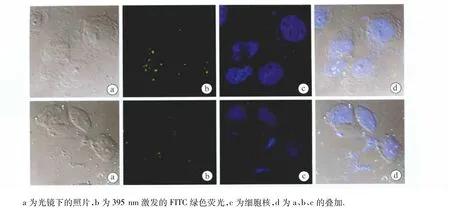
图9 激光共聚焦显微镜观察聚乙烯亚胺-环糊精(上)和雷公藤内酯醇-聚乙烯亚胺-环糊精(下)被HEK-293细胞株摄取图像Fig.9 CLSM images of the cellular uptake of PEI-CyD(Up)and TPL-PEI-CyD(Down)in HEK-293 cell lines
在本研究中,我们还研究了雷公藤内酯醇-聚乙烯亚胺-环糊精携带siRNA的能力。近年来,针对肿瘤对化疗药物产生耐药性问题,很多研究者尝试运用基因-药物协同疗法,即将基因和药物同时运送至癌细胞内部的方法,增加肿瘤细胞对化疗药物的敏感性,减少化疗药物的用量[20-23]。实验用凝胶阻滞实验评估了雷公藤内酯醇-聚乙烯亚胺-环糊精压缩siRNA的能力,表明雷公藤内酯醇的接入对聚乙烯亚胺-环糊精的基因压缩能力有一定影响,但在N/P约为5时仍可有效压缩siRNA。雷公藤内酯醇-聚乙烯亚胺-环糊精与siRNA形成的复合物粒径随N/P增加而减小,在N/P大于30时,复合物的粒径在300 nm,表面电荷在8 mV左右,有利于复合物在肿瘤细胞的吞噬[4]。我们还使用携带荧光标记的siRNA,通过细胞吞噬实验,证明了雷公藤内酯醇-聚乙烯亚胺-环糊精可以有效携带siRNA进入细胞内部。为进一步携带具有治疗作用的基因和siRNA的研究工作打下了一定的基础。
综上所述,本研究成功合成并表征了一种雷公藤内酯醇-聚阳离子高分子复合物。在下一步实验中,我们将用雷公藤内酯醇-聚乙烯亚胺-环糊精携带不同种类的治疗性siRNA,通过细胞学实验和动物实验,考察雷公藤内酯醇-聚乙烯亚胺-环糊精介导的基因-药物协同治疗肿瘤、红斑狼疮等疾病的疗效。
[1] YANG S H,CHEN J G,GUO Z,et al.Triptolide Inhibits the Growth and Metastasis of Solid Tumors[J].Mol Cancer Ther,2003,2:65-72.
[2] TAOX,Fan,F HOFFMANN,et al.Effective therapy for nephritis in(NZB NZW)F1mice with triptolide and tripdiolide,the principal active components of the chinese herbal remedy Tripterygium wilfordii Hook F[J].ARTHRITIS & RHEUMATISM,2008,58(6):1774-1783.
[3] SHAMON L A,PEZZUTO J M,GRAVES J M,et al.Evaluation of the mutagenic,cytotoxic,and antitumor potential of triptolide,a highly oxygenated diterpene isolated from Tripterygium wilfordii[J].Cancer Letter,1997,112(1):113-117.
[4] ALLEN T M,CULLIS P R.Drug delivery systems:entering the mainstream [J].Science,2004,303:1818-1822.
[5] WANG Y,CAO S,Ye W H,et al.Co-delivery of drugs and DNA from cationic core-shell nanoparticles self-assembled from a biodegradable copolymer[J].Nature Materials,2006,5:791-796.
[6] TANG G P,GUO H Y,ALEXIS F,et al.Low molecular weight polyethylenimines linked byβcyclodextrin for gene transfer into the nervous system [J].Gene Med,2006,8(6):736-744.
[7] ROBERT A B,SANT HAKUMAR V,CHIAKIY I,et al.An efficient new protocol for the formation of unsymmetrical tri-and tetrasubstituted ureas[J].Tetrahedron Letters,1998,39:6267-6270.
[8] KUPCHAN SM,COURT WA,DAILEY R G,et al.Triptolide and tripdiolide,novel antileukemic diterpenoid triepoxides from Tripterygium wilfordi[J].J Am Chem Soc,1972,94(20):7194-7195.
[9] WANI M C,TAYLOR H L,WALL M E,et al.The isolation and structure of taxol,a novel antileukemic and antitumor agent from Taxus breoifolia[J].J Am Chem Soc,1971,93(9):2325-2327.
[10] PAN J.RNA polymerase An important molecular target of triptolide in cancer cells[J].Cancer Letters,2010,292:149-152.
[11] WANG W,YANG S,SU Y,et al.Enhanced antitumor effect of combined triptolide and ionizing radiation [J].Clin Cancer Res,2007,13:4891-4899.
[12] TENGCHAISRI T,CHAWENGKIRTTIKUL R,RACHAPHAEW N,et al.Antitumor activity of triptolide against cholangiocarcinoma growth in vitro and in hamsters[J].Cancer Letters,1998,133:169-175.
[13] SHI X P,JIN Y L,CHENG C,et al.Triptolide inhibits Bcr-Abl transcription and induces apoptosis in STI571-resistant chronic myelogenous leukemia cells harboring T315I mutation[J].Clin Cancer Res,2009,15:1686-1697.
[14] TANG X Y,ZHU Y Q,TAO W H,et al.Synergistic effect of triptolide combined with 5-fluorouracil on colon carcinoma [J].Postgrad Med J,2007,83:338-343.
[15] CARTER B Z,MAK D H,SCHOBER W D,et al.Triptolide induces caspase-dependent cell death mediated via the mitochondrial pathway in leukemic cells[J].Blood,2006,108:630-637.
[16] WESTFALL SD,NILSSON EE,SKINNER M K,et al.Role of triptolide as an adjunct chemotherapy for ovarian cancer[J].Chemotherapy,2008,54:67-76.
[17] CHANG W T,KANG J J,LEE K Y,et al.Triptolide and chemotherapy cooperate in tumor cell apoptosis[J].JBC,2001,276(3):2221-2227.
[18] YANG M,HUANG J,PAN H Z,et al.Triptolide overcomes dexamethasone resistance and enhanced PS-341-induced apoptosis via PI3k/Akt/NF-κB pathways in human multiple myeloma cells[J].INT J MOL MED,2008,22:489-496.
[19] LIU Q.Triptolide and its expanding multiple pharmacological functions [J]. Int Immunopharmacol,2011,11:377-383.
[20] LI Z,Zhou Z L,Miao Z H,et al,Design and synthesis of novel c14-hydroxyl substituted triptolide derivatives as potential selective antitumor agents[J].J Med Chem,2009,52:5115-5123.
[21] ZHOU Z L,YANG Y X,DING J,et al.Triptolide:structural modifications, structure activity relationships,bioactivities,clinical development and mechanisms[J].Nat Prod Rep,2012,29:457-475.
[22] ZHANG Z R,QIANG Z G,JING H A,et al.The targeting of 14-succinate triptolidelysozymeconjugate to proximal renal tubular epithelial cells[J].Biomaterials,2009,30:1372-1381.
[23] MINKO T,SAAD M,GARBUZENKO O B,et al.Co-delivery of siRNA and an anticancer drug for treatment of multidrug-resistant cancer [J].Nanomedicine,2008,3(6):761-776.
[24] LU X,PING Y,TANG G P,et al.Bifunctional conjugates comprising β-cyclodextrin,polyethylenimine,and 5-fluoro-2'-deoxyuridine for drug delivery and gene transfer[J].Bioconjugate Chem,2010,21:1855-1863.
[25] ZHU C H,JUNGB S Y,LUO S B,et al.Codelivery of siRNA and paclitaxel into cancer cells by biodegradable cationic micelles based on PDMAEMA PCL PDMAEMA triblock copolymers[J].Biomaterials,2010,31:2408-2416.
[26] CHEN A M,HE H X,WEI D G,et al.Co-delivery of doxorubicin and Bcl-2 siRNA by mesoporous silica nanoparticles enhances the efficacy of chemotherapy in multidrug-resistant cancer cells[J].Small,2009,5(23):2673-2677.
Anticancer effect of triptolide-polyethylenimine-cyclodextrin in vitro
HU Tian-nan,WANG Qi-wen,JIN Xue,HU Qi-da,WANG Xun-shi,XU Sang,ZHOU Jun,TANG Gu-ping
(Institute of Chemical Biology and Pharmaceutical Chemistry,Zhejiang University,Hangzhou 310028,China)
Objective:To develop a drug delivery system triptolide-polyethylenimine-cyclodextrin and to evaluate its anticancer activity in vitro.Methods:Triptolide was conjugated to polyethylenimine-cyclodextrin by N,N'-carbonyldiimidazole to form triptolide-polyethylenimine-cyclodextrin.1H-NMR,FT-IR and XRD were used to confirm its structure.The anticancer effect of the polymer was assessed by MTTassay,erasion trace test and hematoxylin-eosin staining.The potential to condense siRNA and to delivery siRNA into cytoplasm was demonstrated by gel retardation assay,zeta-potential determination and fluorescence staining.Results:Triptolide was successfully conjugated to polyethylenimine-cyclodextrin and the conjugation rate of triptolide was 10%(w/w).siRNA was effectively condensed by the polymer at the N/Pratio of 5,and its particle size was 300±15 nm and zeta potential was 8 ±2.5 mV.MTT assay,erasion trace test and hematoxylin-eosin staining revealed that triptolide-polyethylenimine-cyclodextrin had anticancer effect and low cytotoxicity to normal cells.The polymer was able to deliver siRNA to the cytoplasm effectively as demonstrated by fluorescence staining.Conclusions:Triptolide-polyethylenimine-cyclodextrin is able to inhibit the growth and migration of cancer cells in vitro and to carry siRNA into cells effectively.It is potential to be used as a novel prodrug for co-delivery of gene and drug in cancer treatment.
Cyclodextrin/chemistry;Polyethyleneimine/chemistry;Triptolide/therapeutic use;Antineoplastic drugs/pharmacology;Nanocomposites;Polyethylenimine;Cyclodextrin;Triptolide;Anticancer ability
R 730.54
A
1008-9292(2012)06-0610-10
http:∥www.journals.zju.edu.cn/med
10.3785/j.issn.1008-9292.2012.06.003
2012-09-07
2012-10-08
国家自然科学基金项目资助项目(30970711,21074111).
胡天楠(1993-),男,本科生,化学专业.
汤谷平(1961-),男,博士,教授,博士生导师,主要从事生物材料、药物的控制释放和基因治疗等;E-mail:tangguping@zju.edu.cn
[责任编辑 张荣连]
