四种聚阳离子载体材料的体外细胞学及体内性质研究
2012-01-23胡天楠王启闻王训师胡奇达汤谷平
姚 祺,金 雪,胡天楠,王启闻,王训师,胡奇达,徐 桑,周 峻,汤谷平
四种聚阳离子载体材料的体外细胞学及体内性质研究
姚 祺,金 雪,胡天楠,王启闻,王训师,胡奇达,徐 桑,周 峻,汤谷平
(浙江大学化学生物和药物研究所,浙江杭州310028)
目的:对四种非病毒型聚阳离子载体材料的理化性质、体外细胞学及体内性质进行研究。方法:合成聚乙烯亚胺-环糊精(PEI-CyD)、聚乙烯亚胺-聚天冬酰胺(PEI-PHPA)和烷基胺-聚天冬酰胺(PEE-PHPA)等三种聚阳离子材料,用1H核磁共振对载体材料的结构进行确定;凝胶电泳实验研究了载体材料对质粒DNA的浓缩能力;粒径分析仪测定了载体材料结合DNA后的粒径及表面电荷。用MTT法在COS-7、A549、HEK-293和C6等细胞株上测定了四种载体材料的细胞毒性;在HEK-293细胞株上进行了体外细胞转染实验。进行了四种载体材料体内毒性、组织分布和体内携带报告基因转染实验。结果:1H核磁共振证实了它们的结构。在N/P小于40时,载体材料的平均粒径在100~250 nm,表面电荷在10~35 mV,适合体外细胞的吞噬。体外细胞毒性表明,PEE-PHPA 在 C6、COS-7、A549和 HEK293 细胞上的 IC50 值分别为21.5、20.2、7.30 和 37.1 μg/ml,PEI 25 kD 的 IC50 值分别为15.8、18.3、11.4 和36.7 μg/ml,PEI-CyD 和 PEI-PHPA 在实验所测定的浓度范围中,细胞的存活率高于60%。四种聚阳离子材料都具有较强的DNA缩合能力,且有较好的体外基因转染能力。体内急性毒性实验表明,PEI-PHPA、PEE-PHPA载体材料为低毒性载体材料,其LD50值大于500 mg/kg,血项指标表明PEE-PHPA载体材料对肝、肾功能有轻微影响,体内分布显示,四种聚阳离子载体材料在肾富集较高。结论:PEI-CyD、PEE-PHPA和PEI-PHPA聚阳离子载体材料均有较好的体外基因转染能力,能够携带报告基因在体内表达,其中PEI-CyD和PEE-PHPA是具有应用前景的非病毒性基因药物载体。
阳离子;聚合物;遗传载体;环糊精类/化学;聚乙烯亚胺/化学;聚阳离子材料;体外实验;体内实验
[JZhejiang Univ(Medical Sci),2012,41(6):620-630.]
非病毒药物载体在药物、基因的输送中具有重要的作用。经过多年的研究,证明其在药物输送的靶向性、安全性以及载药特性等方面均显示出良好的性能[1]。其中,聚阳离子材料具有无免疫原性,不引起机体的免疫反应、通过调控纳米尺寸和表面性质可控制其生理行为、经过靶向修饰,可实现药物和基因的定向释放等[2,3]特点,在非病毒药物载体中独树一帜。在药物和基因的携带过程中,聚阳离子材料表面的正电荷,通过静电作用可以浓缩DNAs或RNAs形成纳米微球[4],带正电荷的纳米微球易于粘附于带负电荷的细胞膜表面,以细胞内吞或受配体结合等方式进入细胞,并将药物或基团带入细胞。在细胞内部迁移的过程中,其独特的“质子缓冲效应”可以保护 DNAs或RNAs免受溶酶体的侵蚀和降解,以达到输送药物的目的[5-7]。但是,在研究中发现,聚阳离子材料也存在着某些缺陷与问题,如过量的正电荷会造成输送体系的溶血和栓塞,聚阳离子的非生物降解性、体内代谢较慢以及转染效率较低等问题,使其难以在实验及临床研究中得到广泛应用[8-10]。
针对这些问题,本论文以聚乙烯亚胺(PEI 25 kD)、聚乙烯亚胺-环糊精(PEI-CyD)、聚乙烯亚胺-聚天冬酰胺(PEI-PHPA)和烷基胺-聚天冬酰胺(PEE-PHPA)等四种聚阳离子材料为研究对象,对所合成的三种载体材料进行了细胞学评价,着重对载体材料进入体内后对生物体血相指标的影响,其在体内分布、毒性等作了研究,为载体材料的深入研究提供了科学的依据。
1 材料与方法
1.1 材料 聚乙烯亚胺(branch polyethylenimine,PEI,分子量分别为25 kDa 和600),天冬氨酸,购自 Sigma-Aldrich公司,β-环糊精(β-cyclodextrin,β-CyD,MW=1135),荧光素钠(分子量为376.27)购自 Sigma公司,N,N'-羰基二咪唑(1,1'-Carbonyldiimidazole,CDI,Mw=162.15)购自 Pierce公司,N,N-二甲基甲酰胺(N,N-Dimethylformamide,DMF,Sigma)3,3'-二氨基二丙基胺(Bis(3-aminopropyl)amine,98%,Aldrich)。萤火虫荧光素酶真核表达质粒pGL-4,购自 Promega公司。COS-7、A549、HEK293和C6细胞系由浙江大学医学院免疫学研究所提供。ICR小鼠购自浙江大学医学院实验动物中心。
1.2 方法
1.2.1 材料的合成 聚乙烯亚胺-环糊精(PEI-CyD)的合成:称取 β-CyD(2.2 g,1.85 mmol)溶于10 ml DMSO,取N,N'-羰基二咪唑CDI(2.5 g,14.8 mmol)溶于10 ml DMSO,于50 ml圆底烧瓶中,氮气保护、避光条件下搅拌反应 3 h。称取 PEI 600(6.8 g,11.5 mmol),溶于15 ml DMSO,滴加到上述反应溶液中,反应过夜。将反应液经Mw 8 000~14 000 Da透析膜透析,用流动纯水透析48 h。透析结束后,冷冻干燥至干,得到白色絮状固体。
聚乙烯亚胺-聚羟丙基天冬酰胺的合成(PEI-PHPA):称取 PHPA(0.5 g,2.92 mmol)溶于6 ml DMSO加入50 ml圆底烧瓶中,加入0.2 ml三乙胺(Et3N)作为催化剂,另取CDI(0.7 g,4.32 mmol)溶于 2.5 ml DMSO,在20 ℃条件下加入反应体系,在氮气保护避光条件下持续搅拌反应 3 h。取 PEI 600 Da(1.85 g,3.07 mmol)溶于6 ml DMSO,逐滴加入到活化的PHPA溶液中,氮气保护条件下避光反应过夜。将反应完的溶液转移入透析袋(Mw:8 000~14 400 Da)中,用流动的纯水透析48 h。透析完毕后,冰冻干燥,得到白色絮状固体。
烷基胺-聚天冬氨酸(PEE-PHPA)的合成:称取聚琥珀酰亚胺(PSI)(1 g,10 mmol)于15 ml N,N-二甲基甲酰胺中,加热使充分溶解,保持水浴,依次慢慢滴加二甲基二丙烯三胺和3,3'-二氨基二丙基胺,二甲基二丙烯三胺和3,3'-二氨基二丙基胺的总量控制在25 mmol,二者依次分别与PSI反应0.5 h。反应结束后,将反应液用透析袋(Mw=8000~14000 Da),用流动的纯水透析48 h,透析完毕后,冰冻干燥,得到白色絮状固体。
荧光素纳-聚乙烯亚胺-聚羟丙基天冬酰胺(Flu-PEI-PHPA)的合成:称取2.8 mg荧光素钠(7.5 mmol)于10 ml DMSO 中,称取 0.7 g CDI(4.32 mmol)于2 ml DMSO中,与上述体系反应3 h,再加入PEI-PHPA 3.5 mg在氮气保护下暗处反应过夜,反应结束后,将反应液用透析袋(Mw=8000-14000Da),用流动的纯水透析48 h,透析完毕后,冰冻干燥,得到红色絮状固体。其余三种载体材料的荧光素钠复合物的合成方法同上,产品经过1H NMR鉴定,荧光素钠的接入率为2.5%。经过高效液相色谱测定荧光素钠的纯度。
1.2.2 核磁共振氢谱(1H-NMR) 分别取以上三种合成载体材料和PEI 25 kD 5 mg,溶于0.5 ml D2O中,溶解后装入核磁管中,室温下用核磁共振仪测定。
1.2.3 粒径和表面电荷测定 将载体材料用双蒸水配制成1 mg/ml的溶液,将PEE-PHPA、PEI-PHPA、PEI-CyD和PEI 25 kD四种载体材料配置成350μg/μl;制备方法是:先分别将PEE-PHPA、PEI-PHPA、PEI-CyD 和 PEI 25 kD与DNA混合放置30 min。用pH 7.4的PBS溶液稀释至1.5 ml。用Zetasizer测定粒径和表面电荷。每份样品测定6次,每次50 s,得出6个数据取其平均值。
1.2.4 分子量的测定(GPC) 分别将 PEE-PHPA、PEI-PHPA、PEI-CyD 和 PEI 25 kD 四种载体材料5 mg溶解于1ml双蒸水中。色谱条件:以葡聚糖(12 000 Da,50 000 Da,80 000 Da,150 000 Da,670 000 Da)作为对照品,检测条件:Waters 515型凝胶色谱仪;Waters 2410示差折光检测器;TOSOH TSK-GEL G4000PWXL柱子(Janpan);色谱条件:柱温40℃,流速 0.8 ml/min,流动相 0.3 M NaAc(用醋酸调至 pH 4.44),进样量:50 μl。
1.2.5 脂糖凝胶电泳阻滞实验 电泳条件:1×TAE缓冲液,电压100 mV,电泳时间为40 min。在紫外灯下观察拍照,确定载体材料与结合阻滞质粒DNA的N/P比。将材料与质粒(1 μg)按照不同的 N/P=0∶1,1∶1,2∶1,3∶1,4∶1,5∶1,以pH7.4的PBS作为溶剂分别配制总体积为10μl的载体材料溶液与DNA溶液。混匀,静置30 min备用。
1.2.6 MTT细胞毒性实验 将 COS-7、A549和HEK-293及C6细胞接种于96孔板上(1×104个/孔),孵育16 h,移去培养液,每孔加入预先配制好的一系列浓度的待测的四种材料的无血清培养液。孵育4 h后,移去培养液,加入90 μl无血清DMEM培养液和10μl 5 mg/ml的MTT溶液,孵育3 h。翻板法除去培养液,加入100μl DMSO,振荡10 min后,在570 nm处用酶标仪测定其OD值。细胞活力的计算式∶细胞活力=(每孔样品OD值-每孔阳性OD平均值)/(每孔空白组OD平均值-每孔阳性OD平均值)×100%。
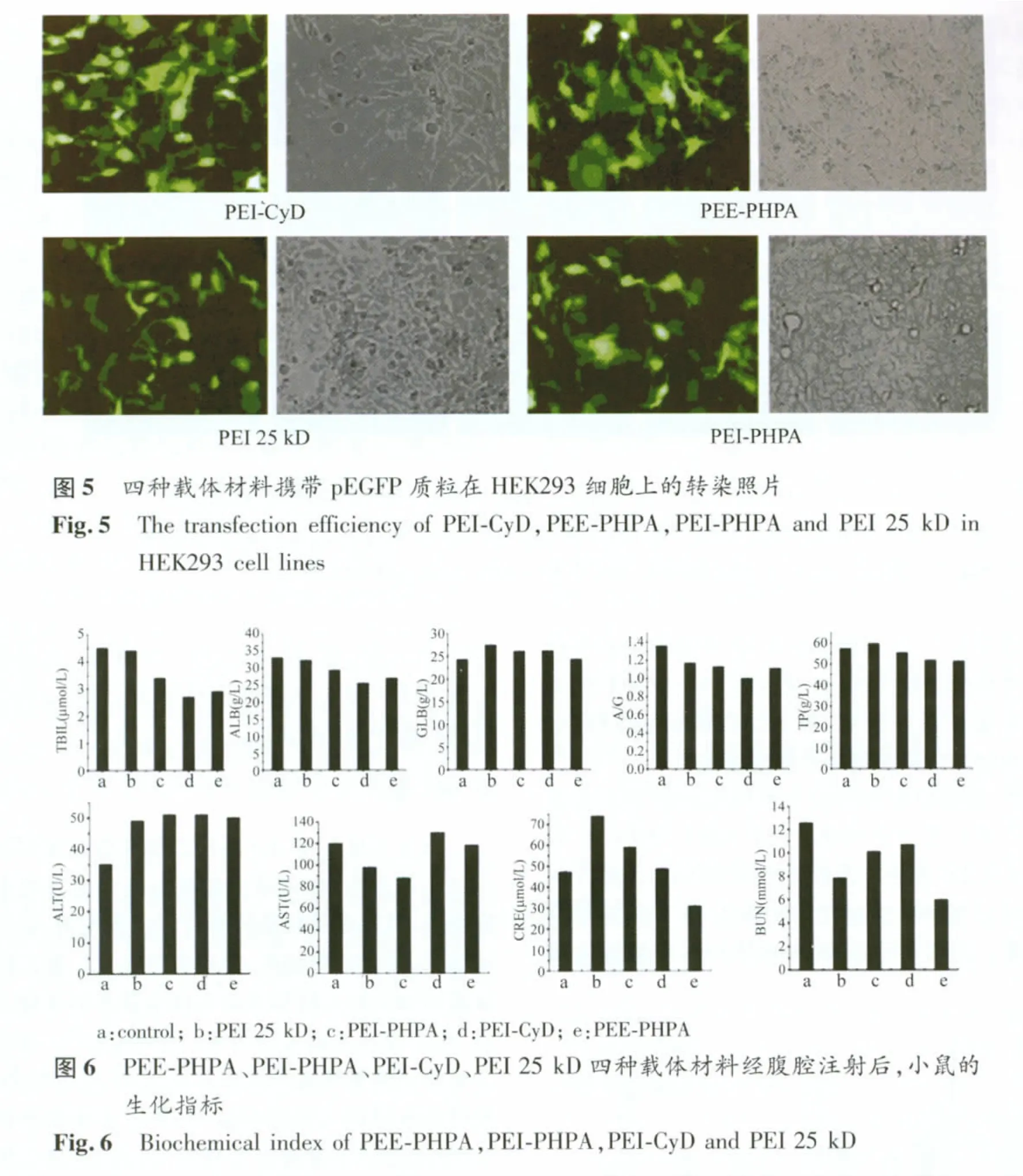
1.2.7 体外细胞转染实验 按每孔3×104个细胞(HEK293)每孔加10%小牛血清DMEM培养液500μl,37℃的CO2培养箱中孵育16 h,进行转染实验。每孔质粒用量为2μg,每孔加入浓度(N/P为20)的化合物PEI-PHPA、PEEPHPA、PEI-CyD溶液和PEI 25 kD的N/P比为10,用无血清DMEM培养液配制,每孔液体体积为500μl。孵育4h后,轻轻吸去培养液,每孔加入500μl 10%牛血清DMEM培养液继续孵育24 h以观察。
1.2.8 生化指标检测 分别将四种材料PEI 25 kD、PEI-PHPA、PEE-PHPA 和 PEI-CyD(1 mg/ml,0.2 ml)腹腔注射入 ICR 小鼠,平均每种材料注射3只小鼠,每隔1天注射1次,共注射4次。在最后一次注射完后撤去实物,12 h后进行眼眶取血,取约2 ml血样分别放入装有5μl肝素钠(防止凝血)的试管中。将试管密封送到浙江大学西溪校区医务室进行生化指标检测。
1.2.9 急性毒性试验ICR小鼠(18~20 g)100只,随机分成10组,(每组雌雄各5只,共10只小鼠),腹腔注射给药,给药前禁食8 h(提供饮水),给药后观察14 h。记录小鼠生存情况。4种材料共400只小鼠。
1.2.10 载体材料体内分布实验 ICR小鼠(18~20 g)20只,随机分成4组(每组5只),尾静脉注射载体材料,载体材料为用荧光标记的4种载体材料,给药24 h后,处死小鼠,取出器官(心脏、肝脏、脾脏、肾脏和肺)称重,加入PBS匀浆,将匀浆液离心,取上清,用HPLC方法测定五个组织器官中荧光素的含量。色谱条件为:色谱柱(25 cm,C18),流动相为乙睛∶水为7∶3,流速:0.5 ml/min,检测波长:238 nm。
1.2.11 载体材料携带报告基因体内转染实验ICR小鼠(18~20 g)20只,随机分成4组(每组5只小鼠),尾静脉注射:载体材料/pGL4-luc(50μg质粒 DNA,N/P=30/1)。48 h后,处死小鼠,取出器官(心脏、肝脏、脾脏、肾脏和肺)称重,加入PBS匀浆,将匀浆液离心,取上清,测荧光素酶活性。
2 结果
2.1 载体材料的性质表征 图1是烷基胺-聚天冬酰胺(PEE-PHPA)的合成路线,聚乙烯亚胺(600)-环糊精(PEI-CyD)[11]、聚乙烯亚胺(600)-聚天冬酰胺(PEI-PHPA)[12]的合成路线已曾报道。图2是四种载体材料的氢核磁共振图谱,其中图2a为PEI 25 kD的核磁共振图,图中化学位移为 2.5 ~3.0 为-NHCH2CH2-基团的特征吸收峰;图2b为PEI-CyD的核磁共振图,化学位移为3.3 ~4.0、5.0 为 β-CyD 的特征吸收峰。图2c为PEE-PHPA的核磁谱图;图2d为 PEI-PHPA的核磁谱图,化学位移为4.55、3.45 ~ 3.52、3.09 ~ 3.19、1.58 ~ 1.70 的特征吸收峰。

图1 PEE-PHPA的合成路线Fig.1 Synthesis route of PEE-PHPA
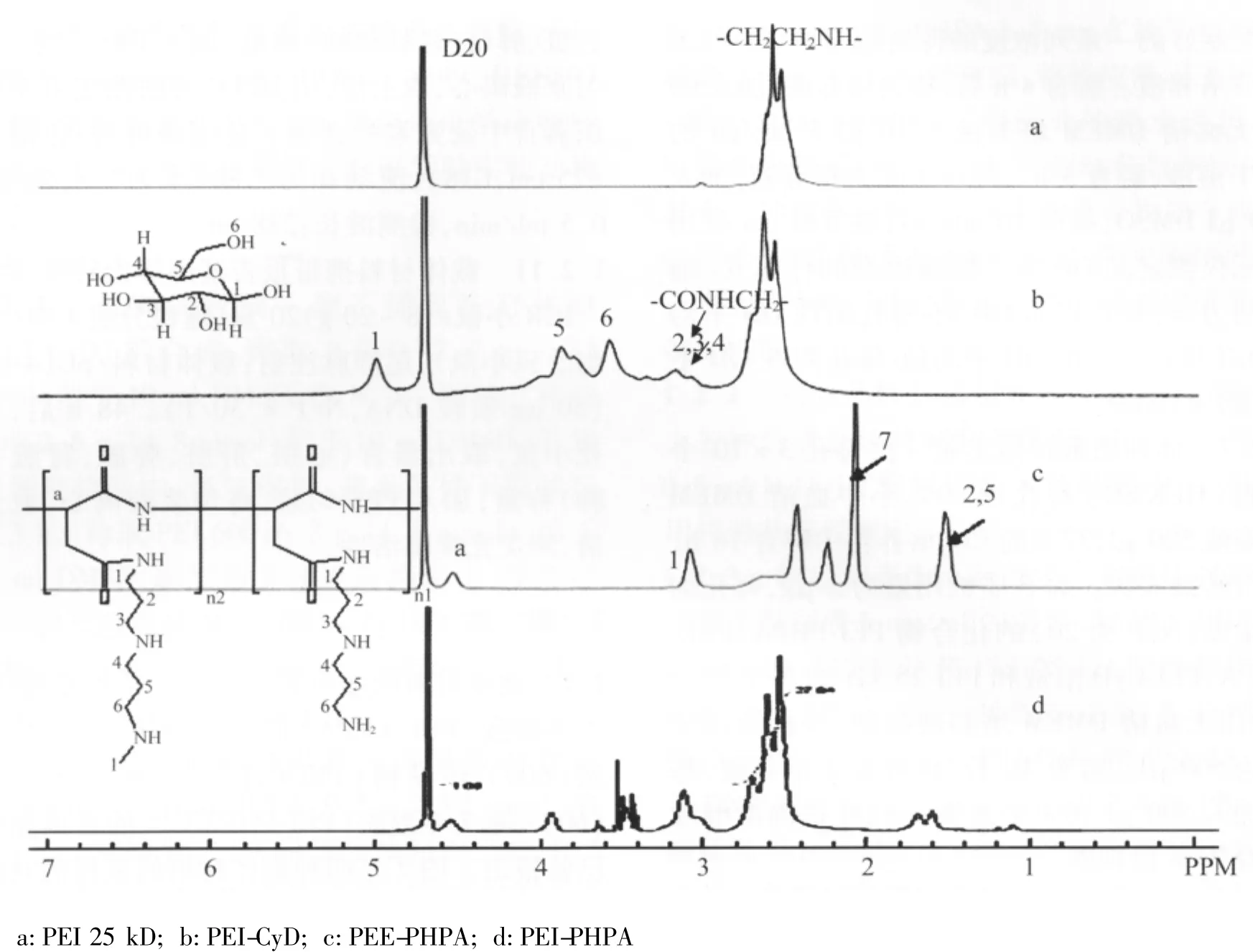
图2 PEI 25 kD、PEI-CyD、PEE-PHPA和PEI-PHPA的1H核磁共振谱图Fig.2 1 HMNR spectra of PEI 25 kD,PEI-CyD,PEE-PHPA,PHPA-PEI
表1是用凝胶色谱(GPC)测定的PEI 25 kD、PEI-CyD、PEE-PHPA和PEI-PHPA四种聚阳离子载体材料的分子量、粒径和表面电荷值。由表所知四种载体材料的分子量在30~40 kD。

表1 PEI 25 kD、PEI-CyD、PEE-PHPA、PEIPHPA四种载体材料的性质Table 1 Characteristics of cationic polymers PEI 25 kD,PEI-CyD,PEE-PHPA and PEI-PHPA
在粒径和表面电荷的测定中PEI 25 kD是其与 DNA的 N/P比例为10测定,PEI-CyD、PEE-PHPA和PEI-PHPA三种聚阳离子载体材料是其与DNA的N/P比例为30时测得。
图3是PEI 25 kD、PEI-CyD、PEE-PHPA 和PEI-PHPA四种聚阳离子载体材料的凝胶电泳阻滞实验及PEI-PHPA/DNA微粒在30:1时的粒径分布和表面电荷分布曲线。由图3a所示,四种聚阳离子载体材料均可以很好的绑定DNA。图中0~5泳道所对应的聚阳离子载体/pDNA 的 N/P 比值分别是 0,1∶1,2∶1,3∶1,4∶1,5∶1。从图中可得,PHPA-PEI、PEI-CyD、PEE-PHPA和PEI 25 kD分别在N/P比值为4∶1、1∶1、3∶1和3∶1时完全阻滞 DNA 的迁移。图3b、3c分别为PEI-PHPA载体材料的粒径和表面电荷的曲线,曲线分布呈正态分布,在PEI-PHPA/DNA为30∶1时,其粒径约为220 nm,zeta电位值约为32 mV,较适宜于细胞的吞噬及体内外基因的转染。
2.2 载体材料的体外细胞学研究结果 图4是 PEI 25 kD、PEI-CyD、PEE-PHPA 和 PEI-PHPA四种载体材料在 COS-7、A549、C6和HEK293细胞株上的毒性实验结果。由图可知,PEE-PHPA和PEI 25 kD的细胞毒性较大,其中PEE-PHPA在C6、COS-7、A549和HEK293细胞上的 IC50 值分别为 21.5、20.2、7.30 和37.1 μg/ml,PEI 25 kD 的 IC50 值分别为15.8、18.3、11.4 和 36.7 μg/ml。PEI-CyD 和 PEI-PHPA细胞毒性相对较小,在实验所测定的浓度范围中,细胞的存活率高于60%。
图5是PEI 25 kD、PEI-CyD、PEE-PHPA 和PEI-PHPA四种载体材料携带pEGFP质粒在HEK293细胞上的转染照片。PEI-PHPA、PEE-PHPA、PEI-CyD与pEGFP质粒按最佳N/P比30形成的复合物,PEI 25 kD与DNA的比例为10。从图中可看出,四种载体材料在HEK293细胞上均有较好的转染效率。
2.3 体内急性毒性实验结果 表2为PEI-CyD、PEE-PHPA、PEI-PHPA 和 PEI 25 kD 四种载体材料在ICR小鼠上的急性毒性实验结果,载体材料经配制成一定浓度后,经腹腔注射,连续观察14天,观测小鼠体重、毛色及死亡情况等并计算LD50结果。
从表2中可知PEI 25 Da和PEI600材料的腹腔注射的急性毒性值均小于50 mg/kg,为中等毒性,而PEI-PHPA和PEE-PHPA材料的腹腔注射的急性毒性值超过500 mg/kg,为低毒材料。PEI-CyD材料介于其中。

图4 PEI-CyD、PEE-PHPA、PEI-PHPA 和 PEI 25 kD 四种材料在 COS-7、A549、HEK293、C6 细胞上的毒性实验Fig.4 Cytotoxicity assay of PEI-CyD,PEE-PHPA,PEI-PHPA and PEI 25 kD in COS-7,A549,HEK293 and C6 cell lines
2.4 载体材料生化指标检测结果 图6是PEI 25 kD、PEI-CyD、PEE-PHPA 和 PEI-PHPA四种聚阳离子载体材料经腹腔注射于ICR小鼠48 h后,对其生化指标的检测的检测结果,其中前7幅是肝组织的生化指标,主要有总蛋白(TP)、白蛋白(ALB)、球蛋白(GLB)、白球比值(A/G)、总胆红素(TBIL)、丙谷转氨酶(ALT)和谷草转氨酶(AST)的含量变化。由图可知四种材料的肝指标中的总蛋白、白蛋白、球蛋白和白球比值变化不明显,与对照组相比丙氨酸转氨酶和谷草转氨酶的指标有一定程度升高,表明存在进行性的肝坏死,其中以PEI-CyD和PEE-HPHA的值变化较大,表明其对肝组织有一定的损伤。最后2幅为肾脏的检测指标,主要检测肌酐(CRE)和尿素氮(BUN)的指标变化。
2.5 病理切片分析 图7是PEI 25 kD、PEI-CyD、PEE-PHPA和PEI-PHPA四种载体材料经过腹腔注射后肝、肾和心脏组织的病理切片照片。由病理切片发现,注射PEE-PHPA材料的组织切片中,肝出现单个肝细胞坏死和形成双核及多核肝细胞,但心脏和肾未见明显病变,证明PEE-PHPA材料对肝脏有一定的的毒性;注射PEI-PHPA材料的组织切片中发现,在动物的肝脏出现部分炎症,中央静脉周围肝细胞空泡变性,但心脏和肾未见明显病变,表明其对肝有一定毒性,但是比PEE-PHPA影响小;注射PEI-CyD材料的组织切片中发现,肾小管上皮细胞水肿,肝和心脏未见明显病变,证明它对肾脏有一定的影响,但对肝脏几乎无毒。而注射PEI 25 kD的材料在本次试验中对肝、肾和心脏所引起的影响较小。
2.6 载体材料体内分布测定结果 表3是PEE-PHPA、PEI-PHPA、PEI-CyD 和 PEI 25 kD四种载体材料接入荧光素钠后,尾静脉注射载体材料,给药48 h后对其肝肾、胰、心脏和肺组织的载体材料分布结果。荧光素钠用高效液相色谱进行检测。从结果来看PEI 25 kD在肺部的浓度较大,从动物解剖发现,在肺部出现出血斑点及凝聚物,同样的现象在PEE-PHPA的实验小鼠上也观察到,而PEI-CyD和PEI-PHPA材料则在肾和胰组织中浓度较大。
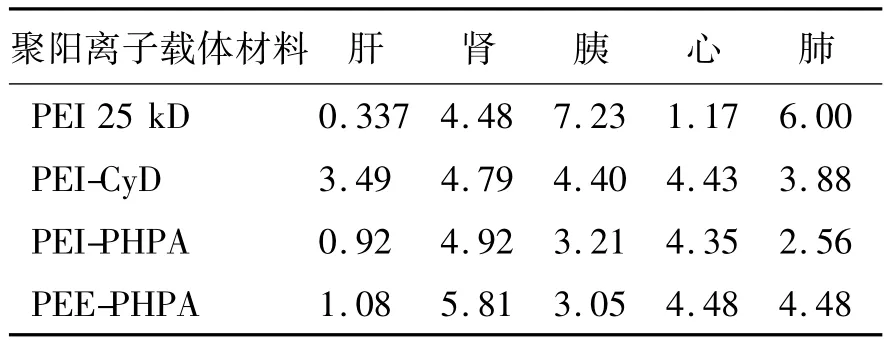
表3 PEE-PHPA、PEI-PHPA、PEI-CyD 和 PEI 25 kD载体材料的在ICR小鼠的体内分布结果(μg/mg组织)Table 3 Distribution of PEE-PHPA,PEI-PHPA,PEI-CyD and PEI 25 kD in vivo

图7 PEE-PHPA、PEI-PHPA、PEI-CyD和PEI 25 kD四种材料在体内的病理切片Fig.7 Tissue slice of PEE-PHPA,PEI-PHPA,PEI-CyD and PEI 25 kD
2.7 载体材料携带报告基因体内转染实验结果 图8为 PEE-PHPA、PEI-PHPA、PEI-CyD 和PEI 25 kD四种载体材料携带PGL4-luc报告基因经过尾静脉注射在小鼠体内48 h后的实验结果。由图8可知,四种载体材料携带报告基因在肝、心脏、脾、肾、肺均有一定表达,从浓度上看PEE-PHPA在脾脏表达较多,PEI-CyD在肝和心脏的表达较高。

图8 PEE-PHPA、PEI-PHPA、PEI-CyD 和 PEI 25 kD携带质粒pGL-4在体内转染结果Fig.8 The transfection efficiency of cationic polymers/pGL-4 in vivo
3 讨论
以分子量为25 kD的聚乙烯亚胺是聚阳离子材料的典型,也是研究较多的非病毒基因药物载体,其特点是转染效率与分子量相关,分子量越大,转染效率也高,但是毒性也大。聚乙烯亚胺结构中的三种氨基的比例是缓冲效果能力强、转染效率高的重要因素,其结构中的一级、二级和三级胺的比例为1∶2∶1,可以在两种PH环境中形成较大的缓冲能力,所以在细胞的胞浆中可以发挥“海绵质子效应”。但是,聚乙烯亚胺最大的问题是非生物降解性及较高的阳离子电荷,因此,阻碍了其进一步的广泛使用。已经有多个研究小组对其结构进行改性,低分子量的聚乙烯亚胺转染效率低,但毒性也低且易于被生物代谢,因此,研究者用各种方法将低分子量的聚乙烯亚胺进行交联,增加分子量,提高转染效率,同时保持较低的细胞毒性。在本研究中用环糊精与低分子量的聚乙烯亚胺交联制成PEI-CyD载体材料,用聚天冬酰胺为母体,用低分子量的聚乙烯亚胺作为侧基制成PEI-PHPA载体材料,均具有较好的基因转染效率,同时细胞毒性也较低。在此基础上,课题组首次用模拟聚乙烯亚胺的氨基比例的方法,以聚天冬酰胺为母体,侧基用不同比例的烷基胺键合制成新型的聚阳离子载体材料PEE-PHPA。研究用1H核磁共振法对所设计合成的载体材料进行了结构表征,在PEI-CyD结构中,经核磁共振谱中质子峰的计算,聚乙烯亚胺与环糊精的摩尔比为1∶1,故为一线性结构聚合物;在PEI-PHPA结构中,根据核磁共振计算在PEIPHPA结构中,每10个聚氨基酸单元结构中接入4个PEI。在PEE-PHPA聚合物中,根据核磁共振和元素分析(数据未报导),其-N=,-NH-,NH2三种结构的胺基的比例近似为1∶2∶1,与聚乙烯亚胺中胺基的比例非常接近,为形成良好的“质子缓冲效应”提供了可能。
研究对四种聚阳离子载体材料的体外生物学性质进行了表征,表明它们在结合DNA能力及基因转效率上均表现出较好的性能。在细胞毒性实验中PEI-CyD和PEI-PHPA的毒性较低,但PEE-PHPA的细胞毒性几乎与PEI 25 kD相近,这与PEE-PHPA结构中表面氨基较多有关。
在体内动物学实验中,通过腹腔注射后血项指标和组织的病理切片观察,四种载体材料对肝指标的影响,包括总蛋白、白蛋白、球蛋白和白球比值变化不明显,但是在丙氨酸转氨酶和谷草转氨酶的指标上与对照组相比有一定程度升高,表明存在进行性的肝坏死,其中以PEE-HPHA的值变化较大,表明其对肝组织有一定的损伤。在肾功能指标中,PEE-PHPA载体材料所引起的肌酐和尿素氮的变化最明显。在载体材料的急性毒性实验中发现,聚乙烯亚胺(分子量为25kD和600)均表现为一定的毒性LD50值低于50 mg/kg,为中毒化合物。低分子量的聚乙烯亚胺偶合于环糊精上后,毒性有所降低。以聚天冬氨酸为母体的载体材料其毒性均比上述三种材料要低,PEI-PHPA和PEE-PHPA的LD50值均高于500 mg/kg,为低毒性化合物,PEE-PHPA聚合物在细胞学实验和血项指标中均显示毒性,但LD50值却较大,在用荧光素钠标记的载体材料体内分布实验中也发现PEE-PHPA的含量较其他器官要高(5.81μg/mg组织),我们认为这与其可生物降解有关,在相关的降解实验中发现(数据未报导),其能较快地被降解代谢,这在血项分析中肾指标变化较大也得以证实,其代谢过程中阳离子胺基对器官组织的损伤有一定的联系。在载体材料的体内基因转染实验中PEE-PHPA也表现出较好的转染效率,特别是其在心脏的富集较低,主要集中于代谢途径的器官,是一种潜在的药物-基因输送载体,相关的修饰和改性工作在进一步进行中。
4 结论
本研究对 PEI-CyD、PEE-PHPA、PEI-PHPA和PEI 25 kD四种聚阳离子载体材料的化学和生物学特征进行了研究。实验表明,所合成的聚阳离子材料三种聚阳离子载体材料均有较好的体外基因转染能力。在体内研究中三种载体的毒性均低于PEI 25 kD,且能够携带报告基因在体内表达,其中PEI-CyD和PEE-PHPA是具有应用前景的非病毒性基因药物载体。
(病理切片由浙江大学医学院病理实验室朱有法老师完成,急性毒性实验由浙江大学医学院药理实验室唐法娣教授课题组完成,特此致谢。)
[1] PACK D W,HOFFINAN A S,PUN S,et al.Design and development of Polymers for gene delivery[J].Nat Rev Diseov,2005,157(7):581-593.
[2] LI S D,HUANG L.Gene therapy Progress and Prospects: non-viral genetherapy by systemie delivery[J].Gene Ther,2006,13(18):1313-1319.
[3] NIIDOME T,HUANG L.Gene therapy Progress and Prospects:nonviral vectors[J].Gene Ther,2002,9(24):1647-1652.
[4] CROSS D,BURMESTER J K.Gene therapy for cancer treatment:past,Present and future[J].Clin Med Res,2006,4(3):218-227.
[5] MITROVIE T,RADULOVIC S.Gene therapy of cancer[J].J Buon,2005,10(2):167-173.
[6] WITLOX M A,LAMFERSM L,WUISMAN P L,et al.Evolving gene therapy approaches forosteo-sarcoma using viral vectors:Rview [J].Bone,2007,40(4):797-812.
[7] ZHANG S,XU Y,WANG B,et al.Cationic compounds used in lipoplexes and polyplexes for gene delivery [J].J Control Release,2004,100:165-180.
[8] IN-KYU P,HORST A,JIANG S Y,et al.Supramolecular Assembly of Cyclodextrin-Based Nanoparticles on Solid Surfaces for Gene Delivery[J].Langmuir,2006,22:8478-8484.
[9] TANG G P,GUO H Y,ALEXIS F,et al.Low molecular weight polyethylenimines linked byβcyclodextrin for gene transfer into the nervous system [J].J Gene Med,2006,8:736-742.
[10] KANG H S,KIM J-D,HAN S-H,et al.Selfaggregations of poly(2-hydroxyethyl aspartamide)copolymers loaded with methotrexate by physical and chemical entrapments [J].J Control Release,2002,81:135-144.
[11] TANG G P,GUO H Y,ALEXIS F,et al.Low molecularweight polyethylenimines linked by betacyclodextrin for gene transfer into the nervous system [J].J Gene Med,2006;8:736-744.
[12] WANG J L,TANG G P,SHEN J,et al.A gene nanocomplex conjugated with monoclonal antibodies for targeted therapy of hepatocellular carcinoma [J].Biomaterials,2012,33(18):4597-4607.
Characteristics of cationic polymers PEI-CyD,PEI-PHPA,PEE-PHPA and PEI25kD in vitro and in vivo
YAO Qi,JIN Xue,HU Tian-nan,WANG Qi-wen,WANG Xun-shi,HU Qi-da,XU Sang,ZHOU Jun,TANG Gu-ping
(Institute of Chemical Biology and Pharmaceutical Chemistry,Zhejiang University,Hangzhou 310028,China)
Objective:To study the charicteristics of cationic polymers polyethylenimine-β-cyclodextrin(PEI-CyD),polyethylenimine-poly-(3-hydroxypropyl)-aspartamide(PEI-PHPA),N,N-Dimethyldipropylenetriamine-Bis(3-aminopropyl)amine-aspartamide(PEE-PHPA)in vitro and in vivo.Methods:PEI-PHPA,PEI-CyD and PEE-PHPA were synthesized and the chemistry structure of PEI-PHPA,PEI-CyD and PEE-PHPA was confirmed by1H-NMR.The particle size and zeta potential of these polymers were measured,and capacity of plasmid DNA condensation was tested.The inhibition of COS-7,A549,HEK293 and C6 cells was measured by MTT assay.The transfection efficiency was determined in HEK293 cell lines.The toxicity,tissue distribution and transfection efficiency of cationic polymers were tested in vivo.Results:When the N/Pof polymers/DNA at 30,the particle sizes were close 250 nm and the zeta-potential were near 35 mv.They were able to condense DNA at N/P ratio < 5.The MTT assay showed that the IC50of PEE-PHPA was 21.5,20.2,7.30 and 37.1 μg/ml,and that of PEI25kD was 15.8,18.3,11.4 and 36.7 μg/ml in C6,COS-7,A549 and HEK293cell lines,respectively.The cell viability of PEI-CyD and PEI-PHPA in above cell lines was over 60%.They had high transfection efficiency in HEK293 cell lines.The LD50of PEI25Kd,PEI-CyD,PEI-PHPA and PEE-PHPA in vivo was 19.50,100.4,521.2 and 630.0,respectively by intraperitoneal(ip)injection.The contractions of these polymers were higher in kidney than in other organs and tissues.PEE-PHPA had slight effect on kidney and liver function.Conclusion:PEE and PEI25kD have higher transfection efficiency and higher toxicity;while PC and PHPA-PEI have lower toxicity and higher transfection efficiency to be used as non-viral gene vector.
Cations;Polymers;Genetic vectors;Cyclodextrin/chemistry;Polyethyleneimine/chemitry;Polycation;In vitro;In vivo
R 730.54
A
1008-9292(2012)06-0620-11
http:∥www.journals.zju.edu.cn/med
10.3785/j.issn.1008-9292.2012.06.004
2012-09-07
2012-10-08
国家自然科学基金项目资助项目(30970711,21074111).
姚 祺(1989-),女,硕士研究生,研究方向:化学生物学.
汤谷平(1961-),男,博士,教授,博士生导师,主要从事生物材料、药物的控制释放和基因治疗等;E-mail:tangguping@zju.edu.cn
[责任编辑 张荣连]
