主客体组装的金刚烷甲酸-阿霉素/聚阳离子材料及体外抗肿瘤活性的研究
2012-01-23李永斌胡天楠王启闻胡奇达胡秀荣汤谷平
李永斌,王 凯,胡天楠,王启闻,胡奇达,周 峻,胡秀荣,汤谷平
主客体组装的金刚烷甲酸-阿霉素/聚阳离子材料及体外抗肿瘤活性的研究
李永斌1,王 凯1,胡天楠1,王启闻1,胡奇达1,周 峻1,胡秀荣2,汤谷平1
(1.浙江大学化学生物和药物研究所,浙江杭州310028;2.浙江大学化学系分析测试中心,浙江杭州310028)
目的:合成以金刚烷甲酸阿霉素(Ada-Dox)为客体,聚乙烯亚胺PEI600-γ-羟丙基环糊精(γ-hy-PC)为主体的超分子纳米材料,观察其理化特性和转基因功能。方法:通过主客体相互作用将Ada-Dox组装到 γ-hy-PC材料上,制成 γ-hy-PC/Ada-Dox的载药纳米粒子。用1H-NMR、NOESY、UV-Vis、XRD、TGA对其结构进行表征,粒径和电势的测定和凝胶电泳阻滞实验观察其浓缩质粒DNA的能力,在人肝癌细胞BEL-7402和SMMC-7721细胞上对载体材料的细胞毒性进行评价,并进行细胞迁移和细胞形态学鉴定实验,在HEK293细胞上进行体外转染实验以及在BEL-7402细胞上进行细胞吞噬实验。结果:1H-NMR、NOESY、UV-Vis、XRD、TGA证实成功地合成了γ-hy-PC/Ada-Dox复合物;UV-Vis测得其载药量分别是0.5%和5.5%;载药量0.5%和5.5%的γ-hy-PC/Ada-Dox分别在N/P为3和4时可以浓缩质粒DNA;MTT实验结果显示材料的毒性均低于PEI 25 kDa;细胞迁移与H/E染色实验表明合成的材料都有一定的抗肿瘤活性;体外转染实验显示,γ-hy-PC具有较高的转染效率,且随着载药量的增加,转染效率逐渐降低;细胞吞噬实验结果表明γ-hy-PC/Ada-Dox可同时携带药物和FAM-siRNA进入细胞。结论:成功地合成了γ-hy-PC/Ada-Dox复合物,并表现出一定基因转染效率和抗肿瘤活性。
多柔比星/类似物和衍生物;多柔比星/药理学;抗肿瘤药/药理学;γ-羟丙基环糊精;聚乙烯亚胺;阿霉素;纳米粒载体
[JZhejiang Univ(Medical Sci),2012,41(6):599-609.]
非病毒性基因药物载体的研究是目前药物载体领域的一个重要方向,研制安全有效的药物、基因输送体系将有效地提高药物的输送效率,达到治愈疾病的目的[1-4]。主客体组装的药物输送体系是一种新颖的给药系统,它具有提高药物的载药量,并依据药物的亲疏水性质及有效血药浓度,调控药物载量等特点[5-6]。何斌等将α-环糊精(α-CD)穿入肉桂酸改性的PEG分子链形成包含复合物,通过超分子自组装成为纳米粒子,将抗肿瘤药物阿霉素负载到纳米粒子中,研究药物释放行为及其对肿瘤细胞的抑制效果[7]。李姝静等合成了环糊精二聚体(trans-Azoβ-CD Dimer)及侧链含金刚烷(Ad)的聚丙烯酰胺(PAM-Ad),利用trans-Azoβ-CD Dimer与PAM-Ad侧链的Ad基团的主客体识别作用构筑了一类超分子体系[8]。胡奇达等以小分子的聚乙烯亚胺作为桥联偶合β-环糊精制成主体材料,金刚烷连接阿霉素为客体材料,制备了主客体组装的载药体系[9]。我们研究发现,主客体组装的药物基因输送体系,以弱的分子间作用力联接主客体材料,并可以荷载小分子药物和基因药物,依据所需的有效治疗浓度,控制药物的载药量,调控药物和基因的释放顺序。在本研究中,以分子量为600 Da的聚乙烯亚胺为桥联偶合 γ-羟丙基-环糊精(γ-hy-cyclodentrin)制成具有规整、交替结构的聚合物主体材料,用金刚烷甲酸修饰抗肿瘤药物制成客体材料,经分子间的相互作用组装成具有主客体结构的超分子药物输送体系。对主客体药物输送体系进行了化学、生物物理学、细胞学等性质的表征,结果表明该药物-基因输送系统具有良好的载药性能,为进一步深入研究提供了可能。
1 材料与方法
1.1 材料 γ-羟丙基-环糊精(2-(Hydroxypropyl)-γ-Cyclodextrin),购自阿拉丁;1-金刚烷甲酸(1-Adamantanecarboxylic acid),聚乙烯亚胺(polythylenimine,PEI,分子量分别为 25kDa与 600Da),N,N'-羰 基 二 咪 唑 (N,N'
-carbonyldiimidazole,CDI,分子量:162.15),甲基噻唑基四唑(methyl thiazolyl-tetrazolium,MTT)均购自 Sigma-Aldrich公司;苏木精(Hematoxylin)购自南京建成生物工程研究所;伊红(Eosin)购自上海三爱思试剂有限公司;编码萤火虫荧光素酶(PGL-4)报告基因,荧光素酶检测试剂盒购于 Promega公司。HEK293、BEL-7402、BEL-7404和 SMMC-7721细胞系由浙江大学医学院免疫学研究所提供。其它试剂均为分析纯。
1.2 材料的合成
1.2.1 Ada-Dox的合成 取金刚烷甲酸0.0393 g(0.2183 mmol) 溶于 1 ml DMSO 中,加到 25 ml圆底烧瓶中,取 N,N-羰基咪唑(CDI)0.0477g(0.2942 mmol) 溶 于 1 ml DMSO加到上述溶液中,滴加时间5 min以上,加0.2 ml三乙胺(Et3N)作催化剂,室温、避光、氮气保护下搅拌 2.5 h。取 0.111 g阿霉素(0.2044 mmol)于2 ml DMSO中,逐滴加入到上述反应液中,滴加时间20 min以上,反应过夜,反应液用干燥活化的硅胶板展开分离,展开剂为异丙醇∶氯仿=1∶1,经提纯后制得产物。
1.2.2 γ-hy-PC 的合成 取 1.622 g(1.027 mmol)2-羟丙基-γ-环糊精(γ-hy-CyD) 于10 ml DMSO中,加到100 ml圆底烧瓶中,取1.70 g(10.50 mmol)CDI溶于10 ml DMSO加到上述溶液中,加0.2 ml三乙胺(Et3N)作催化剂,室温、避光、氮气保护下搅拌 5 h。取 5.56 g(9.269 mmol)PEI 600 Da 于10 ml DMSO 中,逐滴加入到上述反应液中,继续反应12 h。将反应产物置于分子量为8 000~14 000的透析袋中,流水透析48 h,冰冻干燥,得到白色絮状固体产物。
1.2.3 γ-hy-PC/Ada-Dox的合成 将上述反应的Ada-Dox 1.5 ml加入到15 ml PBS缓冲溶液中,搅拌30 min以除去过量的 CDI。称取0.3393 g(0.2150 mmol) γ-hy-PC 于 8 ml PBS缓冲溶液中,将该溶液加入到上述溶液中,搅拌过夜。然后将反应产物置于分子量为8 000~14 000的透析袋中,流水透析48 h,冰冻干燥,得到紫红色絮状固体产物。
1.3 材料的理化表征
1.3.1 核磁共振氢谱(1H-NMR)分析 将5 mg样品溶于0.5 ml D2O或DMSO-d6中。室温下用Bruker Avance400DMX核磁共振光谱仪(Bruker公司,德国)测定。
1.3.2 核欧佛豪瑟效应频谱(NOESY spectrum) 取20 mgγ-hy-PC/Ada-Dox超分子聚合物,溶于1 ml D2O中,室温下用 Bruker Avance 400DMX核磁共振光谱仪(Bruker公司,德国)测定。
1.3.3 紫外-可见光谱(UV-Vis) 将Dox和γ-hy-PC/Ada-Dox配成一定的浓度,以紫外分光光度仪在250~700 nm波长范围内进行扫描,观察紫外吸收光谱变化并确定最大吸收波长。将Dox配成一系列不同浓度的溶液,在最大吸收波长出测定吸光度,制得标准曲线。将γ-hy-PC/Ada-Dox配成一定浓度的溶液,测定其吸光度,根据标准曲线,计算Dox的载药量。
(2)转换层设计斜柱,安装质量控制要求高:由于建筑布置要求,周边型钢混凝土柱 2 F 楼面标高开始逐层向外倾斜,到 4 F 楼面标高恢复直立状态,外围型钢柱呈向内折线形,吊运安装质量控制要求高。
1.3.4 X-射线粉末衍射(XRD) 样品(100 mg左右)研磨成粉状,多晶衍射仪 D/Max22550Pc(日本理学)测定。
1.3.5 热重分析(TGA) 称取3~4 mg干燥的样品,用SDTQ600综合热分析仪(美国TA公司)对样品进行热失重分析。温度从30℃升至700℃,升温速率为10℃/min,N2保护,流速120 ml/min。
1.3.6 粒径与zeta电位测定(Particle size and Zeta potential) 将材料与pDNA按照适宜的N/P 比值(N/P=10、20、30、40) 配制溶液,其中DNA取1μg,最后稀释至1 ml水溶液,在Mastersizer-2000型激光衍射粒度分析仪上测定粒径。
1.4 凝胶电泳阻滞实验 将材料与pDNA按照适宜的 N/P 比值(N/P=0、1、2、3、4、5) 配制溶液,其中DNA取1μg,加入到1%琼脂糖凝胶孔中,在1×TAE缓冲液中80V、电泳 45 min。电泳结束后,在JS-380A自动凝胶图像分析仪上测定载体材料阻滞DNA的位置。
1.5 细胞毒性实验 将人肝癌细胞BEL-7402和SMMC-7721细胞分别接种于96孔板上,10 000细胞/孔,37℃、5%CO2培养箱孵育 16 h。吸去培养液,加入 N/P分别为 10、20、30、40、50、60 的材料溶液200 μl,3 复孔,孵育4 h,吸去培养液,加入含有10μl MTT(5 mg/ml)的无血清培养液100μl,孵育4 h后翻板弃去培养液,每孔加入100μl DMSO,在570 nm波长下测定OD值,计算细胞活力。
1.6 细胞迁移实验(细胞划痕法) 将HEK293和 BEL-7404细胞(3×105个/孔,500 μl/孔)接种于6孔板上,37℃孵育16 h。移去培养液,用10μl的移液器枪头呈“一”划痕,然后用PBS洗2遍,加入N/P为30的材料和DNA的混合溶液500μl,其中DNA取1μg,于37℃孵育4 h,移去药液,用PBS清洗,再分别加入含10%小牛血清的DMEM和RPMI1640培养液,分别于0 h、24 h、48 h 观察。
1.7 H/E染色 将BEL-7402细胞(1×105个/孔,1 ml/孔)接种于12孔板上,37℃孵育16 h。移去培养液,然后用PBS洗2遍,加入N/P为30的材料和DNA的混合溶液1 ml,其中DNA取1μg,于37℃孵育12 h。移去药液,用PBS清洗,加入500μl 5%甲醛溶液固定10 min,吸出并用PBS清洗。每孔加入500μl苏木精染料,振荡40~60 min,吸出苏木精染料并用PBS清洗直到PBS中无蓝色为止,然后每孔加入300μl伊红染料,约30 s后吸出并用PBS清洗直到PBS中无橘黄色为止,在倒置荧光显微镜下观察。
1.8 体外细胞转染 将HEK293细胞按2×104个/孔铺于48孔板上,37℃孵育16 h。将载体 材 料 PEI600、γ-hy-PC、γ-hy-PC/Ada-Dox(0.5%)、γ-hy-PC/Ada-Dox(5.5%)与PGL-4(1 μg)按照 N/P=15、20、25、30、35,PEI 25 kD 与PGL-4质粒(1μg)按照N/P=10比值混合,静置30 min后加入各孔,每种N/P三复孔。在37℃、5%CO2培养箱中转染4 h,去掉培养液,加入含10%小牛血清DMEM培养液,培养36 h后,PBS洗涤细胞一次,采用反复冻融法使细胞破裂。采用Promega公司的荧光素酶检测试剂盒测定荧光素酶活性,采用BCA试剂盒检测总蛋白量。最后用“相对荧光单位/mg蛋白”(RLU/mg protein)表示转染效率。将HEK293细胞按5×104个/孔铺于24孔板上,37℃孵育16 h。将载体材料 γ-hy-PC、γ-hy-PC/Ada-Dox(5.5%)与 pEGFP质粒(1μg)按照 N/P=30混合,静置30 min后加入各孔,在37℃、5%CO2培养箱中转染4 h,去掉培养液,加入含10%小牛血清DMEM培养液,培养36~48 h后,用荧光倒置显微镜观察荧光强度。
2 结果
2.1 材料的合成结果 图1a为聚合物γ-hy-PC的合成路线图,γ-hy-CyD中8位上的羟基,因为空间位阻较小,易于被活化,实验选用N,N-羟基二咪唑(CDI)为活化剂,将其活化后与分子量为600的聚乙烯亚胺反应,制得聚乙烯亚胺-γ-羟丙基-环糊精(PEI600-γ-hy-CyD)。应注意的是,在反应过程中应控制聚乙烯亚胺的滴加速度,以防止溶液的局部过浓导致交联沉淀。图1b为金刚烷-阿霉素的合成路线,金刚烷甲酸中的羧羟基易于活化剂CDI作用,可与阿霉素六元杂环上的氨基反应,形成稳定的酰胺键。图1c为γ-hy-PC/Ada-Dox超分子聚合物的合成示意图,Ada-Dox通过弱的分子间作用力,以主客体形式嵌入γ-hy-PC的疏水性空腔内,形成超分子聚合物 γ-hy-PC/Ada-Dox。本实验中Ada-Dox与γ-hy-PC的比例是按照理论重量比1%和8%进行投料的。
2.2 材料的表征结果 图2是以DMSO-d6为溶剂的阿霉素(Dox)(a)、1-金刚烷甲酸(Ada-COOH)(b)、Ada-Dox化合物(c)以及以D2O为溶剂的 γ-hy-PC(d)、γ-hy-PC/Ada-Dox(e)的核磁共振氢谱。图2a中δ=4.87ppm处为Dox的特征质子吸收峰。图2b中 δ=1.5~2.0 ppm间三个吸收峰为Ada-COOH烷基的特征质子吸收峰。图2c中 δ=1.5~2.0 ppm间和 δ=4.85 ppm等位移处同时具备了Ada-COOH烷基和Dox的特征质子吸收峰,说明形成了新的化合物,即Ada-Dox。此样品通过薄层层析分离得到,说明是单一的物质。图2e中δ=1.6,1.9 ppm 处可见 Ada-COOH 中烷基的特征吸收峰,在δ=1.0 ppm可见γ-hy-PC中未改变的甲基的特征吸收峰,说明客体Ada-Dox已成功通过主客体相互关系与主体γ-hy-PC组装起来,并形成超分子聚合物γ-hy-PC/Ada-Dox。
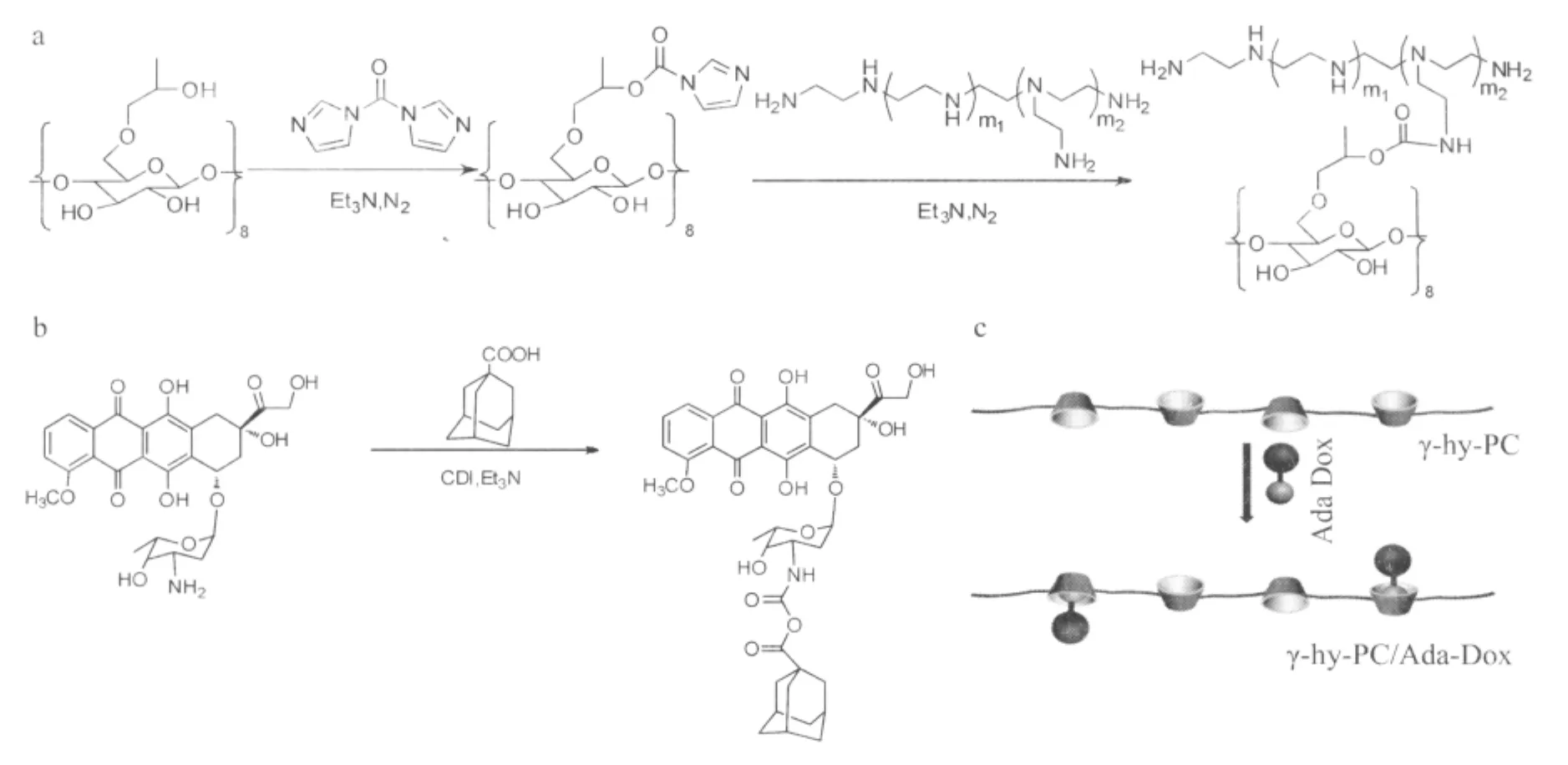
图1 γ-hy-PC/Ada-Dox超分子载体材料的合成路线Fig.1 Synthesis route ofγ-hy-PC/Ada-Dox
图3 a为γ-hy-PC/Ada-Dox的核欧佛豪瑟效应频谱。NOESY的交叉峰表明二个质子之间有足够强的NOE效应,通常二个质子之间的距离不大于5Å时才可能观测到NOE效应。γ-hy-PC/Ada-Dox的核欧佛豪瑟效应频谱中,客体金刚烷甲酸中亚甲基和次甲基的质子信号与主体γ-hy-CyD中的质子信号有很好的关联,说明γ-hy-CyD与Ada-Dox之间存在疏水键结合的主客体相互关系,并已形成超分子化合物。
图3b 为 Dox、γ-hy-CyD、γ-hy-PC 和 γ-hy-PC/Ada-Dox的粉末衍射图谱。从图中可以看出 Dox 为结晶性化合物,在 25.0(°)、17.2(°)、22.5(°)、25.0(°)等处有特征衍射峰;γ-hy-CyD 在 8.8(°)、17.8(°)、20.5(°) 处有三个明显的衍射峰,且峰形较宽,表明γ-hy-CyD为无定形结构;γ-hy-PC和γ-hy-PC/Ada-Dox都只有一个明显的衍射峰,γ-hy-PC/Ada-Dox的衍射峰比 γ-hy-PC的更宽并有所位移,说明Ada-Dox已经嵌入γ-hy-PC主体材料中形成了超分子结构物,其无定型结构更加明显。
图3c 为 Dox、Ada-Dox、γ-hy-CyD、γ-hy-PC和γ-hy-PC/Ada-Dox的热重分析。由图可知Dox的分解温度为 193.7℃ 和 255.5℃,生成Ada-Dox后的分解温度为144.4℃,说明生成物热稳定性较差;γ-hy-CyD的分解温度为292.6℃,而偶联PEI600后,分解温度分别变为238℃,再与Ada-Dox形成主客体材料后,分解温度变为255℃,这些变化说明材料的组分已经发生改变,其稳定性也发生了变化。
图3d为 Dox、γ-hy-PC 和 γ-hy-PC/Ada-Dox的紫外吸收光谱。γ-hy-PC基本无紫外吸收谱带,Dox在480 nm处有吸收峰,Ada-Dox与 γ-hy-PC形成了主客体超分子聚合物后,吸收峰移至508nm,位移向长波长方向移动了28 nm。这与形成超分子结构后,共轭程度增加有关。根据阿霉素的标准吸收曲线(A=14.220C+0.008,R2=0.993)可以计算,所合成的两种 γ-hy-PC/Ada-Dox的载药量分别为 0.5%和5.5%。
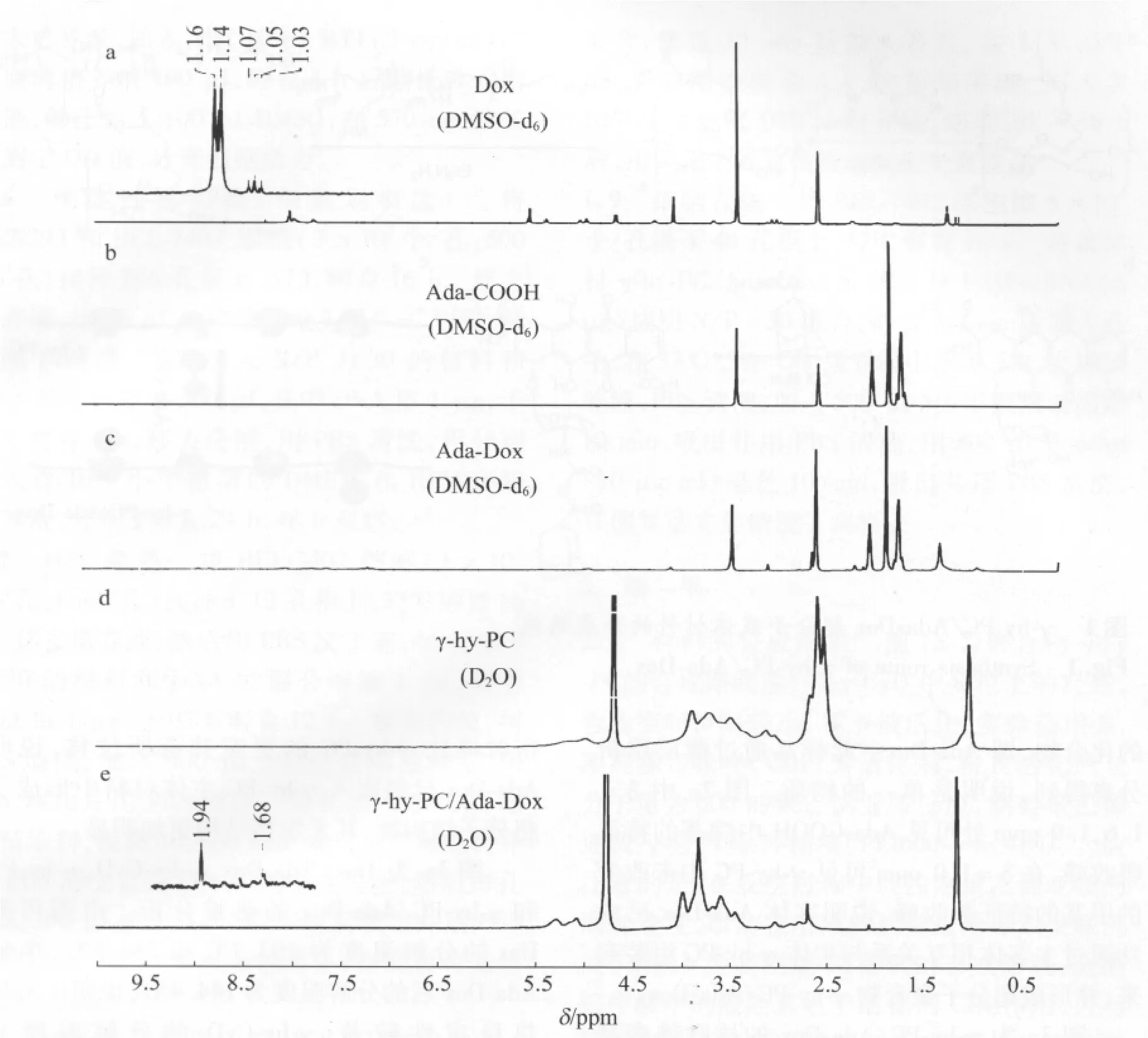
图2 超分子载体材料的核磁共振氢谱表征,其中Dox(a)、Ada-COOH(b)、Ada-Dox(c)、γ-hy-PC(d)和γ-hy-PC/Ada-Dox(e)Fig.2 1H-NMR spectra of Dox(a),Ada-COOH(b),Ada-Dox(c),γ-hy-PC(d)and γ-hy-PC/Ada-Dox(e)
超分子材料和DNA形成的纳米微球的粒径和zeta电势的大小,直接影响着体外转染效率。图4a、b分别为在不同的N/P比下PEI 25 kDa(N/P 为 10)、γ-hy-PC、γ-hy-PC/Ada-Dox(0.5%)和 γ-hy-PC/Ada-Dox(5.5%)的粒径和zeta电势。实验结果表明 γ-hy-PC、γ-hy-PC/Ada-Dox(0.5%)和 γ-hy-PC/Ada-Dox(5.5%)与DNA在N/P为10~40之间的粒径基本维持在100~300 nm之间,γ-hy-PC的粒径均在180 nm 以下,而 γ-hy-PC/Ada-Dox(0.5%)和 γ-hy-PC/Ada-Dox(5.5%)的粒径为 200 nm以上,说明γ-hy-PC与Ada-Dox形成超分子化合物后粒径明显增大,对照组PEI 25 kDa(N/P为10)的粒径则为350nm左右。从测得的zeta电势 结 果 可 知 γ-hy-PC、 γ-hy-PC/Ada-Dox(0.5%)和 γ-hy-PC/Ada-Dox(5.5%) 与 DNA形成的微球在N/P 10~40之间时zeta电势基本为维持在20~40 mV之间,均小于对照组PEI 25 kDa(N/P为10)的zeta电势。
图5 为 γ-hy-PC、γ-hy-PC/Ada-Dox(0.5%)和γ-hy-PC/Ada-Dox(5.5%)与质粒在不同N/P下的凝胶阻滞实验。γ-hy-PC在N/P为2∶1时能完全结合DNA形成稳定的复合物,γ-hy-PC/Ada-Dox(0.5%)在N/P 为3∶1时能完全结合DNA形成稳定的复合物,γ-hy-PC/Ada-Dox(5.5%)在N/P为4∶1时能完全结合DNA形成稳定的复合物。实验结果说明γ-hy-PC上嵌入Ada-Dox量增多,其结合DNA的能力减弱。
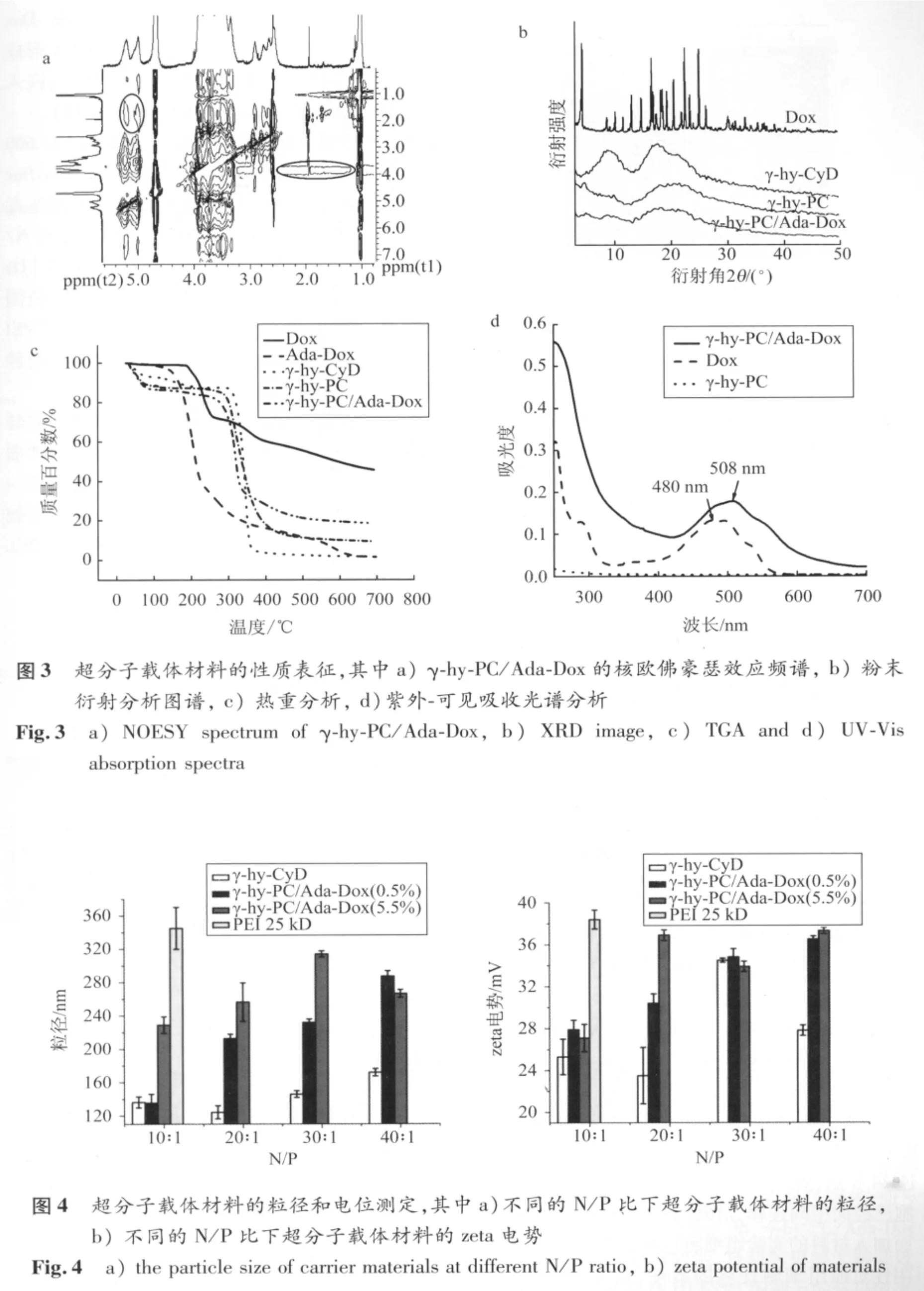
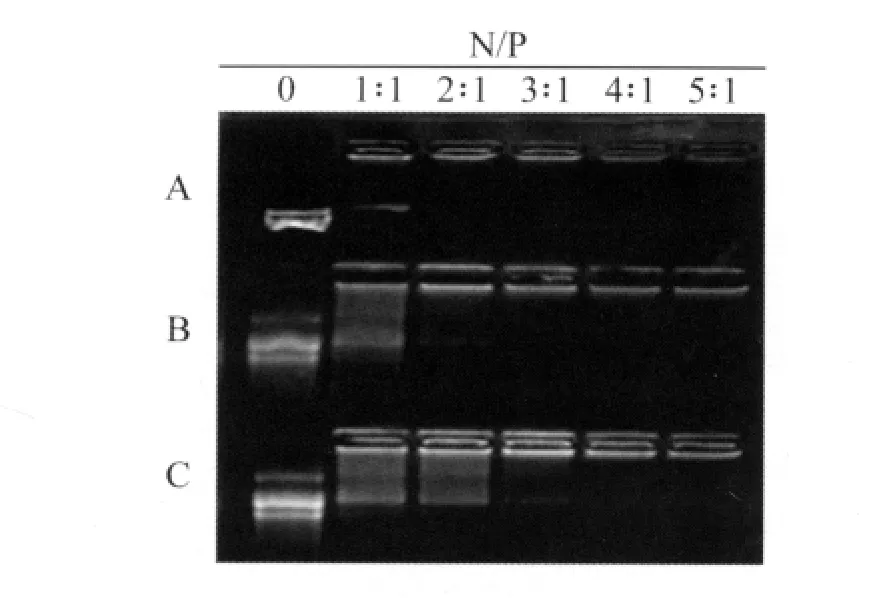
图5 超分子载体材料对质粒DNA的凝胶阻滞实验,A、B、C分别为载体材料γ-hy-PC、γ-hy-PC/Ada-Dox(0.5%)和 γ-hy-PC/Ada-Dox(5.5%)Fig.5 A, B, C mean respectively,electrophoretic mobility shift assay ofγhy-PC/DNA, γ-hy-PC/Ada-Dox(0.5%)/DNA and γ-hy-PC/Ada-Dox(5.5%)/DNA
2.3 体外细胞毒性实验结果 图6为PEI 600 Da、PEI 25 kDa、γ-hy-PC、γ-hy-PC/Ada-Dox(0.5%)和 γ-hy-PC/Ada-Dox(5.5%)的细胞毒性实验结果。从图中可看出,PEI 600 Da在N/P为10~60范围内基本没有毒性,PEI 25 kDa的毒性最大。三种材料在N/P为10~60范围内呈现出一定的毒性,介于PEI 600 Da与PEI 25 kDa之间,在体外转染N/P(30∶1)下,两种细胞的存活率均高于60%。
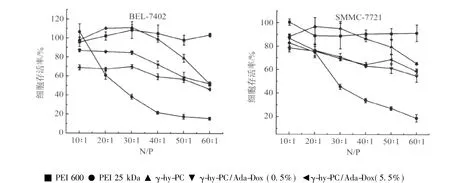
图6 PEI 600 Da、PEI 25 kDa、γ-hy-PC、γ-hy-PC/Ada-Dox(0.5%)和 γ-hy-PC/Ada-Dox(5.5%)的细胞毒性实验Fig.6 Cytotoxicity of PEI 600 Da,PEI 25 kDa,γ-hy-PC,γ-hy-PC/Ada-Dox(0.5%)and γ-hy-PC/Ada-Dox(5.5%)in BEL-7402 and SMMC-7721
2.4 细胞迁移实验结果 迁移是肿瘤细胞转移过程中必不可少的环节,肿瘤细胞与母体瘤分离、穿越血管壁、侵袭周边正常组织均需要一定的运动能力,高转移的肿瘤细胞通常具有较强的运动性。图7 a、b分别为HEK293、BEL-7404细胞的划痕照片;c、d分别为HEK293、BEL-7404细胞在24 h、48 h的细胞迁移率。经过24 h后,在不加任何药物的阴性对照组,细胞已经向中间迁移,清晰的划痕界面变得模糊,而加入材料的实验组细胞迁移的数量明显小于阴性对照组细胞迁移的数量,且γ-hy-PC/Ada-Dox的毒性要大于γ-hy-PC;但48h后γ-hy-PC/Ada-Dox的毒性与γ-hy-PC的差距没有那么明显,说明随着时间的推移,由于材料毒性较高,细胞基本无存活。
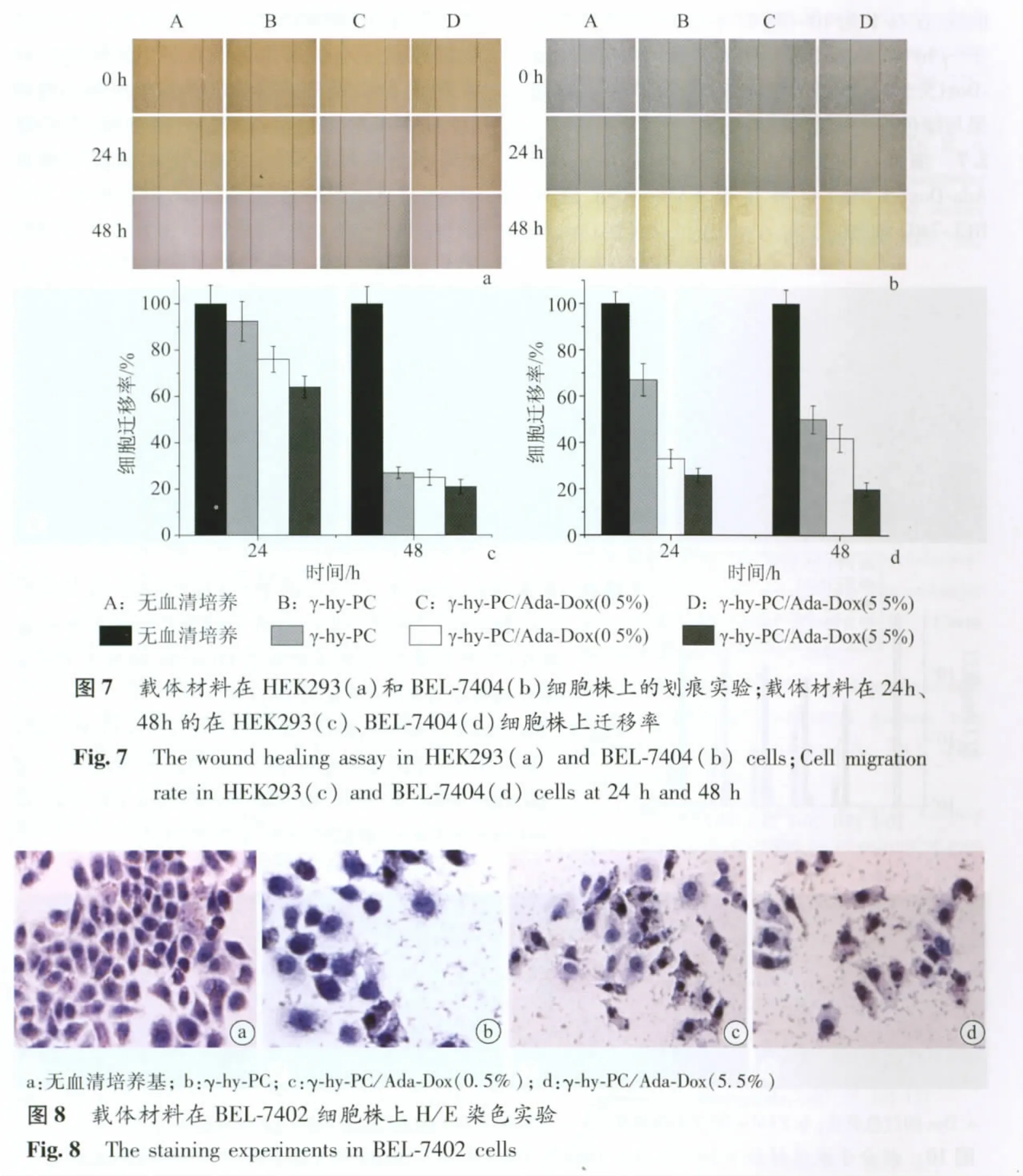
2.5 H/E染色结果 图8为在BEL-7402细胞上H/E染色实验结果。从此实验结果可看出,加入材料的细胞的形态结构发生变化,胞浆明显减少,而且存在大量的细胞裂解物,说明材料对细胞有一定的毒性,且载药量越大使细胞形态改变越大,对细胞的毒性越大。
2.6 体外转染结果 实验以HEK293细胞为研究对象,比较了 γ-hy-PC、γ-hy-PC/Ada-Dox(0.5%)和 γ-hy-PC/Ada-Dox(5.5%)载体材料的体外转染效率,以PEI 600 Da和PEI 25 kDa作为对照组,图 9a、b、c分别是 γ-hy-PC、γ-hy-PC/Ada-Dox(0.5%) 和 γ-hy-PC/Ada-Dox(5.5%)材料在N/P为30时在HEK293细胞上的转染图片。从图中可看出,载体γ-hy-PC的转染效率较高,细胞呈现出较强的绿色荧光,而γ-hy-PC/Ada-Dox(0.5%) 和 γ-hy-PC/Ada-Dox(5.5%)的转染效率较低,且载药量越大转染效率越低。图9d是在HEK293细胞上的转染效率曲线,在N/P为10~35时γ-hy-PC的转染率大于 γ-hy-PC/Ada-Dox(0.5%) 和 γ-hy-PC/Ada-Dox(5.5%),且载药量越高转染效率越低,这结果与绿色荧光的转染结果一致。
2.7 细胞吞噬实验结果 图10是γ-hy-PC/Ada-Dox(5.5%)材料吞噬 FAM-siRNA进入BEL-7402细胞的照片。从图中可以看到Dox,包括结合的和已解离的Dox的红色荧光,基本集中在核周围,表明纳米粒携带的药物被细胞内吞后,随内吞体/溶酶体逐渐向核移动,开始药物释放。FAM-siRNA被材料携带入细胞后,在细胞核周围出现绿色荧光,表明载体材料可携带siRNA进入细胞。

3 讨论
本实验所合成的主客体载体材料γ-hy-PC是一种新型的非病毒载体,在合成γ-hy-PC时,为防止反应产物之间发生交联,需要调控PEI 600 Da的反应量,在本实验中γ-羟丙基环糊精与PEI 600 Da的摩尔比为1∶9,在PEI600滴加过程中需均匀搅拌缓慢滴加。客体材料Ada-Dox的投料量分别按理论值的1%、8%投料,而实际测定值为0.5%和5%,说明在反应过程中有一定的损失。在主客体载体材料的表征中发现,客体的组装比例直接影响整个载体材料的性质。在微粒的粒径方面,非病毒载体缩合DNA后可形成纳米颗粒,其一般为几百纳米,通过内吞途径进入细胞,从粒径测定的结果中可知,客体材料Ada-Dox的组装比例对γ-hy-PC的粒径大小有明显的影响,Ada-Dox的比例增加,微粒的粒径明显增大,5%组装的超分子材料在与DNA结合30∶1时其粒径接近400 nm。在与DNA的结合能力方面,凝胶阻滞电泳结果显示,客体Ada-Dox与主体γ-hy-PC的组装比例提高,聚合物浓缩DNA的能力减小。
从细胞毒性试验显示,载体材料γ-hy-PC、γhy-PC/Ada-Dox(0.5%) 和 γ-hy-PC/Ada-Dox(5.5%)均呈现出一定的毒性,随着载药量的增大,细胞毒性随之增大,同样的结果在细胞划痕和H/E染色实验中得到证明。
在体外转染实验中显示,γ-hy-PC/Ada-Dox的转染效率低于γ-hy-PC,且随着载药量的增大,转染效率降低。我们认为阿霉素起了一定的作用,聚合物中阿霉素含量的增加,抑制pEGEP质粒表达绿色荧光蛋白。细胞吞噬实验表明γ-hy-PC/Ada-Dox(5.5%)可携带具有治疗性的siRNA进入细胞。
综上所述,实验成功合成了γ-hy-PC/Ada-Dox主客体组装的超分子材料,且该材料在药物与基因协同治疗中具有了潜在的应用价值。
[1] MARK E DAVIS.Non-viral gene delivery systems[J].Curr Opin Biotech,2002,13:128-131.
[2] HE CX,TABATA Y.GAO JQ,et al.Non-viral gene delivery carrier and its three-dimensional transfection system[J].Int J of Pharm,2010,386:232-242.
[3] NISHIKAWA M,HASHIDA M.Nonviral approaches satisfying various requirements for effective in vivo gene therapy[J].Biol Pharm Bull,2002,25:275-283.
[4] GAJADHAR B.SUSMITA M.AMARNATH M,et al.DNA encapsulated magnesium and manganous phosphate nanoparticles:potential non-viral vectors for gene delivery[J].Biomaterials,2005,26:2157-2163.
[5] CHEN L,ZHU X Y,YAO Y F,et al.Controlling Polymer Architecture through Host Guest Interactions[J].Angew Chem Int Ed,2006,45:87-90.
[6] ZHANG J X,SUN H L,PETER.X.MA.Host-guest Interactions Mediated Polymeric Assemblies:Multifunctional Nanoparticles for Drug and Gene Delivery[J].ACSNano,2010,4:1049-1059.
[7] LI Y,JI L,HE B,etal.Study on the α-cyclodextrin/poly(ethylene glycol)self-assembly supramolecular nanoparticles for drug delivery[J].Chem Scichina,2010,40(3):247-254.
[8] LI SJ,LIANG H Y,WANG X L.A supramolecular system obtained by cyclodentrin dimmers with adamantly modified polyacrylamide [J].Fine Chemicals,2012,29(6):531-536.
[9] HU Q D,FAN H,TANG G P,et al.Cationic supramolecular nanoparticles for co-delivery of gene and anticancer drug[J].Chem Commun,2011,47:5572-5574.
[10] ZHANG Z Y,UGWU S,ZHANG A,et al.A novel cationic cardiolipin analogue for gene delivery[J].Pharmazie,2006,61(1):10-14.
[11] HUH SH,DO H J,LIM H J,et al.Optimization of 25kD linear polyethylenimine for effieient gene delivery[J].Biologicals,2007,35:165-171.
Synthesis of a supermolecular nanoparticleγ-hy-PC/Ada-Dox and its antitumor activity
LI Yong-bin1,WANG Kai1,HU Tian-nan1,WANG Qi-wen1,HU Qi-da1,ZHOU Jun1,HU Xiu-rong2,TANG Gu-ping1
(1.Institute of Chemical Biology and Pharmaceutical Chemistry,Zhejiang University,Hangzhou 310028,China;2.Center of Analysis and Measurement,Zhejiang University,Hangzhou 310028,China)
Objective: To synthesize a (2-Hydroxypropyl)-γ-cyclodextrin-polyethylenimine/adamantane-conjugated doxorubicin(γ-hy-PC/Ada-Dox)based supramolecular nanoparticle with host-guest interaction and to identify its physicochemical characterizations and antitumor effect.Methods:A novel non-viral gene delivery vector γ-hy-PC/Ada-Dox was synthesized based on host-guest interaction.1H-NMR,NOESY,UV-Vis,XRD and TGA were used to confirm the structure of the vector.The DNA condensing ability of complexes was investigated by particle size,zeta potential and gel retardation assay.Cytotoxicity of complexes was determined by MTT assay in BEL-7402 and SMMC-7721 cells.Cell wound healing assay was performed in HEK293 and BEL-7404 cells.The transfection efficiency was investigated in HEK293 cells.H/E staining and cell uptake assay was performed in BEL-7402 cells.Results:The structure ofγ-hy-PC/Ada-Dox was characterized by1H-NMR,NOESY,UV-Vis,XRD,TGA.The drug loading was 0.5%and 5.5%.Gel retardation assay showed that γ-hy-PC was able to completely condense DNA at N/P ratio of 2;0.5%and 5.5% γ-hy-PC/Ada-Dox was able to completely condense DNA at N/Pratio of 3 and 4,respectively.The cytotoxicity of polymers was lower than that of PEI25KDa.The transfection efficiency ofγ-hy-PC was higher than that ofγ-hy-PC/Ada-Dox at N/P ratio of 30 in HEK293 cells;and the transfection efficiency was decreasing when Ada-Dox loading was increasing.Cell uptake assay showed that γ-hy-PC/Ada-Dox was able to carry drug and FAM-siRNA into cells.Conclusion:The novel vector γ-hy-PC/Ada-Dox has been developed successfully,which has certain transfection efficiency and antitumor activity.
Doxorubicin/analogs& derivatives;Doxorubicin/pharmacology;Antineoplastic drugs/pharmacology;(2-Hydroxypropyl)-γ-cyclodextrin; Polyethyleneimine; Doxorubicin;Nanoparticles carrier
R 730.54
A
1008-9292(2012)06-0599-11
http:∥www.journals.zju.edu.cn/med
10.3785/j.issn.1008-9292.2012.06.002
2012-09-07
2012-10-08
国家自然科学基金资助项目(30970711,21074111).
李永斌(1988-),男,硕士研究生,化学生物学专业.
汤谷平(1961-),男,博士,教授,博士生导师,主要从事生物材料、药物的控制释放和基因治疗等;E-mail:tangguping@zju.edu.cn
[责任编辑 张荣连]
