整合素和钙通道在人与小鼠钩端螺旋体主要宿主细胞上分布的差异
2012-01-23李成学
李成学,赵 欣,钱 景,严 杰
整合素和钙通道在人与小鼠钩端螺旋体主要宿主细胞上分布的差异
李成学,赵 欣,钱 景,严 杰
(浙江大学医学院病原生物系,浙江杭州310058)
目的:了解人和小鼠钩端螺旋体(简称钩体)主要宿主细胞上整合素与钙通道表达情况及其差异。方法:采用免疫荧光和Western blot法,检测人单核细胞株THP-1、小鼠单核-巨噬样细胞株J774A.1、人脐静脉内皮细胞株HUVEC、小鼠血管内皮细胞株EOMA、人肝细胞株L-02、小鼠肝细胞株Hepa1-6、人肾小管上皮细胞株HEK-293、小鼠肾小球系膜上皮细胞株SV40-MES13、小鼠肾成纤维细胞株 NIH/3T3、人及小鼠血小板的 β1、β2、β3 类整合素分子以及 Cav3.1、Cav3.2、Cav3.3、Cav2.3 电压门控型钙通道蛋白和 P2X1、P2X2、P2X3、P2X4、P2X5、P2X6、P2X7受体门控型钙通道蛋白的分布差异。结果:整合素 β1分子表达于 J774A.1、THP-1、HUVEC、EOMA、L-02、Hepa1-6、HEK-239细胞以及人和小鼠血小板膜表面,β2分子表达于 J774A.1、THP-1、HUVEC、EOMA和NIH-3T3 细胞膜表面,β3 分子表达于 J774A.1、THP-1、HUVEC、EOMA、Hepa1-6、HEK-239、NIH-3T3细胞以及人和小鼠血小板膜表面。ATP依赖性受体门控型钙通道蛋白P2X1表达于人和小鼠血小板膜表面,P2X5表达于 J774A.1、THP-1、L-02、Hepa1-6、HEK-239 和 HUVEC 细胞膜表面,但未检测出上述细胞或血小板表达其它钙通道蛋白。结论:不同种类整合素分子和钙通道蛋白在钩体主要宿主细胞上表达明显不同,这可能与钩体对不同组织细胞致病性差异有关。
钩端螺旋体,问号;整合素类/分析;钙通道/分析;内皮细胞/代谢;钩端螺旋体;宿主细胞;整合素;表达
[JZhejiang Univ(Medical Sci),2012,41(4):410-417.]
由致病性钩端螺旋体(简称钩体)感染引起的钩体病是全球流行的人兽共患自然疫源性传染病,我国不少地区也是钩体病流行疫区[1-2]。鼠类是钩体主要宿主动物,感染后一般表现为隐性感染并持续尿液排菌,污染土壤和水源形成疫源地[3]。人感染钩体后均发病且不同器官或组织病变有明显差异,如肝细胞性黄疸、肺弥漫性出血、肾功能衰竭等[2-4]。Patti等首先提出细菌黏附素结合宿主细胞胞外基质(ECM)分子的黏附模式[5]。近年发现钩体可与宿主细胞纤维连接蛋白(FN)、层粘连蛋白(LN)、胶原蛋白(COL)、核心蛋白多糖(DEN)等ECM分子结合而黏附于细胞[6-9]。结合病原体黏附分子的ECM分子可激活整合素家族蛋白,启动相关胞内信号传导[10-12]。Ca2+是细胞第二信使。研究发现,钩体感染的宿主细胞胞内游离 Ca2+水平显著升高[13-14],胞内游离Ca2+水平中度升高以及整合素激活可引起细胞骨架重排,导致病原体以吞噬或内化方式进入细胞,持续高水平Ca2+超载可激活细胞Ca2+依赖性蛋白酶和核酸内切酶,导致细胞坏死或凋亡[13-16]。由于不同物种或同一物种不同细胞表达的整合素及钙通道类型可有差异,不同整合素及钙通道对细胞吞噬病原体及生存状态可有不同影响。本研究检测了钩体主要宿主细胞表达的整合素及钙通道蛋白,以期为深入探讨钩体对不同宿主及细胞致病性差异及其机制奠定基础。
1 材料和方法
1.1 材料
1.1.1 细胞株来源及培养基 人单核细胞株THP-1、小鼠单核-巨噬样细胞株J774A.1、人脐静脉内皮细胞株HUVEC、人肝细胞株L-02、小鼠肝细胞株Hepa1-6、人肾小管上皮细胞株HEK-293、小鼠肾小球系膜上皮细胞株 SV40-MES13、小鼠肾成纤维细胞株NIH/3T3购自中国科学院上海生命科学研究院细胞库,小鼠血管内皮细胞株EOMA购自上海复祥生物科技有限公司。J774A.1、THP-1、HUVEC 细胞培养液为含10%胎牛血清的RPMI-1640(GiBco),SV40-MES13、NIH/3T3、Hepa1-6、HEK293 细胞培养液为含10%胎牛血清的DMEM(GiBco)。
1.1.2 主要试剂 整合素 β1和 β2亚基以及电压门控型钙通道蛋白 Cav3.1和 Cav3.3、Cav2.3抗体购自Abcam公司。整合素β3亚基以及电压门控型钙通道蛋白Cav3.2和受体门控型钙通道蛋白 P2X1、P2X2、P2X3、P2X4、P2X5、P2X6、P2X7购自Santa Crusz公司。各DyLightTM488标记二抗购自Jackson ImmumoResearch公司。RIPA细胞裂解液购自Beyotime公司,细胞膜蛋白和胞浆蛋白提取试剂盒购自KeyGEN公司。
1.2 方法
1.2.1 血小板悬液制备 取20 ml自愿者及BALB/c小鼠外周血,用2%EDTA凝血。各抗凝血900 r/min离心10 min,弃血细胞沉淀。取上清加入2倍体积ACD液(0.82%枸橼酸-2.21%枸橼酸三纳-2.65%葡萄糖溶液,pH 6.5),混匀后900 r/min离心10 min,沉淀悬于5 ml ACD液中即为人及小鼠血小板悬液样品。
1.2.2 细胞悬液制备 THP-1和 J774A.1为悬浮生长细胞,贴壁生长的 HUVEC、EOMA、L-02、Hepa1-6、HEK-293、SV40-MES13 和 NIH/3T3细胞用25 mmol/L EDTA室温消化5 min。各细胞1 000 r/min 4℃离心10 min,细胞沉淀用Hanks液按洗涤并按上法离心,如此重复3次,取细胞沉淀再悬于Hanks液中,调整细胞浓度至0.5 ~1 ×104/ml。
1.2.3 细胞膜蛋白制备 根据细胞膜蛋白和胞浆蛋白提取试剂盒说明书,制备上述9种细胞(1×107)的膜蛋白样品,采用紫外分光光度法测定各膜蛋白样品中蛋白浓度[17]。
1.2.4 免疫荧光法检测整合素 各细胞及各血小板悬液中分别加入整合素β1、β2和β3亚基抗体,37℃孵育 1 h,1 000 r/min离心 10 min。细胞沉淀用 Hanks液、血小板沉淀用ACD液重悬,1 000 r/min离心10 min,如此重复3次。细胞沉淀悬于Hanks液、血小板沉淀悬于ACD液中恢复至原体积,加入荧光标记二抗,37℃孵育1 h。按上法将细胞及血小板洗涤、离心3次后涂片,用荧光显微镜(HBO50/AC型,ZEISS)观察。实验中设置不加一抗的阴性对照及不加任何抗体的空白对照。
1.2.5 Western blot法检测钙通道蛋白 3.5 ml血小板悬液900 r/min离心10 min,取血小板沉淀加入1 ml RIPA裂解液混匀,室温作用5 min,13 000×g 4℃离心5 min,取上清用于钙通道蛋白检测。采用5%浓缩胶、10%分离胶的SDS-PAGE分离细胞膜蛋白样品及血小板蛋白样品,采用湿转膜法(100 V、70 min)将聚丙烯酰胺凝胶中蛋白条带转移至FVDF(Milipore)膜上,5%牛血清白蛋白(BSA)4℃封闭过夜。次日分别用各钙通道蛋白抗体37℃孵育FVDF膜1 h,0.05%Tween-20-TBST 缓冲液漂洗 3次后加入荧光标记二抗,37℃孵育1 h,0.05%Tween-20-TBST缓冲液漂洗3次后Odyssey荧光扫膜仪检测杂交结果。
2 结果
2.1 不同细胞整合素的表达 人或小鼠不同细胞表达的整合素种类有明显差异(表1)。人单核细胞 THP-1和小鼠单核-巨噬样细胞J774A.1同时表达 β1、β2和 β3 整合素,人血管内皮细胞HUVEC、小鼠血管内皮EOMA、人肾小管上皮细胞HEK293均表达β1和β3整合素,人肝细胞L-02、人和鼠血小板仅表达β1整合素,小鼠肝细胞Hepa1-6、肾小球膜细胞SV40-MES13及肾成纤维细胞NIH/3T3均仅表达β3整合素(表1,图1~3)。
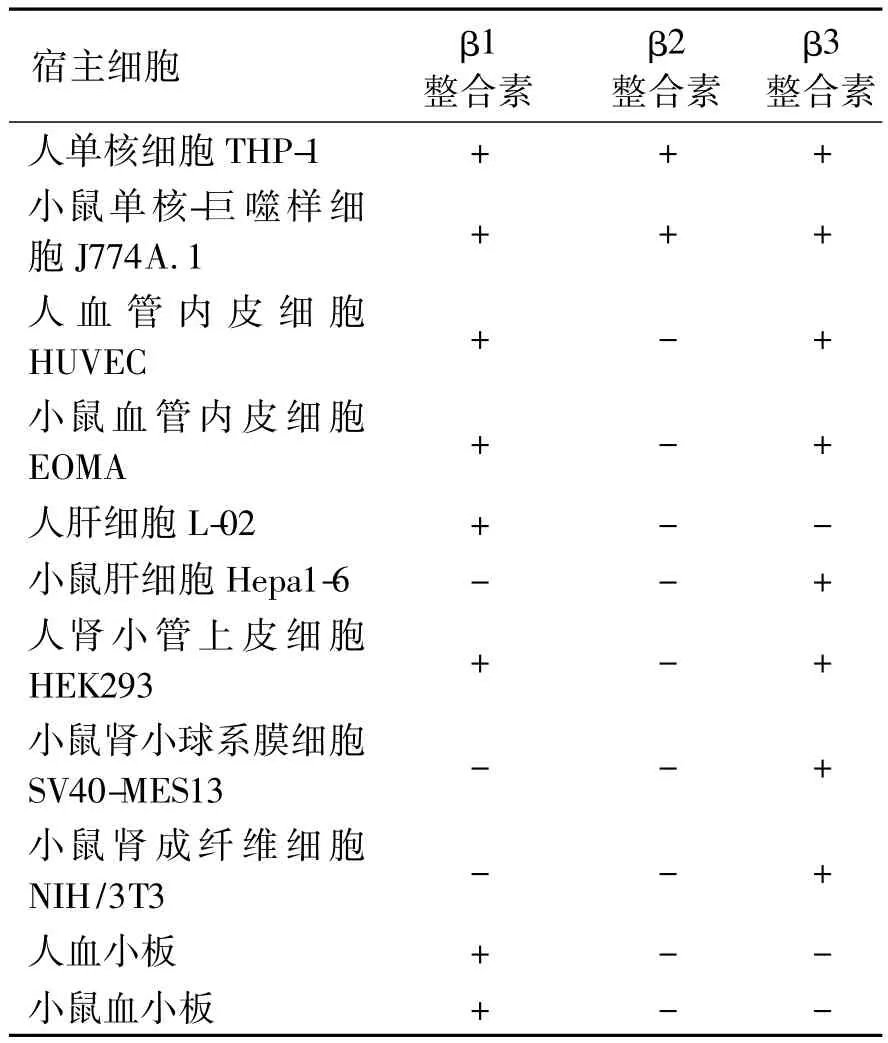
表1 人和小鼠钩体宿主细胞整合素表达谱Table 1 Expression spectrum of integrins on human and mouse host cells of Leptospira

2.2 不同细胞钙通道蛋白的表达 所有受试的9种人和小鼠细胞及人和小鼠血小板均不表达电压门控型钙通道蛋白。人单核细胞THP-1、小鼠单核-巨噬样细胞J774A.1、人血管内皮细胞 HUVEC、人肝细胞 L-02、小鼠肝细胞Hepa1-6和人肾小管上皮细胞HEK293表达受体门控型钙通道蛋白P2X7,人和小鼠血小板表达受体门控型钙通道蛋白P2X1,但小鼠血管内皮EOMA、肾小球系膜细胞SV40-MES13和肾成纤维细胞NIH/3T3未检出任何受体门控型钙通道蛋白(表2和图4)。
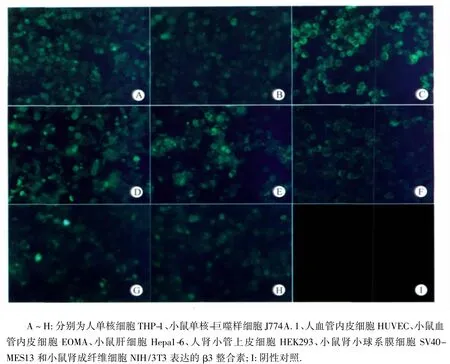
图3 人和小鼠钩体宿主细胞β3整合素表达状况Fig.3 Expression ofβ3 integrin on human and mouse host cells of Leptospira

表2 人和小鼠钩体宿主细胞钙通道蛋白表达谱Table 2 Expression of calcium channel proteins on human and mouse host cells of Leptospira

图4 人和小鼠钩体宿主细胞钙通道蛋白表达状况Fig.4 Expression of calcium channel proteins on human and mouse host cells of Leptospira
3 讨论
鼠类感染钩体后,无明显症状和体征,但可从尿液持续排出钩体形成传染源[3]。致病性钩体有强大的侵袭力,从皮肤或黏膜途径侵入人体后,迅速穿越血管壁引起钩体血症,随血流播散至肺、肝、肾等内脏器官,根据不同器官或组织损伤严重程度差异,临床上将钩体病至少分为5个型,如肺弥漫出血型、黄疸出血型、肾型等,病人恢复期也有短暂的尿液排菌[2,4]。单核-巨噬细胞和中性粒细胞均能吞噬钩体,但仅有单核-巨噬细胞能杀灭吞入的钩体[18]。众所周知,单核-巨噬细胞是抗原提呈细胞,启动宿主抗感染免疫应答。因此,本研究选择人和小鼠单核-巨噬细胞、血管内皮细胞、肝细胞、肾上皮细胞作为实验用靶细胞。
整合素是各种哺乳类细胞广泛表达的异二聚体跨膜蛋白,由α和β两个亚基组成。α和β亚基分子均有一个较大的球形胞外区、一个跨膜区和一个较小的胞内区,α和β亚基胞外区共同组成配体结合区,其配体主要为ECM分子、细胞间粘附分子-1(ICAM-1)和细胞间粘附分子-2(ICAM-2)。α亚基胞内区功能尚不清楚,β亚基胞内区具有调控细胞骨架重排及其相关胞内信号传导的功能序列,按β亚基的不同可将整合素分为 β1、β2和 β3亚家族[10-12]。不同配体分子与不同β亚基整合素相结合,激活胞内信号传导通路有所不同,细胞则表现出不同的生物学行为[19]。我们以往的研究发现,小鼠单核-巨噬样细胞吞噬问号钩体黄疸出血群赖型赖株后形成吞噬泡,吞噬泡与溶酶体融合后钩体被杀灭,人单核细胞THP-1吞噬该钩体后不形成吞噬泡,钩体在THP-1细胞胞浆中繁殖[20];钩体感染导致人单核细胞、小鼠单核-巨噬细胞、人肺上皮细胞坏死或凋亡,但对人血管内皮细胞和小鼠肾成纤维细胞无任何影响[21]。本研究结果显示,人单核细胞THP-1和小鼠单核-巨噬样细胞 J774A.1同时表达 β1、β2和β3整合素,人脐血管内皮细胞 HUVEC表达 β1和 β3整合素,小鼠肾成纤维细胞NIH/3T3仅表达β3整合素,提示上述细胞整合素表达谱不同可能与钩体感染不同细胞的结局差异密切相关。
如前所述,胞内游离Ca2+水平中度升高激发细胞吞噬病原体或病原体内化,持续高水平Ca2+超载导致细胞坏死或凋亡[13-16]。胞内游离Ca2+有两个来源:经膜钙通道的Ca2+内流以及胞内内质网或线粒体钙库的Ca2+释放。根据工作机制不同,细胞膜钙通道分为电压门控型和受体门控型两大类,前者主要分布于神经、肌肉和内分泌细胞,除P2X受体门控型钙通道分布广泛外,其余受体门控型钙通道仅见于神经系统[22-23]。以往研究中发现,问号钩体黄疸出血群赖型赖株感染的单核-巨噬细胞和肾上皮细胞内早期高水平游离Ca2+来源于Ca2+内流,晚期高水平游离Ca2+为胞内钙库动员所致,但相关钙通道类型不明;钩体感染的不同细胞其结局差异很大,人肺上皮细胞坏死,人单核细胞、小鼠单核-巨噬细胞及猴肾上皮细胞部分凋亡、部分坏死[13-14,21]。本研究结果显示,人单核细胞THP-1、小鼠单核-巨噬样细胞J774A.1、人血管内皮细胞HUVEC、人肝细胞L-02、小鼠肝细胞Hepa1-6和人肾小管上皮细胞HEK293均仅表达受体门控型钙通道蛋白P2X7,提示该受体门控型钙通道介导致了钩体感染宿主细胞时Ca2+内流,高水平胞内游离Ca2+导致了感染细胞坏死或凋亡。
[1] BHARTI A R,NALLY J E,RICALDI J N,et al.Leptospirosis: a zoonotic disease of global importance[J].Lancet Infect Dis,2003,3(12):757-771.
[2] YAN Jie,DAI Bao-ming,YU En-shu(严 杰,戴保民,于恩庶).Leptospirology[M].3 ed.Beijing:The People's Healthy Publication House(人民卫生出版社),2006.(in Chinese)
[3] ADLER B, de la PENA-MOCTEZUMA A.Leptospira and leptospirosis [J].Vet Microbiol,2010,140(3-4):287-296.
[4] McBRIDE A J,ATHANAZIO D A,REIS M G,et al.Leptospirosis[J].Curr Opin Infect Dis,2005,18:376-386.
[5] PATTI J M,BREMELL T,et al.The Staphylococcus aureus collagen athesin is a virulence determinant in experimental septic arthritis[J].Infect Immun,1994,62(1):152-161.
[6] BARBOSA A S,ABREU PA,NEVESF O,et al.A newly identified leptospiral adhesin mediates attachment to laminin [J].Infect Immun,2006,74:6356-6364.
[7] CHOY H A,KELLEY M M,CHEN T L,et al.Physiological osmotic induction of Leptospira interrogans adhesion: LigA and LigB bind extracellular matrix proteins and fibrinogen [J].Infect Immun,2007,75(5):2441-2450.
[8] STEVENSON B,CHOY H A,PINNE M,et al.Leptospira interrogans endostatin-like outer membrane proteins bind host fibronectin,laminin and regulators of complement[J].PLoS One,2007,2(11):e1188.
[9] ZHANG Hao,SUN Ai-hua,YAN Jie(张 皓,孙爱华,严 杰).Adhering effect of Leptospira interrongan to major extracellular matrix molecules[J].J Zhejiang Uni Med Sci(浙江大学学报医学版),2008,37(6):579-584.(in Chinese)
[10] ISBERG R R,HAMBURGER Z,DERSCH P.Signaling and invasin-promoted uptake via integrin receptors[J].Microbes Infect,2000,2(7):793-801.
[11] TAKAGI J.Structural basis for ligand recognition by RGD(Arg-Gly-Asp)dependent integrins[J].Biochem Soc Trans,2004,32(Pt3):403-406.
[12] BARCZYK M,CARRACEDO S,GULLBERG D.Integrins[J].Cell Tissue Res,2010,339(1):269-280.
[13] WANG Huan-ping,YAN Jie,LI Li-wei,et al(王焕萍,严 杰,李立伟,等).Phospholipase Cactivity and alteration of intracellular free Ca2+levels during internalization of Leptospira interrogans[J].J Zhejiang Uni Med Sci(浙江大学学报医学版),2005,34(1):15-20.(in Chinese)
[14] LIU Y Y,ZHENG W,LI L W,et al.Pathogenesis of leptospirosis: interaction of Leptospira interrogans with in vitro cultured mammalian cells[J].Med Microbiol Immunol,2007,196(4):233-239.
[15] BOUDREAU N J,JONES P L,et al.Extracellular matrix and integrin signalling:the shape of things to come[J].J Biochem,1999,339(Part 3):481-488.
[16] HANKS S K,RYZHOVA L,et al.Focal adhesion kinase signaling activities and their implications in the control of cell survival and motility[J].Front Biosci,2003,8(d):982-996.
[17] ZHAO J F,SUN A H,RUAN P,et al.Vibrio vulnificus cytolysin induces apoptosis in HUVEC,SGC-7901 and SMMC-7721 cells via caspase-9/3-dependent pathway [J].Microb Pathogenesis,2009,46(4):194-200.
[18] DAVISJ M,HAAKE D A,RAMAKRISHNAN L.Leptospira interrogans stably infects zebrafish embryos,altering phagocyte behavior and homing to specific tissues [J].PLoS Negl Trop Dis,2009,3(6):e463.
[19] LEISS M,BECKMANN K,GIROS A,et al.The role of integrin binding sites in fibronectin matrix assembly in vivo [J].Curr Opin Cell Biol,2008,20(5):502-507.
[20] LI SJ,OJCIUSD M,LIAO SM,et al.Replication or death:distinct fates of pathogenic Leptospira strain Lai within macrophages of human or mouse origin[J].Innate Immun,2010,16(2):80-92.
[21] JIN D D,OJCIUS D M,SUN D,et al.Leptospira interrogans induces apoptosis in macrophages via caspase-8- and caspase-3-dependent pathways[J].Infect Immun,2009,77(2):799-809.
[22] WAITKUS-EDWARDS K R,MARTINEZ-LEMUS L A,et al.α4β1 integrin activation of L-type calcium channels in vascular smooth muscle causes arteriole vasoconstriction [J].CIRC Res,2002,90(4):473-480.
[23] GUI P,WU X,LING S Z,et al.Integrin receptor activation triggers converging regulation of Cav1.2 calcium channels by c-Src and protein kinase A pathways[J].J Biol Chem,2006,281(20):14015-14025.
Distribution diversity of integrins and calcium channels on major human and mouse host cells of Leptospira species
LI Cheng-xue,ZHAO Xin,QIAN Jing,YAN Jie
(Department of Medical Microbiology and Parasitology,Zhejiang University School of Medicine,Hangzhou 310058,China)
Objective:To determine the distribution of integrins and calcium channels on major human and mouse host cells of Leptospira species.Methods:The expression ofβ1,β2 and β3 integrins was detected with immuno fluorescence assay on the surface of human monocyte line THP-1,mouse mononuclear-macrophage-like cell line J774A.1,human vascular endothelial cell line HUVEC,mouse vascular endothelial cell EOMA,human hepatocyte line L-02,mouse hepatocyte line Hepa1-6,human renal tubular epithelial cell line HEK-293,mouse glomerular membrane epithelial cell line SV40-MES13,mouse collagenoblast line NIH/3T3,human and mouse platelets.The distribution of voltage gate control calcium channels Cav3.1,Cav3.2,Cav3.3 and Cav2.3,and receptor gate calcium channels P2X1,P2X2,P2X3,P2X4,P2X5,P2X6and P2X7were determined with Western blot assay.Results: β1 integrin proteins were positively expressed on the membrane surface of J774A.1,THP-1,HUVEC,EOMA,L-02,Hepa1-6 and HEK-239 cells as well as human and mouse platelets.β2 integrin proteins were expressed on the membrane surface of J774A.1,THP-1,HUVEC,EOMA,and NIH/3T3 cells.β3 integrin proteins were expressed on the membrane surface of J774A.1,THP-1,HUVEC,EOMA,Hepa1-6,HEK-239 and NIH/3T3 cells as well as human and mouse platelets.P2X1receptor gate calcium channel was expressed on the membrane surface of human and mouse platelets,while P2X5receptor gate calcium channel was expressed on the membrane surface of J774A.1,THP-1,L-02,Hepa1-6,HEK-239 and HUVEC cells.However,the other calcium channels were not detected on the tested cell lines or platelets.Conclusion:There is a large distribution diversity of integrins and calcium channel proteins on the major human and mouse host cells of Leptospira species,which may be associated with the differences of leptospire-induced injury in different host cells.
Leptospira interrogans;Integrins/anal;Calcium channels/anal;Endothelial cells/metab;Leptospira;Host cell;Integrin;Expression
R 377.5
A
1008-9292(2012)04-0410-08
http:∥www.journals.zju.edu.cn/med
10.3785/j.issn.1008-9292.2012.04.009
2011-12-28
2012-04-28
国家自然科学基金项目(81171534).
李成学(1982-),男,硕士生,主要从事病原菌致病机制研究工作.
严 杰(1956-),男,博士,教授,博士生导师,主要从事病原菌致病机制及基因工程疫苗的研究工作;E-mail:Med_bp@zju.edu.cn
[责任编辑 黄晓花]
