β-聚苹果酸高产菌株的筛选及鉴定
2012-10-24徐玲芬陈忠华刘森泉
徐玲芬,陈忠华,赵 婧,阮 红,刘森泉
(浙江大学城市学院医学与生命科学学院,浙江杭州310015)
β-聚苹果酸高产菌株的筛选及鉴定
徐玲芬,陈忠华,赵 婧,阮 红,刘森泉
(浙江大学城市学院医学与生命科学学院,浙江杭州310015)
目的:从自然界筛选β-聚苹果酸(PMLA)高产菌株,并对其进行菌种鉴定。方法:从自然界取样,经过单菌落分离,根据菌落形态特征、聚苹果酸的定性检测和核酸序列分类鉴定手段,筛选PMLA高产菌株。结果:分离得到一株PMLA高产菌株,编号为Ⅱ04,经形态学研究和ITS序列分析,确定为短梗霉菌Aureobasidium pullulans,命名为Aureobasidium pullulans ZUCC-41。该菌在25℃,220 r/min振荡培养7 d,采用高效液相色谱法(HPLC)进行产物定量分析,检测到PMLA产量可达26.23 g/L。结论:从自然界中分离得到一株 PMLA高产菌株,经鉴定为短梗霉菌Aureobasidium pullulans,其发酵产量可达 26.23 g/L。
苹果酸盐;有丝分裂孢子真菌/分离和提纯;聚苹果酸;高产菌株;鉴定
[J Zhejiang Univ(Medical Sci),2012,41(4):434-440.]
聚苹果酸(Poly-malic acid,PMLA)是一种可完全生物降解且拥有高度生物相容性的水溶性高分子聚酯,且降解产物无毒,具有新型环保包装材料、医用材料、化妆产品、药物载体等巨大应用前景[1]。聚苹果酸有 α、β、γ等3种结构,其中β-PMLA在自然界广泛存在,用途也最为广泛,微生物发酵所得均为β型[1]。苹果酸和聚苹果酸的结构如图1所示[2]。
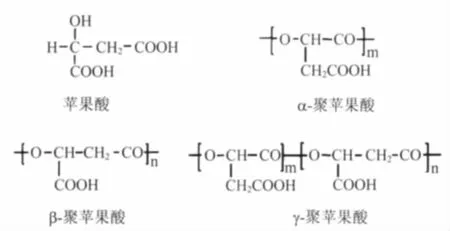
图1 苹果酸与3种聚苹果酸的结构Fig.1 Structure of malic acid and poly(malic acid)s
聚苹果酸的生产方法主要分为微生物发酵法与化学合成法,化学合成法多以β-烷氧羰基β-丙内酯为单体,在引发剂的条件下,通过开环聚合得到,成本相对较高[3]。因此,人们寻求微生物发酵法开展聚苹果酸合成及其规模化生产。
Shimada等最早从圆弧青霉(Penicillium Cyclopium)中分离得到一种酸性大分子化合物,这种物质有抑制蛋白酶的活性,推测可能是PMLA[4]。之 后 先 后 分 离 得 到 Physarum Polycephalum、 Aureobasidium Pullulans 和Aureobasidium Sp.等 PMLA产生菌。后来,对PMLA的研究多以这些菌种为研究对象[5-7]。筛选产酸能力强的发酵菌株及优化培养条件是目前微生物发酵法制备PMLA急需解决的问题。现在研究得比较多的是出芽短梗霉Aureobasidium系列,曾有文献报道,Nagata等人在日本伊豆半岛的某树种树皮上分离得到的出芽短梗霉A-91是一种聚苹果酸高产菌[8]。国内对于聚苹果酸的研究较少。本研究从自然界微生物采集、分离和筛选,以期获得产量较高的PMLA产生菌,并对其进行初步的分类鉴定,为今后β-聚苹果酸的研究和开发提供新的菌种来源和实验依据。
1材料与方法
1.1 材料
1.1.1样本来源 样本包括树皮、树叶和花及树的分泌物,分别来自:湖州苗圃,编号为1~32;杭州植物园,编号为33~64;杭州高校,编
号为65~116,共计116个样本。
1.1.2 主要试剂和仪器 新鲜马铃薯;试剂均为分析纯。压力蒸汽灭菌器(上海华仪医用核子仪器生产有限公司);pH计(上海虹益仪器仪表有限公司);生化培养箱(上海博讯实业有限公司);AllegraTM 64R centrifuge高速冷冻离心机(Beckman Coulter公司);DHZ-CA旋转振荡器(江苏太仓华利达实验设备公司);安捷伦 HPLC 1200高效液相色谱仪;生物显微镜BA 310(麦克奥迪实业集团有限公司)。
1.1.3 培养基 参见文献[8]。富集培养基:10%甘露醇作为主要碳源,0.1%NH4NO3,0.05%KH2PO4,0.02%MgSO4·7H2O,0.2%柠檬酸、0.02%吐温 80;分离培养基:马铃薯葡萄糖琼脂(PDA)平板和斜面;筛选培养基:12% 葡萄糖,0.1%NH4NO3或 0.2%NaNO3作为氮源,0.01%KH2PO4,0.05%KCl,0.02%MgSO4·7H2O,3%CaCO3(单独灭菌),蒸馏水,分装于250 ml三角瓶,每瓶含30 ml培养基(下同);种子培养基:8%葡萄糖,0.3%琥珀酸铵,0.2% 琥珀酸,0.04%K2CO3,0.01%KH2PO4,0.01%MgSO4·7H2O,5 ppm ZnSO4·7H2O,0.05%玉米渣液,2%CaCO3(单独灭菌),蒸馏水;基础发酵培养基:12%葡萄糖,0.3%琥珀酸铵,0.2% 琥 珀 酸,0.04%K2CO3,0.01%KH2PO4,0.01%MgSO4·7H2O,5 ppm ZnSO4·7H2O,0.05% 玉米渣液,3%CaCO3(单独灭菌),蒸馏水。
1.2 β-聚苹果酸高产菌株的筛选
1.2.1 单菌落的分离 将样品置于含有富集培养基的摇瓶培养,30℃培养2~4 d,直至培养液中有浑浊出现;将培养液摇匀,移取100 μl于分离培养基上涂布均匀,30℃培养2~4 d;定期观察平板,依菌落生长情况进行菌种的多次分离纯化直至形成单菌落为止。其中,若一个平板上生长有几个菌落,则以A、B等加以区别,如1A 、1B。
1.2.2 采用筛选培养基进行初筛 挑取单菌落,接种于筛选培养基中,置摇床220 r/min 25℃培养7 d,发酵液用定性滤纸过滤,高速离心,取上清,稀释后经定性检测有PMLA的作为初筛目的菌株。
1.2.3 采用发酵培养基进行复筛 从分离平板挑取初筛菌株的单菌落于PDA斜面上,培养至菌株单菌落生长旺盛(约2~3 d),接种于种子培养基中,置摇床220 r/min 25℃培养2 d,再以5%的接种量在发酵培养基里以相同方法发酵培养7 d,发酵液离心,取上清,水解,高效液相色谱法测定PMLA产量,选取产量较高的菌株作为复筛目标菌株,并做进一步实验。
1.3 发酵产物的分析方法
1.3.1 发酵液的前处理 复筛目标菌株的发酵液经15 000 r/min离心20 min后,取上清液分两份,其中一份加入等体积的0.5 mol/L H2SO4,90℃水解 9 h,用于后续的苹果酸检测[8]。
1.3.2 多糖含量的测定 采用硫酸-苯酚法。精确称取无水葡萄糖0.05 g置50 ml容量瓶中,加水溶解并稀释至刻度,摇匀,量取2.5 ml溶液置于50 ml容量瓶中,稀释至刻度,制成贮液。分别量取 0.1、0.2、0.4、0.6、0.8、1.0 ml加水稀释至1.0 ml,再加5%苯酚溶液1 ml,迅速加入浓硫酸5 ml,摇匀,静置室温30 min,以空白为对照,在490 nm波长处测定吸光度。以葡萄糖浓度C(mg/ml)为横坐标,吸光度为纵坐标绘制出标准曲线:y=9.7112x+0.0093(R2=0.9996)。取 1 ml发酵液,3 000 r/min离心2 min,取上清液0.5 ml并加入等体积乙醇,混匀,1 300 r/min离心5 min,蒸发残余乙醇,加入0.5 ml水溶解沉淀,经透析后测定其吸光度,由标准曲线回归方程推算出发酵液中多糖含量。
1.3.3 聚苹果酸的定性检测 取水解前和水解后的发酵液,离心后各取5 ml于两支试管中,分别滴入3滴15%TiC13溶液,几分钟后观察是否有白色沉淀生成,并对比两支试管的变化。将苹果酸对照品溶液在优化后的HPLC条件下进样,确定苹果酸在该条件下的保留时间,重复测定5次。苹果酸的平均保留时间为6.655 min,RSD为0.44%。在样品中加入苹果酸标准液,根据峰高的突增来进一步验证色谱峰的归属。
1.3.4 聚苹果酸的定量测定 参照文献[9]。精确称取L-苹果酸标准品,用蒸馏水分别配制成浓度为 0.125、0.25、0.5、1、2、3、4、5 g/L 的标准液,经0.22 μm滤膜过滤后,采用优化后的高效液相色谱法测定苹果酸标准液,以L-苹果酸浓度为横坐标、峰面积为纵坐标制作标准曲线 y=512.39x-3.3808(R2=1)。高效液相色谱条件:Agilent 1200 seires液相色谱系统,色谱柱 Synergi 4u Polar-RP(4.6 ×250 mm,5 μm);以 A(0.01 mol/L KH2PO4):B(乙婧)=95∶5为流动相,柱温:30℃;紫外检测波长:210 nm;进样量:5 μl;检测时间:15 min。水解前、后发酵液分别稀释10倍和20倍,滤膜过滤,高效液相色谱法测定与苹果酸标准品相同保留时间的峰面积,根据标准曲线求得水解前、后发酵液中苹果酸含量,水解前后之差值即为PMLA含量。
1.4 菌种鉴定 按照生工SK1375真菌基因组DNA抽提试剂盒说明书,对细菌细胞总DNA进行提取,PCR扩增引物设计为:上游引物:5'TCCGTAGGTGAACCTGCGG 3'(20 bp);下游引物:5'TCCTCCGCTTATTGATATGC 3'(19 bp)。50 μl反应体系:模板 DNA 10 pmol/L、上游引物(10 μmol/L)1 μl、下游引物(10 μmol/L)1 μl、dNTPs混合液(10 mmol/L,each)1 μl、10 × Taq 反应缓冲液 5 μl、Taq 酶(5 U/μl)0.25 μl,最后用无菌双蒸水补足至 50 μl。扩增程序设定为:预变性98℃ 5 mim;循环95℃ 35 s,55℃ 35 s,72℃ 40 s;35 个循环后延伸8 min。PCR产物的纯化:由PCR产物电泳结果切割所需DNA目的条带,用DNA凝胶纯化试剂盒回收琼脂糖凝胶上的PCR产物。测序由上海生工生物工程技术服务有限公司完成。将测序结果送 GenBank库 Blast分析[10],在NCBI数据库中搜索其同源性最高的序列,根据16SrRNA序列进化树比对分析,最后确定菌种分类。
2结果
2.1 菌株初筛 在筛选培养基上经过划线分离共得到165个单菌落,并初筛到28株初筛菌株,菌株编号如表1所示。

表1 菌株初筛结果Table 1 The preliminary results of strains screening
2.2 复筛结果 初筛菌株采用产量较高的10株进行复筛,从结果(见表2)可以看出:编号为Ⅱ04的菌株产量最高,因此,后续研究均选用Ⅱ04菌株为研究对象。
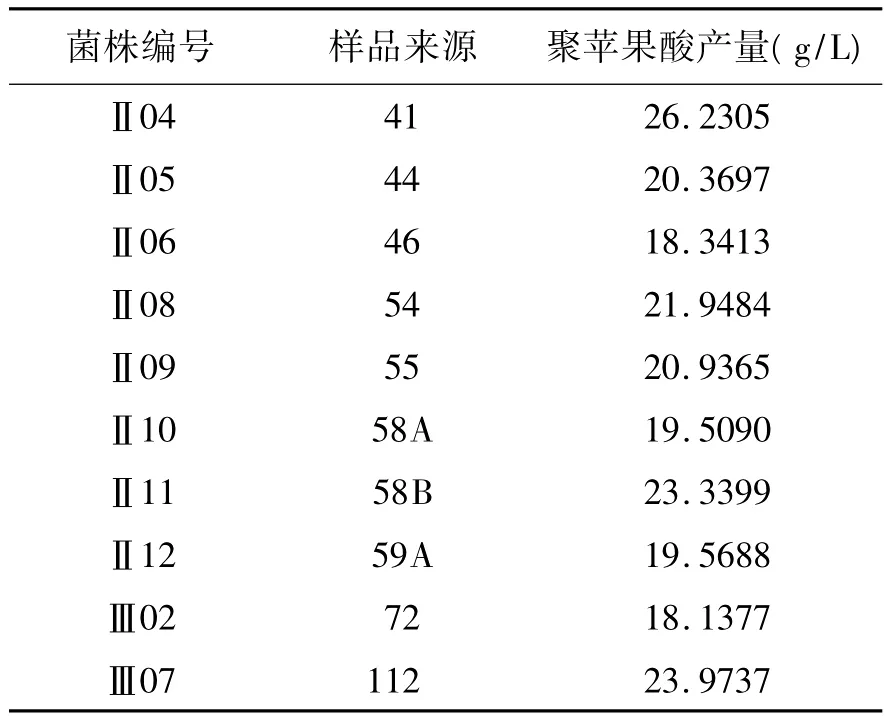
表2 菌株复筛结果Table 2 The results of secondary screening
2.3 发酵产物的分析
2.3.1 苯酚-硫酸法测定发酵液中多糖含量菌株Ⅱ04发酵液经测定多糖含量为15.61 g/L,证明加入的碳源除用于合成PMLA和自身代谢外还产生了一部分多糖。实验中还发现,当发酵液中加入等体积乙醇后产生的多糖沉淀能缠绕于玻棒,初步断定产生的多糖中含有普鲁兰多糖等成分。
2.3.2 紫外-可见分光光度仪分析 根据紫外-可见分光光度法光谱扫描结果图可看出:苹果酸标准品和Ⅱ04菌株发酵产物的光谱图基本相似(图2),可以初步判断发酵液水解产物中含有苹果酸。
2.3.3 HPLC定量分析 对聚苹果酸发酵液水解前后HPLC的定性检测,结果显示水解前的发酵液无明显的白色沉淀生成,水解后有明显的白色沉淀生成。苹果酸的平均保留时间为6.525 min,RSD 为 0.44%,样品目的峰与标准品出峰时间一致,标准品图谱见图3。在样品中加入苹果酸标准液,在原目的峰的基础上峰面积变大,表明目的峰对应的是苹果酸,水解液HPLC图谱见图4。
2.4 菌种分类鉴定
2.4.1 形态特征 菌株Ⅱ04在分离平板上菌落最初呈白色,外表有光泽,但是随着培养的进行逐渐变成粉白色,然后逐渐变绿变暗,最后变成黑色(图5)。其菌体细胞在显微镜下观察呈卵圆形,酵母样,着色均匀(图6)。

图2 苹果酸标准品(左)和菌株Ⅱ04发酵产物水解液(右)的光谱图Fig.2 Spectrograms of standard malic acid(left)and hydrolytic products from fermentation broth(right)
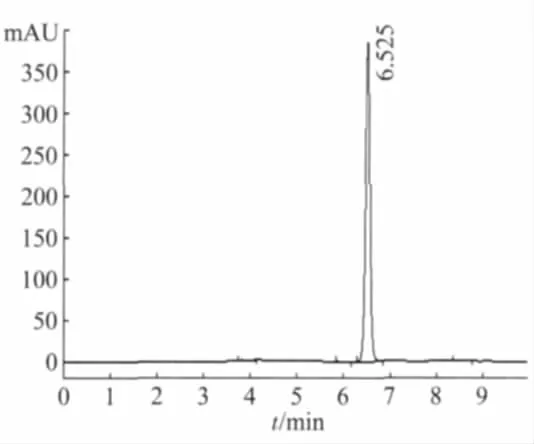
图3 苹果酸标准品的HPLC图谱Fig.3 HPLC map of malic acid standard
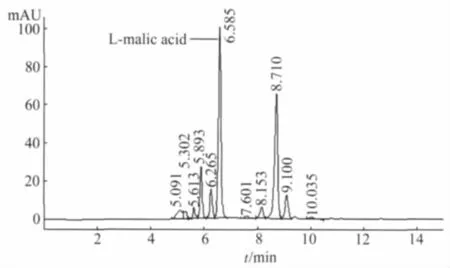
图4 发酵液水解后HPLC含量测定图谱Fig.4 HPLC map of hydrolyzates from fermentation broth

图5 菌株Ⅱ04平板划线图Fig.5 Streak plating of strain Ⅱ04
2.4.2 菌株Ⅱ04的ITS序列分析 提取菌株Ⅱ04的基因组DNA,经PCR扩增后回收测序,所测菌株Ⅱ04的ITS核苷酸序列长度为 519 bp。送 GenBank库,根 据GenBank Blast分析提供的基因序列,依据16SrRNA序列构建进化树进行比对分析,其中同源性最高的菌株是Aureobasidium pullulans,同 源 性 为100%,再结合其菌落形态及16SrRNA序列分析的系统进化结果,菌株Ⅱ04初步鉴定为 Aureobasidium pullulans,命名为Aureobasidium pullulans ZUCC-41(图7)。
3讨论

图6 菌株Ⅱ04的细胞形态显微图(40×)Fig.6 Micrograph of strainⅡ04(40×)
许多微生物能合成聚羟基烷基酯类,作为其碳源和能量的储存形式。聚苹果酸作为聚羟基二元酸酯的一种,是近来发现的一类生物聚酯,到目前为止,只在少数真菌中发现有聚苹果酸产物[11]。本研究从树皮、树叶和树的分泌物及花中筛选得到28株聚苹果酸产生菌,再经过复筛得到聚苹果酸的高产菌株04。其发酵产物经高效液相色谱定量分析,产量可高达26.23 g/L,高于国内报道15.15 g/L 的发酵产量[12]。

图7 基于菌株Ⅱ04的16SrDNA基因序列的系统发育树Fig.7 Phylogenetic tree based on 16S rRNA gene sequence of strain Ⅱ04
依据菌株Ⅱ04的形态以及ITS基因序列分析的结果,发现它属于出芽短梗霉菌,初步鉴定为 Aureobasidium pullulans。出芽短梗霉属是属于一类与酵母亲缘关系密切的真菌,多存在于植物材料上及土壤中,经常能和酵母一起分离得到。由于遗传的不稳定性,它们往往易形成很多变种,菌落最初粘稠,白色,很快转变为淡绿色,最终变为黑色,与Ⅱ04菌落特征相似。据报道出芽短梗霉菌发酵产生的胞外多聚糖多种多样,其中最为重要的有普鲁兰多糖,它是一种细胞外水溶性的中性多糖[13]。本研究在对菌株Ⅱ04的发酵液进行乙醇沉淀时,发现有类似普鲁兰多糖,测得发酵液的多糖含量为15.61 g/L。
考虑到胞外多糖的产量会影响聚苹果酸的产量,我们分离得到的菌株中糖量较少,性能较稳定,易于培养,产生的黑色素少,比较利于聚苹果酸的产生[14]。此外,我们将在PMLA高产菌筛选工作的基础上,进一步开展PMLA高产菌发酵条件的优化研究,为今后苹果酸生产工业化提供实验数据与理论指导。
[1] GE Jin-jie(戈 进 杰).Biodegradablepolymer materials and its applications(生物降解高分子材料及其应用)[M].Beijing:Chemical Industry Press(化学工业出版社),2002.(in Chinese)
[2] DING Rui,LI Guang-ji(丁 锐,李 光 吉).Synthesis and application prospects of biopolymers poly(malic acid)and its derivatives[J].Polymer Bulletin(高分子通报),2005,17(2):47-48.(in Chinese)
[3] YU Wen-bing,ZHOU Hua,WEI Ping(周文兵,周华,韦 萍).Synthesis and applications of biodegradable materialPMLA [J]. Chemical Industry and Engineering Progress(化工进展),2004,23(10):1086-1090.(in Chinese)
[4] SHIMADA K,MATSUSHIMA K,FUKUMOTO J,et al.Poly-(L)-malic acid,a new protease inhibitor from Penicillium cyclopium [J].Biochem Biophy Res Common,1969,35(5):619-624.
[5] LEE B S,HOLLER E.Beta-poly(L-malate)production by non-growing microplasmodia of Physarum polycephalum and effects of metabolic intermediates and inhibitors [J]. FEMSMicrobiology Letters,2000,193(1):69-74.
[6] NAKAJIMA-KAMBE T, HIROTANI N,NAKAHARA T.Poly(β-L-malic acid)production by the non-growing cells of Aureobasidium sp.strain A-91 [J].J Ferment Bioeng,1996,82(4):411-413.
[7] LIU S J,ALEXANDER S.Production of poly(malic acid) from differentcarbon sources and its regulation in Aureobasidium pullulans [J].Biotechnology Letters,1997,19(1):11-14.
[8] NAGATA N,NAKAHARA T,TABUCHIT.Fermentative production of poly(β-L-malic acid),a polyelectrolytic biopolyester,by Aureobasidium sp.[J].Biosci Biotech Biochem,1993,57(4):638-642.
[9] LIU Sen-quan,RUAN Hong,XU Ling-fen,et al(刘森泉,阮 红,徐玲芬,等).Determination of the poly(malic acid)content in the fermentation liquor by reversed-phase high performance liquid chromatography[J].Food and Fermentation Industries(食品与发酵工业),2010,36(6):142-145.(in Chinese)
[10] GENG Zhi,LIU Kai-hui,ZHAO Yun-xin,et al(耿直,刘开辉,赵赟鑫,等).Distributary and identification of a strain of paclitaxel-producing endophytic fungi from Chinese yew [J].Journal of Microbiology(微生物学通报),2010,37(2):199-203.(in Chinese)
[11] FISCHER H,ERDANN S,HOLLER E.An unusual polyanion from Physarum polycephalum that inhibits homologous DNA polymerase alpha in vitro[J].Biochemistry,1989,28(12):5219-5226.
[12] FANG Xuan-jun,ZHANG Ying(方宣钧,张英).Ultraviolet mutagenesis and optimal fermentation conditions of Aureobasidium pullulans[J].Journal of Agricultural Biotechnology(农业生物技术报),1998,6(2):124-128.(in Chinese)
[13] CUI Tang-bin,GUO Yong,ZHENG Sui-ping(崔堂兵,郭 勇,郑穗平).The research progress of Aureobacidium pullalans [J]. Industrial Microbiology(工业微生物),2002,32(2):41-47.(in Chinese)
[14] LIU Shuang-jiang(刘双江).Poly(malic acid)production by Aureobacidium pullalans CBS591.75 and DSM2404 [J].Chinese Journalof Biotechnology(生物工程学报),1997,13(3):279-283.(in Chinese)
[责任编辑 张荣连]
Screening and identification of high-yield poly(β-malic acid)bacterial strain
XU Ling-fen,CHENG Zhong-hua,ZHAO Jing ,RUAN Hong,LIU Sen-quan(School of Medicine and Life Science,Zhejiang University City College,Hangzhou 310015,China)
Objective:To isolate and identify the high-yield poly-malic acid(PMLA)bacterial strains from the nature.Methods:Samples were collected and cultured.The high-yield PMLA bacterial strains were screened through morphological observation,qualitative PMLA tests by HPLC and ITS sequence analysis on the isolated bacterial strains.Results:A high-yield PMLA strainⅡ04 was isolated,the yield of PMLA of the strain reached to 26.23g/L in the rotary shaker at 25℃ for 7d.From morphological observation and ITS sequences analysis,the strain belonged to Aureobasidium pullulans,and named as Aureobasidium pullulans ZUCC-41.Conclusion:A high-yield bacterial strain has been isolated from the nature and identified to be Aureobasidium pullulans.
Malates;Mitosporic fungi/isol;Poly(malic acid);High-Producing Strain;Identification
Q 939.9
A
1008-9292(2012)04-0434-07
2011-04-08
2011-11-21
2010年浙江省大学生新苗人才计划资助项目;杭州市科技局重点实验室科技创新资助项目(20080432T05).作者简介:徐玲芬(1989-),女,本科生,主要从事微生物发酵研究.
阮红(1968-),女,博士,教授,主要从事天然产物生物活性研究;E-mail:ruanhong@zucc.edu.cn
10.3785/j.issn.1008-9292.2012.04.013
