冷藏温度下真空包装牛肉微生物及品质变化*
2012-01-12邱淑冰张一敏罗欣
邱淑冰,张一敏,罗欣
(山东农业大学食品科学与工程学院,山东 泰安,271018)
肉品真空包装是延长肉品货架期的有效方法,适合于长期贮存和长距离运输,因此,真空包装从初始包装、运输到零售都得到广泛应用[1],也是现在消费市场主要销售包装形式[2]。真空包装能抑制肉中常见的一些食源性致病微生物和腐败微生物的生长,但并不能完全抑制所有微生物的生长,一些厌氧和兼性微生物仍然可以生长。研究显示:假单孢菌属、肠杆菌属、热杀索丝菌属、乳酸菌属均能导致真空包装肉品的腐败[2-3]。
目前,真空包装作为广泛应用于冷却牛肉的包装形式,十分有必要了解该包装条件下贮藏过程中,产品的微生物数量变化及品质变化情况。因此,本课题通过测定真空包装冷却牛肉品质变化及多种微生物生长变化,确定了此种包装下冷却牛肉贮藏过程中微生物的变化趋势、理化指标的变化规律及各指标的相关关系,为客观评价真空包装形式下的冷却牛肉的货架期提供理论依据。
1 材料与方法
1.1 材料与样品处理
从山东某肉牛屠宰基地取四条常规屠宰、成熟48h牛背最长肌(西冷)。无菌操作将牛背最长肌修去筋腱后,垂直于肌纤维方向切成大约(50±5)g牛肉切片。每一牛肉切片在无菌条件下放入真空包装袋中,抽气封口,其真空度为99%,然后分别放置在4℃恒温箱中。4℃条件下分别测定其第0,7,13,21,28,38天的相应指标。
真空包装袋:河北雄县旭日包装有限公司。材质为PA/PE复合,透氧率<15 cm3/24 h(25℃),厚度为0.08 mm。
1.2 仪器与设备
GB204分析天平、MP120pH计,瑞士,Mettler Toledo;DZ-400型真空包装机,山东小康机械有限公司;LDZX立式压力蒸汽灭菌器,上海申安医疗器械厂;DHG-9240A电热鼓风干燥箱,上海一恒科学仪器有限公司;Bag Mixer400均质器,法国,Interscience;SPX-400智能型生化培养箱,宁波江南仪器厂;DKS28电热恒温水浴锅,上海精宏实验设备有限公司;UDK-126D半自动凯氏定氮仪,意大利WELP公司;centrifuge5415D离心机,德国,Eppendorf;SP62色差计,美国,爱色丽 X-Rite等。
1.3 方法
1.3.1 细菌总数的测定
每隔相应时间,在无菌操作条件下,取肉样25 g置于均质拍打袋中,加入225mL灭菌蛋白胨生理盐水,用均质器拍打60 s,然后按10倍递增稀释到所需稀释度,按照GB4789.2-2008《食品卫生微生物学检验菌落总数测定》用稀释平板法测定细菌总数。
1.3.2 乳酸菌、肠杆菌、热杀索丝菌、假单胞菌数的测定
操作同1.3.1。采用不同的选择培养基进行细菌培养,并测定菌落总数。各种培养基及培养条件见表1。
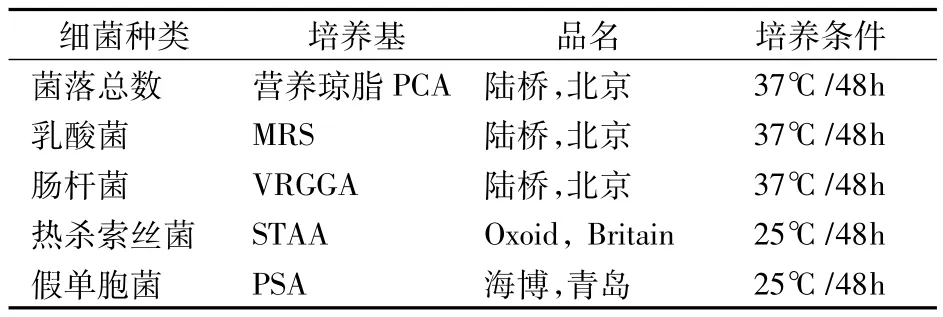
表1 培养基及培养条件
1.3.3 pH值的测定
采用便携式pH计按照GB 9695.5-2008《肉与肉品pH测定》中的方法测牛肉的pH值。每个样品至少重复4次。
1.3.4 挥发性盐基氮(TVBN)的测定
每隔相应时间取肉样10.00 g绞碎搅匀,分别置于锥形瓶中,加入100 mL水,不时振摇,浸渍30 min后离心(5 000 r/min,5 min),上清液置冰箱备用。按照GB/T5009.44-2003半微量凯氏定氮法测定挥发性盐基氮含量。
1.3.5 失水率的测定
低速离心法[4]:离心速度为 5 000r/min,离心 5 min,试样3 g,试样形状为:(1.5×1.5×0.5)cm。
1.3.6 色差值的测定
打开真空包装袋0.5 h后,进行色差测定[6]。取相应肉样用X-rite SP62便携式色度仪测定CIE L*a*b*(L*为亮度值,a*为红(+)-绿值(-),b*为黄(+)-蓝(-)值)。每个样品至少测定6个位点,取平均值,并计算C*ab的值。C*ab为色度饱和度。C*ab=[(a*2+b*2)]1/2。
1.4 数据处理
数据统计采用Sigma Plot 11.0进行作图分析,SAS 9.0统计软件进行显著分析和相关性分析。
2 结果分析
2.1 真空包装牛肉在冷藏温度下菌落总数与乳酸菌变化
从图1可以看出:真空包装牛肉其初始菌落数为4.2 lgCFU/g,在贮藏初期,菌落总数其生长变化较快,21 d时达到最大生长水平,约为108CFU/g,此后基本保持不变。据报道,在低温下,肉中微生物的最大生长量为 107~109CFU/g[7],这与本研究结论一致。Liu认为肉品开始腐败时,肉中的菌落数量达到了7 ~ 9 lgCFU/g[8]。
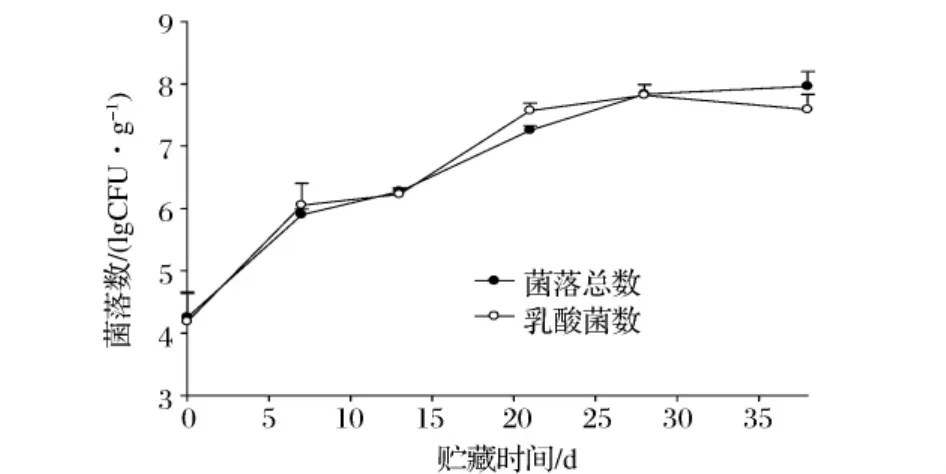
图1 4℃真空包装牛肉菌落总数和乳酸菌变化
诸多研究证实乳酸菌是真空包装食品的主要腐败菌[1,9]。从图1可以看出:乳酸菌的生长趋势与菌落总数大致相同。21 d时,已达到生长最高水平,约为108CFU/g。
2.2 真空包装牛肉在冷藏温度下假单胞菌、热杀索丝菌、肠杆菌生长变化
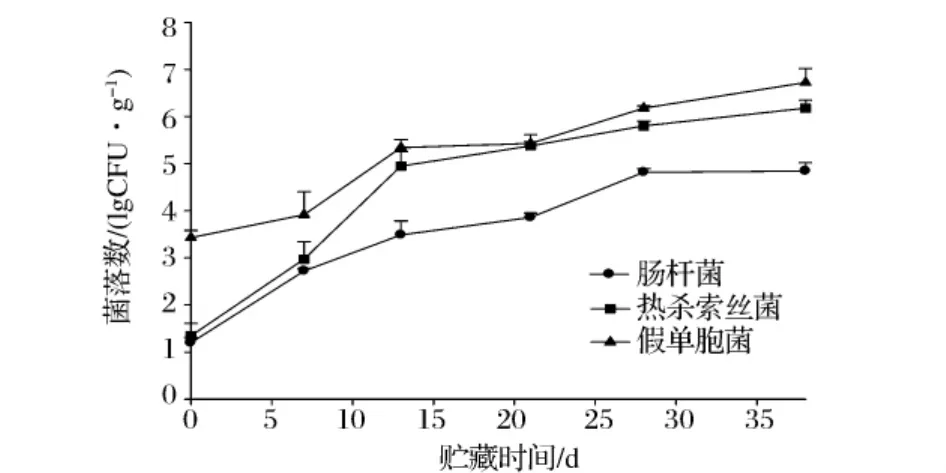
图2 4℃真空包装牛肉肠杆菌、热杀索丝菌、假单胞菌变化
如图2所示,肠杆菌和热杀索丝菌的初始菌量很少,之后生长迅速。肠杆菌能在低温下生长,属于兼性好氧微生物,是肉品中的常见菌。该菌在真空包装的冷却牛肉中数量不是很高,后期生长仅达到104CFU/g。热杀索丝菌也是冷却肉中的常见菌,尤其是在真空包装和气调包装的肉品中。热杀索丝菌生长迅速,后期达到106CFU/g。假单胞是好氧革兰氏阴性菌,诸多研究表明为有氧贮藏条件下的主要腐败菌,假单胞同样为真空包装的主要腐败菌,主要与真空包装条件袋的透氧率有关[10]。从图2可以看出,假单胞的初始菌量较高,这可能因为前期在屠宰、分割、成熟过程中,假单胞菌存在并生长,在贮藏后期达到106CFU/g,这一水平与Pennacchia的研究结果一致[11]。
2.3 真空包装冷却牛肉在不同贮藏温度下pH值变化
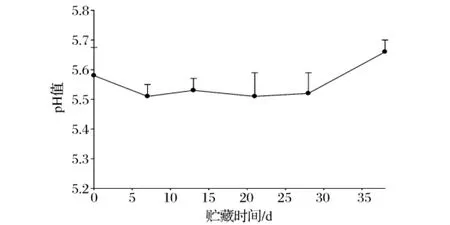
图3 4℃下真空包装牛肉pH的变化
新鲜肉的pH值一般为pH5.4~5.8。肉类在低pH值的情况下能保持较好的肉品品质[15]。从图3中可以看出:肉品初始pH值为pH5.6左右。在贮藏初期,其pH值降低,呈下降趋势,微生物首先利用肉表面的葡萄糖等碳水化合物,产生乳酸等酸性物质,酸类物质积累使pH值减低;在贮藏中期变化不明显,但贮藏后期pH值显著上升,主要原因为随着贮藏时间的延长,肉中的蛋白质在细菌、酶作用下被分解为氨和胺类化合物等碱性物质而使pH值升高。4℃贮藏38 d时,其pH值上升至pH 5.64。pH值是研究肉品品质的重要指标,有研究表明:相比较于细菌数量等微生物指标,pH值等理化指标被认为是肉和肉制品微生物腐败的化学指标[12-13]。
2.4 真空包装冷却牛肉在不同贮藏温度下色泽变化

图4 4℃下真空包装牛肉色泽a*值、C*ab的变化
肉的颜色主要由肌红蛋白决定,肌红蛋白主要有3种氧化还原状态,即由脱氧肌红蛋白(紫红色)、氧合肌红蛋白(鲜红色)和高铁肌红蛋白(褐色),这3种形态对应肌红蛋白中心铁原子的3种配位结构。而肉类产品呈现的诱人的颜色,是与O2结合形成氧合肌红蛋白,对肉色起决定性作用[15]。真空包装下的肌红蛋白,处于低氧状态,肌红蛋白的形式主要是脱氧肌红蛋白,呈现暗红色或紫色;当打开包装袋后,O2与脱氧肌红蛋白结合,发生氧化反应,形成氧合肌红蛋白,呈现消费者所喜欢的鲜红色。
L*为亮度,a*代表红-绿变化。a*越大,表示红度越高。b*代表黄-蓝值。研究表明:a*和C*ab值能较好的反应肉品颜色变化[16]。图4表示在冷藏温度下,肉品a*、C*ab随贮藏时间的变化趋势。贮藏初期a*、C*ab升高,主要由于开始时牛肉处于有氧状态下,肌红蛋白和氧气发生反应暂时生成不稳定的鲜红色氧合肌红蛋白[14],随着贮藏时间的延长,由于氧气消耗,形成大量的高铁肌红蛋白,高铁肌红蛋白大量积累,使肉发生褐变 ,a*值下降[17]。有氧条件下,a*值在贮藏末期,下降明显[4],而真空包装条件,缓解了其色泽下降趋势,此结果与真空包装的颜色稳定的观点一致[18]。
2.5 真空包装冷却牛肉在4℃贮藏温度下系水力和TVBN值变化
系水力变化,主要是在冷藏过程中,导致腐败的微生物的生长繁殖需要利用牛肉中的水分,从而使得牛肉的汁液损失发生变化[4]。从图5可以看出,4℃贮藏时,系水力基本为先上升,到后期有小幅下降。
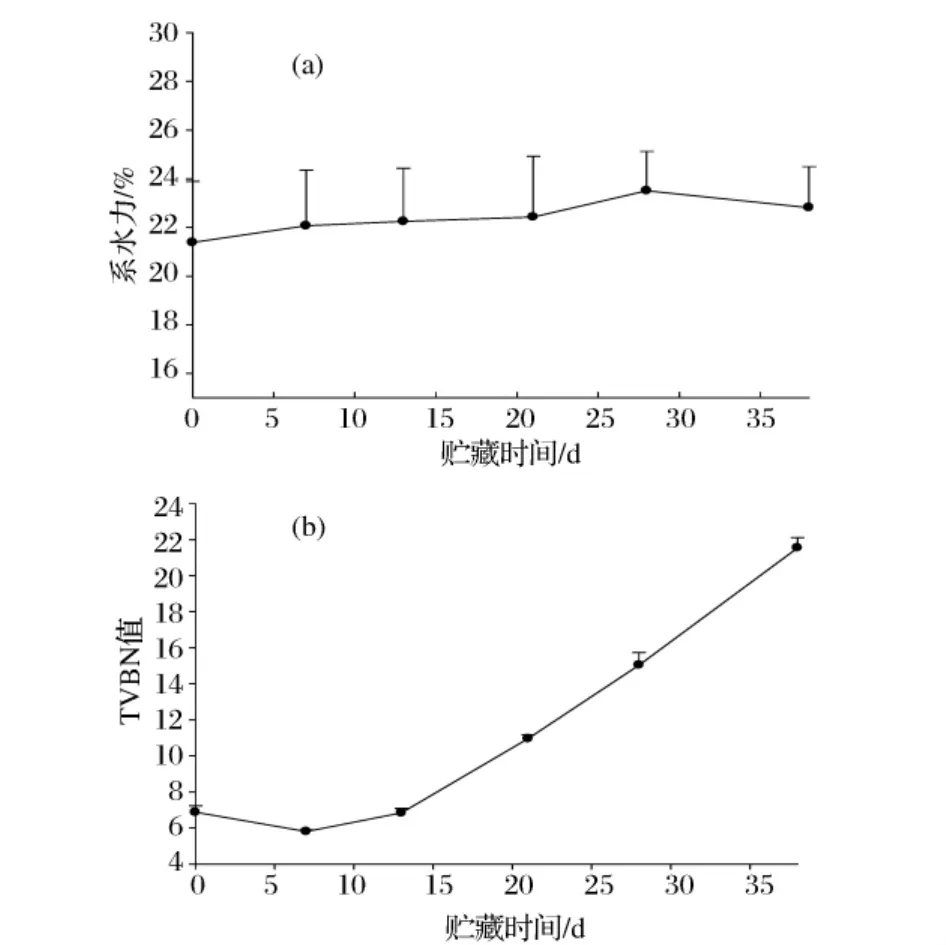
图5 4℃下真空包装牛肉失水率(a)和TVB-N值(b)的变化
肉品中TVBN的来源主要是微生物对牛肉中含氮有机化合物的分解作用,即将蛋白质分解为氨基酸,并进一步通过脱羧基作用和脱氨基作用分解氨基酸产生氨或胺。GB2707-2005规定:鲜肉的卫生标准为TVBN≤15 mg/100g。在4℃条件下,贮藏时间为28 d时,TVBN值超过15 mg/100g,表明牛肉已经腐败;随着微生物生长繁殖,蛋白继续分解,TVBN值继续上升。当TVBN值达到20 mg/100g,其贮藏时间为38天时,此时牛肉严重腐败,不可接受。
有学者对肉进行感官评定,但感观评定带有很强的主观因素,而且只能检测到后期的腐败[19]。本实验通过检测冷却牛肉的理化指标和微生物指标,结合变化趋势图可以知道随着贮藏时间的延长,微生物数量、挥发性盐基氮、系水力都是增长的趋势,能客观反映真空包装牛肉在腐败过程中的品质变化。
2.6 4℃条件下真空包装冷却牛肉微生物指标与品质指标相关性分析
冷却牛肉在冷藏条件下微生物及各相关品质指标都发生了变化,各指标之间都是动态的变化过程,本研究应用相关性分析评价各个指标之间的关系。表2通过pearson相关系数反应微生物指标与各品质指标的相关性。肉品菌落总数与乳酸菌数都呈现极显著相关(P<0.01)的关系。菌落总数与TVBN值、a*值、b*值、C*ab及汁液损失显著相关(P<0.05),此结论与文献[5]结论一致,Byun与Min等研究0℃和4℃有氧贮藏条件下肉品品质变化,同样发现:TVBN与细菌总数相关性超过0.9,并建议用TVBN作为腐败指示指标[20]。O’Sullivan等发现,b*值与感官评定人员的评定相关[21],这与本文b*值与菌落总数的显著相关的结论一致,因此可以用b*值作为肉品品质腐败指标。从表2中依然可以看出,微生物数量与pH值相关性不大(P>0.5),这一结果与文献[20]结果一致。
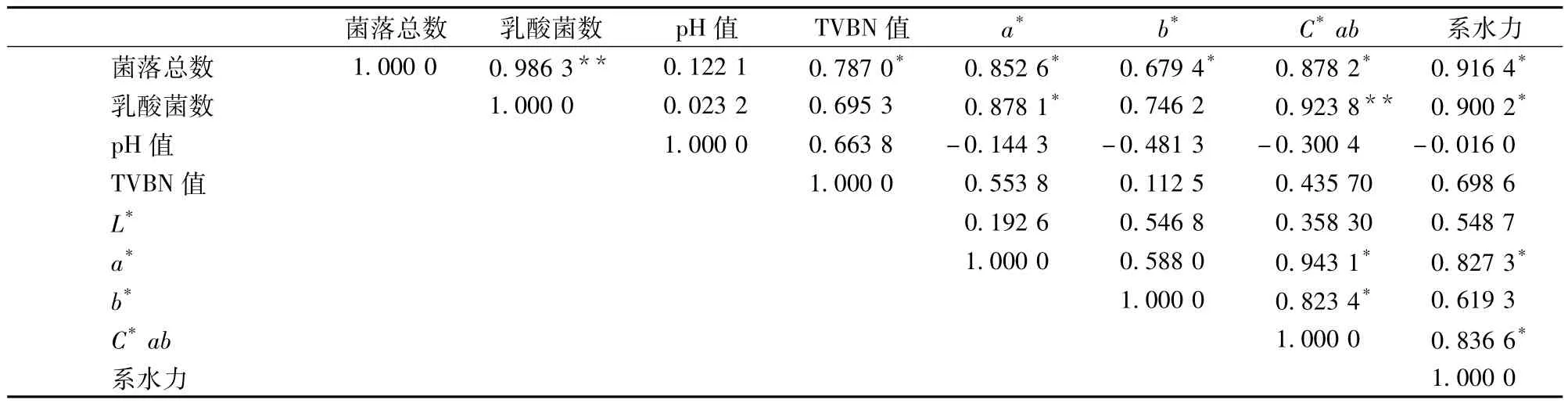
表2 真空包装牛肉在4℃下各品质指标的Pearson相关系数
3 结论
真空包装牛肉在贮藏过程中,随着时间的延长,菌落总数上升,其乳酸菌生长迅速,假单胞菌、热杀索丝菌及肠杆菌在真空包装下能够生长。真空包装有助于色泽稳定,a*值、C*ab值初期上升,后期小幅下降;对汁液损失有小幅影响。菌落总数与乳酸菌在0.01水平上呈现极显著相关的关系,与TVBN值、a*值、b*值、C*ab及汁液损失在0.05水平上显著相关,但与pH值相关性不大。在第28天时TVBN值超过15 mg/100g,此时牛肉已经腐败。可以用TVBN值、a*值、b*值、C*ab作为真空包装牛肉品质腐败指标来确定冷却肉的微生物污染状况。
[1] Pennacchia C,Ercolini D,Villani F.Spoilage-related microbiota associated with chilled beef stored in air or vacuum pack [J].Food Microbiology,2011,28(1):84 -93.
[2] Castellano P,González C,Carduza F,et al.Protective action of Lactobacillus curvatus CRL705 on vacuum-packaged raw beef.Effect on sensory and structural characteristics[J].Meat Science 2010,85(3):394-401.
[3] Ercolini D,Ferrocino I,LaStoria A.Development of spoilage microbiota in beef stored in nisin activated packaging[J].Food Microbiology,2010,27(1):137 -143.
[4] 李飞燕,张一敏,王秀江,等.冷却牛肉贮藏过程中品质变化的研究[J].食品与发酵工业,2011,37(3):182-185.
[5] 李苗云,张秋会.冷却猪肉贮藏过程中腐败品质指标的关系研究[J].食品与发酵工业,2008,34(7):168-171.
[6] Katikou P,Ambrosiadis I,Georgantelis D.Effect of Lactobacillus-protective cultures with bacteriocin-like inhibitory substances’producing ability on microbiological,chemical and sensory changes during storage of refrigerated vacuumpackaged sliced beef[J].Journal of Applied Microbiology,2005,99(6):1 303 -1 313.
[7] Borch E,Kant-Muemans M L,Blixt Y.Bacterial spoilage of meat products and cured meat[J].Food Microbiology,1996,33(1):103-120.
[8] Liu F,Guo Y Z,Li Y F.Interactions of microorganisms during natural spoilage of pork at 5℃[J].Journal of Food Engineering,2006,72(1):24-29.
[9] Sakala Rita M,Hayashidani Hideki,kato Y,et al.Change in the composition of the microflora on vacuum-packaged beef during chiller storage[J].International Journal of Food Microbiology,2002,74(1/2):87 -99.
[10] Koutsoumanis K P,Stamatiou A P,Drosinos E H.Control of spoilage microorganisms in minced pork by a self-developed modified atmosphere induced by the respiratory activity of meat microfiora[J].Food Microbiol,2008,25(7):915-921.
[11] Buys E M,Kruger J,Nortje G L.Cent ralised bulk prepackaging of fresh pork retail cuts in various gas atmospheres[J].Meat Science,1994,36(3):292 -297.
[12] Yano Y,Kataho N,Watanabe M,et al.Changes in the concentration of biogenic amines and application of tyramine sensor during storage of beef[J].Food Chem,1995,54(2):155-159.
[13] De Pablo B,Asensio M A,Sanz B,et al.The D( -)lactic acid and acetoin/diacetyl as potential indicators of the microbial quality of vacuum-packed pork and meat products[J].J Appl Bacteriol,1989,66(3):185 - 190.
[14] Faustman C,Specht S M,Malkus L A,et al.Pigment oxidation in ground veal:Influence of lipid oxidation,iron and zinc[J].Meat Science,1992,31(3):351 -359.
[15] Mancini R A,Hunt M C.Current research in meat color[J].Meat Science,2005,71(1):100 -121.
[16] Jakobsen M,Bertelsen G.Colour stability and lipid oxidation of fresh beef.Development of a response surface model for predicting the effects of temperature,storage tine,and modified atmosphere composition [J].Meat Science,2000,54(1):49-57.
[17] Kim Y H,Keeton J T,Yang H S,et al.Color stability and biochemical characteristics of bovine muscles when enhanced with L-or D-potassium lactate in high-oxygen modified atmospheres[J].Meat Science,2009,82(2):234-240.
[18] Gill C O.Extending the storage life of raw chilled meats[J].Meat Science,1996,43(Supplement 1):99 -109.
[19] Gill C,Dussault R,Holley R A,et al.Evaluation of the hygienic performances of the processes for cleaning,dressing and cooling of pig carcasses in eight packing plants[J].International Journal of Food Microbiology,2000,58(1/2):65-72.
[20] Byun JS,Min JS.Comparison of indicators of microbial quality of meat during aerobic cold storage[J].J Food Prot,2003,66(9):1 733 -1 737.
[21] O'Sullivan M G,Byrne D V,Martens,et al.Evaluation of pork colour:Prediction of visual sensory quality of meat from instrumental and computervision methods of colour analysis[J].Meat Science,2003,65(2):909 - 918.
