自体脂肪及筋膜植入犬声门旁间隙及固有层的实验研究*
2012-01-11胡慧英徐文范尔钟张丽
胡慧英 徐文 范尔钟 张丽
继发于单侧声带麻痹、声带沟、声带萎缩、声带瘢痕等原因的声门闭合不良,可引发明显的发声及吞咽障碍,严重影响患者的生活质量。声带填充术已广泛应用于声门闭合不良患者的治疗,但是填充物的选择仍然存在争议。既往研究[1,2]采用脂肪、明胶海绵等大颗粒物质植入声门旁间隙,但植入物存活时间有差异,而是否会影响手术效果也有分歧。本研究通过建立声带麻痹动物模型,研究自体脂肪、筋膜移植入声带后的局部病理反应,探讨填充物作用机制及影响填充效果的因素,以期指导临床应用。
1 材料与方法
1.1实验动物与分组 选择叫声响亮的健康杂种实验用犬(普通级)16只(因术中操作失败及喉部严重感染死亡4只,未计入),雌雄不限,年龄1.5~2.0岁,体重10.7~12.5 kg。实验前经0°鼻内镜检查,犬喉部形态及声带运动均正常。16只犬的32侧声带,除正常对照组2侧声带不做任何手术处理外,其余30侧声带在建立声带麻痹动物模型后,按照不同的植入材料、植入方式、植入部位和植入后观察时间进行分组(表1)。

表1 实验用声带分组(侧)
1.2声带麻痹动物模型制备 除正常对照组声带外,其余实验用犬以速眠新II注射液(0.15~0.2 ml/kg)麻醉,控制麻醉深度在III期1级,颈部正中切口,于第3、4气管环平面用手术刀片截除喉返神经1.0 cm,断端局部筋膜包埋,缝合切口,观察1周后进行后续手术。
1.3自体填充物质获取 切开犬腹部获取脂肪,去除周围组织后备用,自体筋膜组织取自犬腹直肌筋膜,剪成约1 mm×1 mm的小碎块放入1 ml注射器中备用,或约5 mm长以湿纱布包裹备用。
1.4全麻下声带填充物植入
1.4.1声门旁间隙脂肪注射 支撑喉镜下,在鼻内镜系统监视下应用Brunning高压注射器将脂肪注入声门旁间隙,注射量为0.5~1 ml。
1.4.2声门旁间隙脂肪填充 颈部正中切口,暴露甲状软骨,正中裂开,彻底止血,在声带上表面与喉室交界处、声带外侧切口,约1 ml脂肪块完全植入声门旁间隙,关闭甲状软骨,缝合切口。
1.4.3声门旁间隙筋膜注射 用上颌窦穿刺针在甲状软骨板前下1/3处进针,插入声门旁间隙,缓慢注入筋膜0.5~1 ml,直至声带边缘凸起为止。
1.4.4声带固有层筋膜填充 支撑喉镜下,在显微镜下应用喉部显微手术器械切开声带表面黏膜,将条状筋膜填充于声带黏膜下,以8-0丝线缝合黏膜切口。
所有实验犬术后注射广谱抗生素1周,流食3日后正常饲养。
1.5组织病理学观察 于术后第1周、1、3、6、12个月用0°鼻内镜观察喉部形态及运动后,完整切取犬喉,常规石碏包埋。沿犬喉冠状面自前联合至声带突全喉切片,进行HE染色及Masson染色。高倍光学显微镜下观察填充的脂肪和筋膜的生长特性,如填充物的存在状态、吸收情况、异物反应等。40倍光学显微镜下获得清晰的病理切片图像,以Adobe Photoshop CS2软件在1 024×768分辨率及25%缩放比例下进行图像的量化分析(每侧标本选取有观察部位的全部切片,观察部位的数据取均值),分别计算单位面积(cm2)炎性细胞、纤维母细胞及新生血管个数、胶原纤维面积占图像面积的百分比,以标尺工具计算填充物周围纤维包膜厚度。
1.6统计学分析 所有数据由计算机统一收集,采用SPSS13.0统计软件,组间比较用独立样本的t检验及方差分析或非参数检验。
2 结果
2.1内窥镜下犬声带大体形态 自体脂肪与筋膜植入术后1个月内,70.0%(21/30)术侧声带出现充血、水肿,均于术后3个月内消失,其中筋膜注射组反应出现比例最低(1/8)(图1、2)。
自体脂肪或筋膜植入后第1周均可见术侧声带体积饱满,呼气期末可内收超越中线,声门闭合良好。术后第3个月,术侧声带体积明显缩小。填充物剩余体积观察:筋膜注射组>脂肪注射组>脂肪填充组。术后第6个月时80%的声带可见植入部位隆起,体积趋于稳定。筋膜填充组术后观察期内均可见填充部位隆起(因体积较小未测量)。
2.2实验侧声带光镜观察结果 自体脂肪、筋膜植入声带后,可见植入物与周围正常声带组织间有较明确的界限。脂肪植入部位可见成活的团状脂肪细胞存在,其间夹杂部分破碎的脂肪大泡;筋膜组织以密度较高的胶原纤维形式存在。植入部位组织病理学表现主要为:炎性浸润、纤维形成(主要是Ⅰ型胶原纤维,呈不规则束状,分布较均匀)、纤维母细胞形成、新生血管形成及纤维包膜形成(图3~5)。病理变化依填充物、填充方式和观察时间而不同。
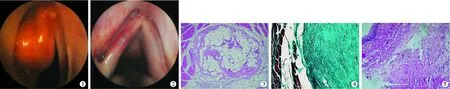
图1 左声带脂肪注射后1周纤维喉镜图像 左声带饱满,内移,声门闭合好图2 左声带筋膜填充表面丝线缝合图3 脂肪注射后6月声带光镜观察图 可见纤维包膜及脂肪细胞存活(HE×40)图4 筋膜注射后1月声带光镜观察图 纤维均匀,纤维包膜形成(Masson×40)图5 筋膜填充后3月声带光镜观察图 纤维排列,无明显包膜(HE×100)
脂肪植入组1周时有炎性反应,脂肪内新生血管形成出现于术后3月,同时填充物周围组织形成少量纤维结缔组织分隔脂肪填充物,即形成纤维包膜,3月时包膜厚度最大,与周围组织分界清楚。6月后纤维母细胞出现,12个月时脂肪填充物仍然存在,填充物周围组织未见坏死及萎缩。
筋膜注射组病理学表现主要是胶原纤维形成,呈束状排列不规则,分布较均匀,随时间推移密度无明显变化。术后1月植入部位有纤维母细胞,同时纤维包膜形成,术后3个月时包膜厚度值最大,与周围组织分界清楚,术后12个月时纤维包膜消失。术后12个月时筋膜注射部位始有新生血管形成。
筋膜填充组胶原纤维密度随时间推移逐渐降低,在术后第1、3个月时胶原纤维密度最大,筋膜植入部位于第1个月时观察到纤维母细胞,都以椭圆形纤维母细胞为主,3个月后筋膜组织呈漩涡状排列,6个月后椭圆形纤维母细胞密度增大,填充部位有新生血管形成。纤维包膜厚度较低,6个月后消失。第12个月时其密度与周围组织趋于一致,筋膜植入部位纤维排列较密,与声带固有层组织无明显分界。
脂肪注射组观察期内除2侧声带分别于术后1、3个月时病理切片未发现填充物外,其余8侧声带与脂肪填充组在各观察时间点上形态学表现基本一致,组织病理学表现差异无统计学意义,因此合并为脂肪植入组进行分析(表2、3)(其中表2为所有观察时间点数据的均值)。从表3可见,脂肪植入组纤维母细胞出现比例(4/15)小于筋膜植入组(9/15),而新生血管形成比例(7/15)大于筋膜植入组(3/15)。
3 讨论
声带填充术是将自体或异体生物材料注射或填充至声带不同层次或声门旁间隙,使声带体积增加、游离缘内移,以改善声门闭合状况及声带振动特性,恢复发音及吞咽功能。目前对于声带麻痹及声带萎缩引起的声门闭合不全,多用脂肪、明胶海绵等大颗粒物质填充,其粘弹性特性不影响声带振动。而声带沟位于声带固有层,在固有层内填充筋膜的同时,还要在声门旁间隙注射脂肪[1,2]。
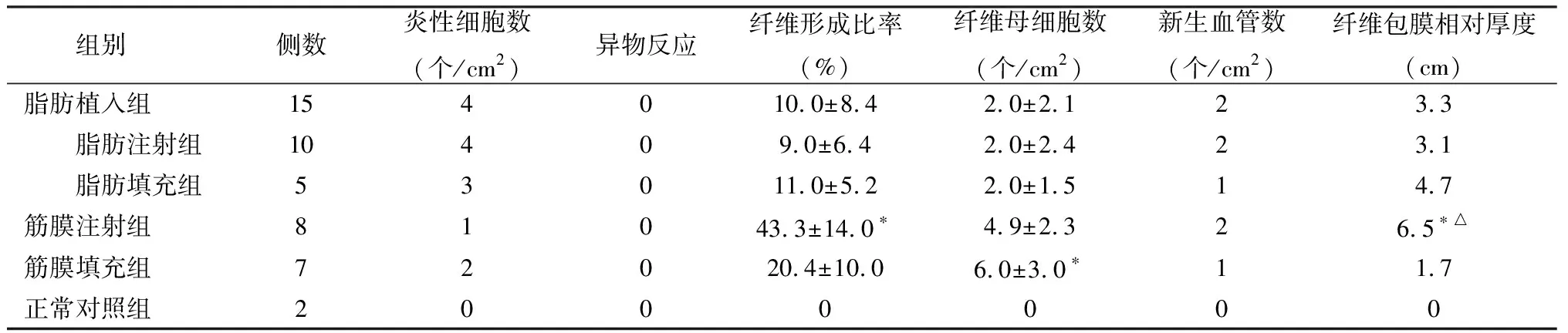
表2 各组术后声带组织切片光镜下观察结果
注:*与脂肪植入组比较,P<0.05;△与筋膜填充组比较,P<0.05
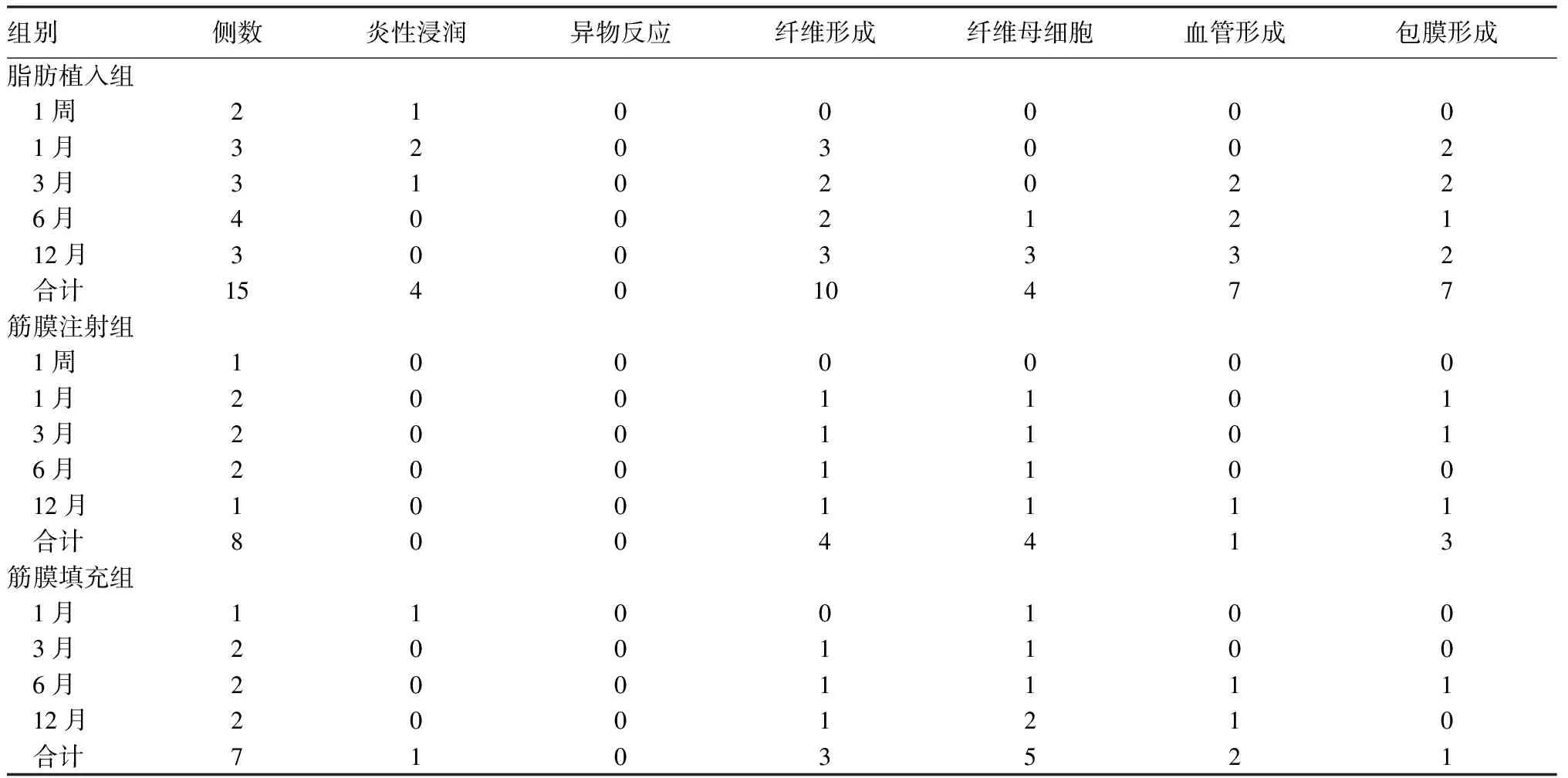
表3 各组各观察时间点声带组织光镜下病理变化出现侧次(侧)
脂肪与其他填充材料相比可以最大程度恢复声带振动特性,缺点是会被吸收。对于脂肪的吸收率有不同研究结果。Kruschewsky等[3]通过磁共振技术研究了犬单侧声带麻痹后的脂肪吸收率,结果显示在植入后3个月时脂肪注射吸收率为82%,Ⅰ型甲状软骨成型术脂肪填充吸收率为71%。徐文等[4]研究发现,注射脂肪后的第1个月吸收最为明显,达30 %~35 %,术后18个月时患者发声仍有明显改善。温武等[5]通过测量发现自体脂肪声带注射后12个月时声带体积仍有增大。本研究发现,脂肪注射填充物体积明显减少出现于术后第1、3个月,但声门闭合良好。有研究显示,脂肪组织在术后第3个月时几乎全部消失,由纤维母细胞和巨噬细胞代替[5,6]。本研究组织病理学检查显示术后植入部位确实存在有活性的脂肪填充物,其中间及周围为新生毛细血管、纤维母细胞及大量胶原纤维充斥,显示有纤维化存在,在术后12个月时仍有大量有核脂肪细胞存在。正如Brandenburg等[7]指出,术后即便脂肪组织有损坏,纤维组织也可以代替损坏的脂肪,保持声带的轮廓和体积。
自体筋膜填充于声带固有层治疗声带固有层缺陷疗效良好[2,8],但尚缺乏组织病理研究来证实。本研究显示筋膜组织填充后在形态上可与周围组织区分开来,填充后3个月与周围组织无明显分别,开始有纤维细胞及纤维母细胞长入,细胞密度较高,以椭圆形纤维母细胞为主,而这种有活性的纤维母细胞具有分泌细胞外基质的作用,使填充后的筋膜与声带本身生物学特性更接近。由于填充的筋膜存在时间较长,能很好的起到支架作用,使声带本身纤维组织、纤维母细胞及其他细胞外基质成份充分长入。筋膜与声带固有层周围组织无明显纤维包膜形成,显示自体筋膜与声带有很好的生物相容性,与植入部位结合良好。6个月后筋膜组织与声带固有层结构趋于一致,提示声带沟筋膜植入术后的患者,嗓音大幅度的改善理论上应该出现于术后6个月左右。筋膜注射于声门旁间隙和填充于固有层,两种植入方法炎性反应均轻微,随植入部位不同,反应有所差异,植入物周围纤维包膜形成比例高,与周围组织界限清晰。
可见,脂肪填充于声门旁间隙,相对于筋膜,更能起到介质作用,使周围的新生血管及活性纤维母细胞长入,这些新生成分的营养支持作用促进了植入的脂肪细胞的存活,但随时间的推移,有一定的吸收率,但仍可以起到填充效果。而筋膜注射于声门旁间隙后,是以胶原纤维的结构形式长期存在于植入部位,纤维母细胞出现的密度较大,因此筋膜移植物存在时间长,重吸收现象不显著;但是由于筋膜的大量取材及注射方式受限,在一定程度上限制了其临床应用。
本研究中脂肪注射组有2侧声带病理切片未发现明确填充物存在,分别出现于术后1个月和3个月,分析原因,考虑为注射部位过于表浅、脂肪自声带注射部位排出有关,因此术中脂肪注射入声门旁间隙内的深度控制非常重要。另外,由于本实验中无法控制犬很好地声休,致使术后1周时一例犬声带填充筋膜脱落(记为操作失败未计算在内),可见术后声休有利于筋膜在植入部位的生长。因此,声带填充术中应注意,脂肪注射应采用多点分散注射,要注射在声门旁间隙内,且要注射到一定深度;术后一定时期内限制声带过度活动,避免填充物排出或脱落,为新生物质生长提供基础。随着组织工程技术、分子生物学、基因治疗等技术的进一步发展,相信声带填充技术必将拥有更广阔的研究前景和临床应用价值。
4 参考文献
1 Rihkanen H. Vocal fold augmentation by injection of autologous fascia[J]. Laryngoscope, 1998, 108(1 Pt1):51.
2 徐文,韩德民,侯丽珍,等.自体筋膜移植填充治疗声带沟[J].中华耳鼻咽喉头颈外科杂志,2006,41:591.
3 Kruschewsky LS, de Mello-Filho FV, dos Santos AC, et al. Autologous fat graft absorption in unilateral paralyzed canine vocal folds[J]. Laryngoscope, 2007,117:96.
4 徐文,韩德民,侯丽珍,等. 声带外侧自体脂肪注射填充术治疗声门闭合不良[J].中国耳鼻咽喉头颈外科,2006,13:499.
5 温武,周水淼,杨心青,等. 自体脂肪声带内注射术治疗单侧声带麻痹的远期疗效观察[J].中华耳鼻咽喉科杂志,2004,39:204.
6 Laccourreye O, Papon JF, Kania R, et al. Intracordal injection of autologous fat in patients with unilateral laryngeal nerve paralysis: long-term results from the patient’s perspective[J]. Laryngoscope, 2003, 113: 541.
7 Brandenburg JH, Unger JM, Koschkee D. Vocal cord injection with autogenous fat: a long-term magnetic resonance imaging evaluation[J]. Laryngoscope 1996, 106:174.
8 Tsunoda K, Takanosawa M, Niimi S. Autologous transplantation of fascia into the vocal fold: A new phonosurgical technique for glottal incompetence[J]. Laryngoscope, 1999, 109:504.
