制备单抗偶联载阿霉素白蛋白免疫毫微球的初步研究
2012-01-06戚宁杜明华张东生张佳刘凤
戚宁,杜明华,张东生,张佳,刘凤
(1.东南大学医学院,江苏南京 210009;2.江苏省中医院核医学科,江苏南京 210029)
阿霉素(注射用盐酸多柔比星,doxorubicin,DOX)是由链丝霉菌属发酵液分离得到的抗有丝分裂和细胞毒性抗生素,也可由柔红霉素来合成,其抗肿瘤谱广,活性强,作用机制主要是阿霉素分子嵌入DNA抑制核酸的合成,对实体瘤如肝癌、乳腺癌、肺癌等具较好的疗效,是肿瘤化疗方面最重要的药物之一。
白蛋白作为抗肿瘤药物载体,是一种无毒、无抗原性、生物相容性好、易降解且性质稳定的微球材料,有实验证实这种微球具有缓释特性,并可以有效改变药物的组织分布,延缓药物释放[1-2]。
肿瘤化疗效果与药物作用的部位和持续的时间有关,药物到达血液系统时,传统药物剂型不能有效调整药物在体内的分布和清除,药物在非靶位的积累将引起全身毒副作用,于是有学者开始研究制备可以特异杀伤肿瘤的具有靶向性的免疫纳米粒[2-5]。本实验以阿霉素为模型药物,牛血清白蛋白为药物载体制备白蛋白纳米球,再与抗人肝癌甲胎蛋白(AFP)单克隆抗体进行交联制成免疫纳米球,以提高药物对肿瘤细胞的特异性选择,降低药物毒副作用,提高疗效。有药物和毒素等直接与单克隆抗体结合的研究报道[6],但未见载阿霉素纳米粒与抗人肝癌AFP单克隆抗体交联的报道。
1 材料和方法
1. 1 药品试剂
注射用盐酸多柔比星(深圳万乐药业有限公司),牛血清白蛋白(BSA,Sigma公司),氢氧化钠(NaOH,0.01 mmol·L-1,自配);pH 试纸(上海三爱思试剂有限公司),单克隆抗体AFP(鼠抗人,上海叶民生物科技有限公司),异型蛋白质功能交联剂(SPDP,Sigma公司),胰蛋白酶(美国Amresco公司),二硫苏糖醇(DTT,Sigma公司),无水乙醇(分析纯,上海凌峰化学试剂有限公司),透析袋,双蒸水。
1. 2 仪器
85-2A数显测速恒温磁力搅拌器(江苏省金坛市荣华仪器制造有限公司),DF-101S集热式恒温加热磁力搅拌器(郑州长城科工贸有限公司),LGF-12冷冻干燥机(北京忪源华兴科技发展有限公司),摇床,离心机(美国),电泳仪,紫外分光光度计,透射电镜(JEM-2100HR,日本)。
1. 3DOX-BSA-NP 的制备、检测
经过预实验和总结文献资料,经过优化[2,5],去溶剂化法制备工艺如下:精密称取200 mg BSA与5 mg DOX溶液轻微振荡混匀,磁力搅拌一定时间后,NaOH调节溶液使之pH为9,磁力搅拌下缓慢滴入无水乙醇约 25 ml,滴加速度约为 1 ml·1 min-1,搅拌适当时间后加入25%戊二醛溶液,继续磁力搅拌,固化过夜,次日离心,弃去上清液,蒸馏水洗涤3次,用双蒸水定容成悬液状。-20℃冷冻后,真空低压干燥,得冻干粉,装入小瓶,存于冰箱冷冻层备用。
检测:(1)确定DOX测定波长:适量浓度DOX用生理盐水溶解,以生理盐水为参比调零,紫外分光光度计波长扫描。(2)绘制标准曲线:精密称取干燥至恒重的阿霉素标准品适量,用水溶解定容至50 ml,配成200 μg·ml-1的储备液,分别吸取 0.50、0.80、1.10、1.40、1.70、2.00 ml于 10 ml的容量瓶中,定容配成标准液,以蒸馏水为空白,480 nm处测得吸光度A,以质量浓度ρ对吸光度A线性回归。(3)载药量、包封率测定:精密称取DOX-BSA-NP适量,加0.1%的胰蛋白酶的生理盐水液,避光,37℃恒温磁力搅拌至澄清,转移到100 ml容量瓶中,定容、过滤,取滤液,在480 nm处测紫外吸光度,带入标准曲线计算药物含量。载药量=纳米粒中阿霉素的含量/纳米粒的总质量;包封率=纳米粒中阿霉素的含量/阿霉素的投药量。(4)体外释药特性观测:精密称取适量DOX-BSA-NP,生理盐水溶解,超声分散均匀,转入预先处理过的透析袋内,将透析袋悬至在盛有生理盐水的大烧杯中,37℃恒温振荡,定时取样3 ml,同时补加入同体积生理盐水,测样品480 nm处的吸光度A。由回归直线方程计算不同时间点药物质量浓度,以各时间点为横坐标,累积释药分数为纵坐标,绘出体外释药曲线。
1. 4 antiAFP-DOX-BSA-NP 的制备、鉴定
制备:参考文献[6-7]方法,将活化的纳米粒与单抗-PDP混合,4℃轻摇反应约15 h。经Hank's液洗涤4 次,15 000 r·min-1,45 s,得沉淀即为免疫毫微球。
鉴定:(1)聚丙烯酰胺凝胶电泳测定共价连接:取antiAFP-DOX-BSA-NP和抗体AFP与足量上样缓冲液反应后上样。以antiAFP-DOX-BSA-NP与不加还原剂的上样缓冲液做对照组,抗体AFP为空白组。80 V稳压,约30 min进入分离胶,调稳压至100 V,1 h后剥离胶板,于考马斯亮蓝染色液中染色1 h,再用脱色液脱至样品带清晰。(2)电镜观测粒径大小及形态:经超声均匀分散的微球悬液滴在铜网上,按倍数稀释,空气中干燥后,电镜下观察。
2 结 果
2. 1 DOX吸收光谱测定
于300~800 nm扫描得阿霉素最高吸收峰在480 nm,见图1。
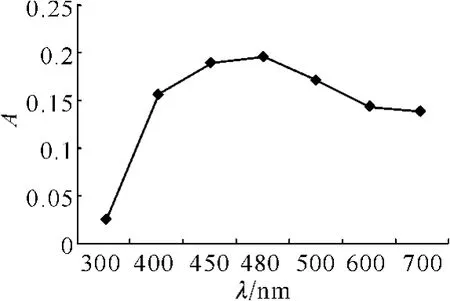
图1 阿霉素(50 μg·ml-1)吸收光谱图Fig 1 The absorption spectrum image of doxorubicin(50 μg·ml-1)
阿霉素药量质量浓度对光吸光度A进行直线回归,得标准曲线线性回归方程为:Y=3 347.7X-54.644,相关系数r=0.994 2。计算DOX-BSA-NP的有效载药量约为1.8%,包封率约为90.3%。见图2。
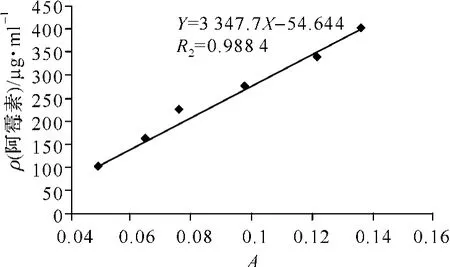
图2 阿霉素质量浓度与吸光度A成明显的线性比例关系Fig 2 The concentration of DOX is clearly linearly proportional to the absorbance
DOX-BSA-NP形态学性质观察:冻干粉剂外观为红色,再溶解性好。电镜下观察呈圆球状,表面光滑,分散性好,粒径均匀,粒径范围80~160 nm。见图3~4。

图3 DOX-BSA-NP外观图Fig 3 The outside view of the DOX-BSA-NP
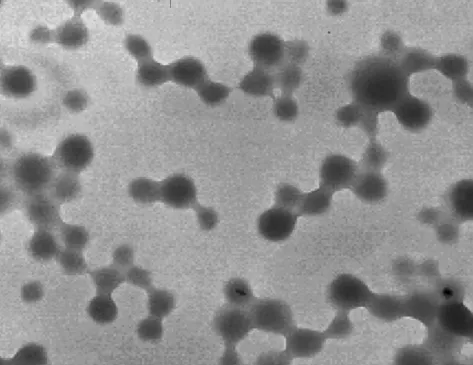
图4 DOX-BSA-NP的电镜照片(×25 000)Fig 4 The TEM image of DOX-BSA-NP(amplification factor 25 000)
体外释药性质检测:DOX-BSA-NP释药呈持续缓慢状态,至第7天累计释药分数达95%。透析袋对药物的释放也有一定的限速作用。见图5。
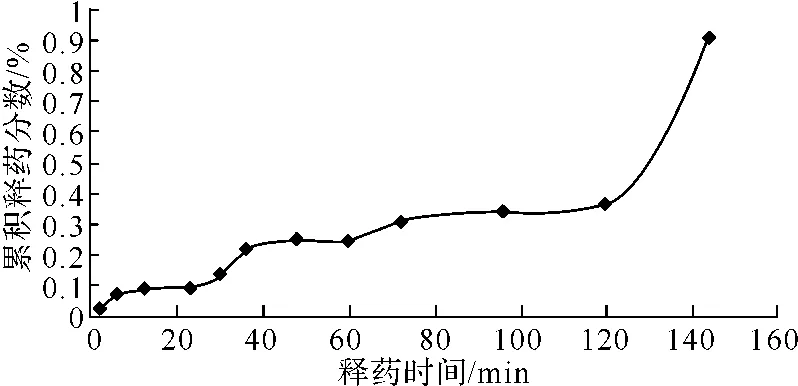
图5 DOX-BSA-NP体外释放的累积释放率-时间曲线Fig 5 The curve of the accumulation release rate in vitro-time of DOX-BSA-NP
2. 2 免疫毫微球的鉴定
还原电泳分析:加还原剂的一组antiAFP-DOXBSA-NP在远端有两条电泳条带,与抗体加还原组的两条条带位置相同,推测为抗体被分解为轻重两条链所形成的对应的条带。未加还原剂的antiAFP-DOXBSA-NP未见电泳条带说明微球与其表面的抗体不是通过离子键连接。未还原的抗体在近端形成一条较粗的电泳条带,符合AFP分子量大小所在位置。
免疫毫微球的电镜观测结果显示,免疫毫微球呈直径330~400 nm的圆球形,大小尚均匀,但分散性欠佳,有轻度的融合。

图6 免疫毫微粒电镜照片(×10 000)Fig 6The TEM image of antiAFP-DOX-BSA-NP(amplification factor 10 000)
3 讨 论
化疗药物需达到一定浓度才能有效杀伤肿瘤细胞,起到化疗作用,增大药量可达此目的,但同时增大了药物对正常组织的毒副作用。单抗特异性高,对肿瘤的亲和力强,对正常细胞损伤也很小,有超过200种基于单抗或其片段的载药系统处于临床前期或临床研究之中[5],并已成为导向治疗最常用的载体。阿霉素抗瘤谱广,可用于多种实体瘤,但其心脏毒性作用限制了临床应用,因此有关阿霉素纳米粒的研究备受关注。提高肿瘤纳米靶向治疗疗效,降低用药量,减少副作用,已成为药物研制的热点和前沿[8]。阿霉素纳米微球是目前较有代表性的抗癌靶向制剂之一[9-11]。本实验旨在制备阿霉素白蛋白纳米粒,同时与甲胎蛋白单抗偶联,制成免疫毫微粒,并初步观测其形态、粒径大小,以期用于临床肿瘤治疗。
载药微球经静脉注射后,在体内的分布首先取决于微粒的粒径大小。通常粒径在2.5~10 μm时,大部分积集于巨噬细胞。大于7 μm的微粒通常被肺的最小毛细血管床以机械滤过方式截留,被单核白细胞摄取进入肺组织或肺气泡。小于7 μm时一般被肝、脾中的巨噬细胞摄取,200~400 nm的纳米粒集中于肝后迅速被肝清除,小于10 nm的纳米粒则缓慢积集于骨髓[1,3]。纳米制剂制备的关键是控制粒子的大小以获得均匀粒度分布[12]。实验中发现,白蛋白浓度越低,成球率越低;无水乙醇滴加量过多,滴加速度过快,都容易产生沉淀,导致聚集失败;搅拌速度过慢,滴加入的乙醇局部浓度过高,产生的微球粒径大小易不均匀。另外,白蛋白溶液浓度、搅拌速度、温度、交联剂用量等都会影响药物从微球中释放的速度。
免疫毫微粒是以肿瘤特异性抗体为导向载体,将药物吸附或包封在白蛋白等生物可降解材料中,经固化分离而成的粒径为纳米级的胶态固体颗粒,载药量较大,具有缓释作用,通过抗体特异性的导向作用对肿瘤细胞选择性结合杀伤[11]。免疫微球是抗体或抗原被包裹或吸附于聚合物微球上而具有免疫活性的,除作为抗癌药的靶向治疗,还可用来标记、分离细胞和疾病的诊断和治疗[9-10,13]。
已有的蛋白质连接方法包括戊二醛法、重氮化法、Mannich法等20余种[7]。用戊二醛交联的缺点是醛基可产生抗体与抗体之间的聚合,降低抗体的活性,优点是操作简单[3,12]。本实验所用的交联剂SPDP是条件温和、专一的异型双功能交联剂[14],原理为:SPDP能分别与两种蛋白质结构中的伯氨基反应,引入吡啶二硫基,用DTT将其中之一的吡啶二硫基还原成-SH,含有吡啶二硫基的蛋白于另一含-SH的蛋白发生巯基-吡啶二硫基交换,使两种蛋白质偶联。本实验结果表明,该方法可以成功制备单抗导向的免疫毫微粒,还原电泳分析证明了两者之间的共价连接。实验将进一步研究用放射性核素标记该免疫毫微粒,观察和检测其免疫特性及体内外的抗肝癌效果。
[1]RAHIMNEJAD M,JAHANSHAHI M,NAJAFPOUR G D.Production of biological nanoparticles from bovine surum albumin for drug delivery[J].Biotechnology,2006,5(20):1918-1923.
[2]FELIX K.Albumin as a drug carrier:design of prodrugs,drug conjugates and nanoparticles[J].J Control Release,2008,132:171-183.
[3]JAMES D B,BETANCOURT T,BRANNON-PEPPAS L.Active targeting schemes for nanoparticle systems in cancer therapeutics[J].Adv Drug Deliv Rev,2008,60(15):1615-1626.
[4]LI F Q,SU H,WANG J,et al.Preparation and characterization of sodium ferulate entrapped bovine serum albumin nanoparticle for liver targeting[J].Int J Pharm,2008,349(1-2):274-282.
[5]LI Q Y,LIU C,ZHANG X H,et al.Preparation,characterization and targeting of micronized 10-hydroxycamptothecin-loaded folate-conjugated human serum albumin nanoparticles to cancer cells[J].Int J Nanomedicine,2011,6:397-405.
[6]DAN P,KARP J M,HONG S,et al.Nanocarriers as an emerging platform for cancer therapy[J].Nat Nanotechnol,2007,2(12):751-760.
[7]CARLSSON J,DREVIN H,AXEN R.Protein thiolation and re-versible protein-protein conjugation[J].Biochem J,1978,173(6):723-737.
[8]曲秋莲,张英鸽.纳米技术和材料在医学上应用的现状与展望[J].东南大学学报:医学版,2011,30(1):157-163.
[9]HAUN J B,DEVARAJ N K,HILDERBRAND S A,et al.Bioorthogonal chemistry amplifies nanoparticle binding and enhances the sensitivity of cell detection[J].Nat Nanotechnol,2010,5(9):660-665.
[10]SHI M,LU J,SHOICHET M S.Organic nanoscale drug carriers coupled with ligands for targeted drug delivery in cancer[J].J Mater Chem,2009,19:5485-5498.
[11] BRANNON-PEPPAS L,BLANCHETTE J O.Nanoparticle and targeted systems for cancer therapy[J].Adv Drug Deliv Rev,2004,56(11):1649-1659.
[12]王子妤,王丽,张东生.纳米雄黄脂质体的制备﹑特性检测和体外抗肿瘤细胞作用的研究[J].东南大学学报:医学版,2009,28(3):175-179.
[13]SHI M,HO K,KEATING A,et al.Doxorubicin-conjugated immuno-nanoparticles for intracellular anticancer drug delivery[J].Adv Funct Mater,2009,19:1689-1696.
[14]MAHMOUDIAN J,JEDDI-TEHRANI M,RABBANI H,et al.Conjugation of R-phycoerythrin to polyclonal antibody and F(ab')2 fragment of a polyclonal antibody by two different methods[J].Avicenna J Med Biotechnol,2010,2(2):87-91.
