运动与IL-6shRNA干扰影响胰岛素抵抗发生的作用及其机制研究
2012-01-06蔡建光
唐 晖,雷 雨,周 亮,蔡建光
(1.湖南科技大学体育学院,湖南 湘潭 411201;2.铜仁学院体育系,贵州 铜仁 554300)
运动与IL-6shRNA干扰影响胰岛素抵抗发生的作用及其机制研究
唐 晖1,雷 雨2,周 亮1,蔡建光1
(1.湖南科技大学体育学院,湖南 湘潭 411201;2.铜仁学院体育系,贵州 铜仁 554300)
目的:探讨运动是否通过IL-6抑制胰岛素抵抗的发生,以及p38MAPK信号蛋白在此的可能作用。方法:大鼠高脂饮食8周以形成胰岛素抵抗,通过葡萄糖钳夹实验确定胰岛素抵抗是否发生;在此过程中采用8周跑台运动和/或IL-6shRNA载体注射干预,检测血清IL-6、空腹胰岛素、空腹血糖、葡萄糖输注率、各组织IL-6基因表达水平及磷酸化p38活性等指标。结果:高脂饮食8周形成胰岛素抵抗,IL-6shRNA注射组各组织IL-6mRNA水平与对照组相比显著降低(P<0.05,或P<0.01);8周有氧运动显著降低胰岛素抵抗发生,但是运动注射IL-6shRNA组的胰岛素抵抗与运动不注射注射IL-6shRNA组相比葡萄糖输注率显著降低(P<0.05,或P<0.01),高脂饮食大鼠磷酸化p38显著升高,运动高脂饮食大鼠与之相比显著降低(P<0.05,或 P<0.01),但是运动注射IL-6shRNA组大鼠磷酸化p38的变化却没有明显规律。结论:运动抑制胰岛素抵抗的发生可能通过激活IL-6和/或下调p38MAPK信号通路而起作用。
p38MAPK;运动;IL-6shRNA;胰岛素抵抗
运动可以抑制胰岛素抵抗发生,改善肥胖、糖尿病等代谢综合症的症状,然而其分子机制仍然不太清楚。根据以下文献报道:(1)运动导致机体不同组织,特别是骨骼肌IL-6基因表达和循环血IL-6浓度显著增加[1];(2)IL-6 基因敲除大鼠会形成继发性肥胖[2];(3)肥胖及糖尿病人静息血清IL-6浓度与正常人相比显著升高[3];(4)IL-6具有激素样作用,从组织释放出来后进入血液循环,调节机体的糖代谢和脂代谢[4],我们认为运动可能通过IL-6抑制胰岛素抵抗的发生。为此,我们采用RNA干扰技术,通过在体注射IL-6shRNA载体的方法导致IL-6基因沉默,以此来研究运动抑制胰岛素抵抗发生是否通过IL-6起作用。
p38MAPK是与IL-6及胰岛素抵抗关系密切的一条信号通路。p38MAPK在不同刺激引起机体释放IL-6中具有重要作用[5],同时IL-6从组织释放出来以后调节靶组织的信号途径又与激活p38MAPK有关[6]。Hemi的结果表明,肝脏p38MAPK在各种应激刺激下激活,而它的上调在应激引起的胰岛素受体底物1丝氨酸磷酸化和胰岛素抵抗中具有重要作用[7]。因此本研究通过分析运动及RNA干扰抑制IL-6基因表达时机体不同组织的p38MAPK激活来探讨p38MAPK在胰岛素抵抗发生的作用。
1 材料与方法
1.1 shRNA载体构建及在体注射
在预实验中,我们选择了4段IL-6核苷酸序列作为干预靶序列:IL-6-rat-356、IL-6-rat-410、IL-6-rat-479、IL-6-rat-578,并设计一条乱序非编码片段作为空白对照。成功建立这四个片段的shRNA载体后,培养大鼠骨骼肌原代细胞,待细胞融合至70%后,用建立的四种shRNA载体转染细胞,结果表明,4个干预片段的转染率都在80%以上。进行RT-PCR和Western blotting检测,结果表明,骨骼肌细胞 IL-6mRNA水平分别为:正常对照(18.2±3.4)、空白载体对照(17.1±2.8)、IL-6-rat-356(8.4±1.6)、IL-6-rat-410(2.5±0.6)、IL-6-rat-479(5.2±1.9)、IL-6-rat-578(6.1±1.7),骨骼肌IL-6蛋白浓度分别为:正常对照(131.2±35.7)、空白载体对照(120.3±39.1)、IL-6-rat-356(60.2±19.7)、IL-6-rat-410(20.6±11.3)、IL-6-rat-479(30.9±18.7)、IL-6-rat-578(51.4±16.5)。该结果表明载体IL-6-410封闭目的基因效果最好,因此我们选择它作为正式试验的干预载体。
按以下程序制备和注射shRNA载体和空白载体(参照Crosswhite[8]的方法并进行适当修改)。
(1)以250ul Opti-MEM(r)I稀释5ul Lipofectamine(tm)2000,轻轻混匀,室温下孵育5分钟。
(2)以250ul Opti-MEM(r)I分别稀释20ul shRNA或阴性shRNA,轻轻混匀。
(3)孵育5分钟后,混合稀释的shRNA(或阴性shRNA)和稀释的Lipofectamine(tm)2000,轻轻混合,在室温下孵育20分钟,以形成复合物。
(4)在正式实验开始后的第一、三、五、七周的星期一上午8点,根据分组,各大鼠分别尾静脉注射一次300ul shRNA复合物、阴性shRNA复合物或生理盐水。
1.2 试验动物与分组
从中南大学湘雅医学院实验动物中心购买中南72只雄性 Sprague-Dawley(SD)大鼠,3周龄,体重110±10g,分笼饲养,每笼5只,正式实验前自由饮食。饲养笼采用大小鼠独立通风笼IVC,该设备购于苏州市苏杭科技器材有限公司,设备采用自动通风模式。实验动物许可证号:SYXK(湘)2010-0103.动物房恒温24℃,相对湿度55%,自然光照。
适应1周后,72只大鼠随机分为3大组:安静普通饲料组(RN)、安静高脂饲料组(RH)、运动高脂饲料组(EH),每一大组又分为注射生理盐水(SRN,SRH or SEH)、注射空白载体和(BRN,BRH or BEH)注射shRNA载体3个小组(PRN,PRH or PEH),每小组8只。
1.3 动物运动方案
动物适应性喂养1周后,运动组大鼠在跑台上适应性运动2天。两天后运动组大鼠进行8周递增负荷的有氧训练。训练方案参照Jung的报道并进行改进[9],跑台坡度为0,每周训练6天,休息一天,每天训练一次(见表1)。

表1 大鼠8周跑台运动负荷
1.4 动物饮食方案
动物适应性喂养1周后(适应期所有大鼠喂食标准啮齿动物饲料),安静普通饲料大组大鼠喂食标准啮齿动物饲料,安静高脂饲料和运动高脂饲料组大鼠喂食高脂饲料。所有饲料均购自于中南大学湘雅医学院实验动物中心。高脂饲料配方参照 Zhang的报道[10]并进行适当修改。高脂饲料具体配方为:猪油20%、蔗糖20%、蛋黄粉10%、食盐5%、猪胆盐0.3%、标准饲料 44.7%,能量为 4.9kcal/g。
1.5 高胰岛素-正糖钳夹实验
本实验所采取的高胰岛素-正糖钳夹实验方案是根据已有的报道进行的[11]。8周实验完成后,所有动物禁食12小时,然后腹腔注射异戊巴比妥钠(25 mg/kg)麻醉,将大鼠放在微热的实验桌上以保持正常体温。大鼠右颈静脉置一插管以注射葡萄糖和胰岛素,左颈动脉置另一插管以提取血样。葡萄糖和胰岛素溶液储存在两个数字注射泵内,这两个注射泵通过“Y”连接头与颈静脉插管相连。胰岛素(Novolin R,Novo Nordisk Pharmaceuticals,Denmark)以 mU·kg-1·min-1的速率通过颈静脉插管注射,血糖水平通过血糖仪(Surestep,Johnson,USA)连续监测,每隔5分钟调整葡萄糖输注率(glucose infusion rates,GIR)以维持血糖在较高的水平((5.0±0.5)mmol/L)。钳夹在90分钟内达到稳态并维持30分钟的时间,最后60分钟的平均GIR(Mean GIR60-120min)认为是评价机体整体利用葡萄糖水平的重要指标。
1.6 动物宰杀
将钳夹实验时注射葡萄糖和胰岛素前的动脉血样10ml置于一管内,以1000×g的速度离心15分钟以分离血清,分装后放入液氮待测。钳夹实验结束后立即对大鼠断头处死,迅速剪除小块股四头肌、肝脏和腹部白色脂肪组织,放入液氮待测。
1.7 血样测定
空腹血糖采用葡萄糖-过氧化物酶法进行(试剂盒购于南京建成生物有限公司)。空腹血胰岛素与IL-6浓度利用酶联免疫法法测定(试剂盒购于上海康成生物有限公司)。
1.8 Real- time PCR
各组大鼠的IL-6 mRNA水平通过实时定量PCR方法测定。3种组织的总RNA提取使用Trizol试剂盒(购于美国Invitrogen公司,产品编号:#15596-026)。每个样品的2ug RNA通过反转录成cDNA(试剂盒购于MBI Fermentas公司,编号:#K1631)。RT-PCR的基因扩增试剂盒购于美国 ABI公司,产品编号:4309155。RT-PCR扩增程序为:首先在95°C下变性5min,再 72°C5min,然后是 94°C,58°C,72°C 时各20s40次循环,最后55°C下10s。没有cDNA的样品作为阴性对照,每个样品点样三孔。IL-6的前引物序列为:5'TCGAGCCCACCAGGAACGAAA3',后引物序列为:5'TGGCTGGAAGTCTCTTGCGGAGA 3'(84bp)。GAPDH作为看家基因,其前引物序列为:5'CTCATGACCACAGTCCATGC3',后 引 物 序 列 为 5'TTCAGCTCTGGGATGACCTT3'(155bp)。
1.9 Western blotting
总蛋白抽提试剂盒购于美国ProMab公司,产品编号:SJ-200501。用剪刀剪取约0.5mg组织,置于组织匀浆器中,加入1ml总蛋白提取液,匀浆5min~20min直到组织充分破碎,然后冰上放置10~20min后,再匀浆5min~20min,将匀浆液吸出放到1.5ml离心管中。超声3次,每次3s。然后9000rpm离心10min,取适量上清置于新的1.5ml离心管中,-20℃冻存。测定每个样品的总蛋白含量。
将样品体积与样品缓冲液按5:1的比率混匀,样品缓冲液的组成为:0.6ml 1mol/L的Tris-HCl(Ph6.8)、5ml 50%的甘油、2ml 10%的 SDS、0.5ml 2 - 巯基乙醇、1ml 1%溴酚蓝和0.9ml蒸馏水。在100℃加热3分钟以使蛋白质变性。将样品进行sodium dodecyl sulfate polyacrylamide gel(SDS-PAGE)电泳,再电转移到硝酸纤维素膜上。电转完毕后,将电转膜置于5%的脱脂奶粉(PBS配制)中封闭,4℃过夜。封闭的膜用PBST漂洗2次。然后用磷酸化p38MAPK抗体(在PBST中用5%牛血清蛋白按1:400的比率稀释,抗体购于美国Santa cruz公司,产品编号:sc-166182)摇床哺育,4℃过夜。换液,PBST洗涤4次。然后加入二抗(羊抗鼠IgG抗体/HRP,在PBST中用5%牛血清蛋白按1:5000的比率稀释)室温下摇床哺育1小时。换液,PBST洗涤4次。将膜风干,贴在玻璃纸上,加底物,做化学发光得到胶片。将背景较高的底片片放入PIERCE公司X光片背景去除液中。样品的蛋白含量以与GAPDH的相对量表示。GAPDH一抗在PBST中用5%牛血清蛋白按1:1000的比率稀释,抗体购于美国ProMab公司,产品编号:Mab-2005079。
1.10 统计学分析
所有统计分析均利用Sigma Plot 10.0软件完成。数据以平均值±标准差表示。统计学差别用单因素方差分析(ANOVA)进行检验。两组之间的显著性差异进行t检验,3组及多组之间的显著性差异进行post hoc比较。显著性水平定为P<0.05。
2 实验结果与分析
各空白载体注射组与各生理盐水组相比均没有显著性差异,表明注射空白载体对机体没有显著性影响。因此下面各组的数据均省略了空白载体注射组。
2.1 运动和/或RNA干扰IL-6基因对胰岛素抵抗发生的影响
方差分析表明(表2),与各自生理盐水注射组(S-)相比,IL-6shRNA载体注射组(P-)的空腹血糖显著升高(安静高脂组,即RH组除外)、空腹胰岛素浓度显著升高(运动高脂组,即EH组除外)、葡萄糖输注率显著降低(P<0.05或P<0.01)。与各自安静对照组相比,安静高脂组与运动高脂组的空腹血糖均显著升高(P<0.05或 P<0.01);安静高脂组的空腹胰岛素浓度显著升高(P<0.05),但运动高脂组的空腹胰岛素浓度却没有显著性差异(P>0.05);除了生理盐水运动高脂组外,其余各组的葡萄糖输注率均显著降低(P<0.01)。运动高脂组与各自的安静高脂组相比,空腹血糖均显著降低(P<0.01);空腹胰岛素浓度只有IL-6shRNA载体注射组显著降低(P<0.05);葡萄糖输注率显著升高(P<0.05或P<0.01)。

表2 各组大鼠空腹血糖(mmol/L)、空腹胰岛素(mIU/L)和葡萄糖输注率(Mean GIR60-120min,mg/kg/min)的比较一览表(n=8)
2.2 运动和/或RNA干扰IL-6基因对机体血清IL-6蛋白浓度与各组织IL-6基因表达的影响
方差分析表明(表3),与各自生理盐水注射组(S-)相比,IL-6shRNA载体注射组(P-)的血清IL-6及各组织IL-6mRNA水平均显著降低(P<0.05或P<0.01)。与各自安静对照组相比,安静高脂组与运动高脂组的的血清IL-6与各组织IL-6mRNA水平均显著升高(P<0.01)。运动高脂组与各自的安静高脂组相比,血清IL-6与各组织IL-6mRNA水平均显著升高(P <0.01)。
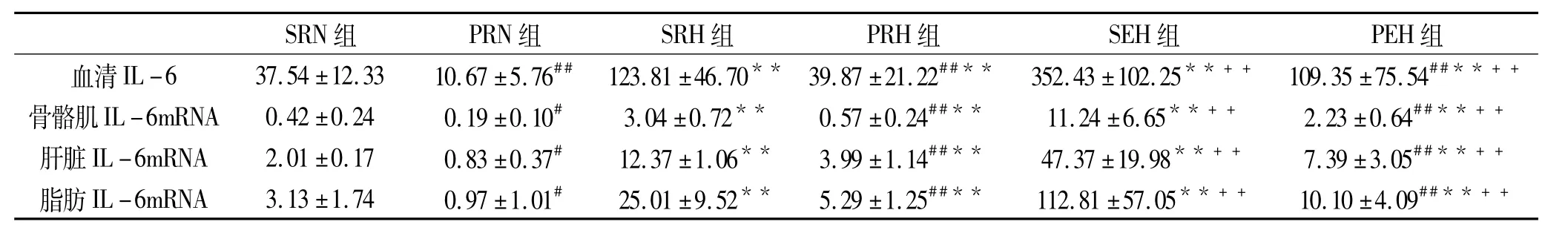
表3 各组大鼠血清IL-6浓度(pg/ml)、各组织IL-6mRNA水平(/GAPDH)的比较一览表(n=8)
2.3 P38MAPK在运动和/或RNA干扰IL-6基因对胰岛素抵抗发生的影响
方差分析表明(表3),与各自生理盐水注射组(S-)相比,IL-6shRNA载体注射组(P-)的p-p38水平一般显著降低(P<0.05或P<0.01),但是PEH组与SHE组相比的骨骼肌p-p38及PRN组与SRN组相比的肝脏p-p38没有显著性差异(P>0.05),并且PEH组与SHE组相比的肝脏p-p38及PRN组与SRN组相比的脂肪p-p38却显著增加(P<0.05或P<0.01)。与各自安静对照组(RN组)相比,安静高脂组(SRH组)与运动高脂组(SEH组)的的骨骼肌pp38均没有显著性差异(P>0.05),SRH组的肝脏与脂肪p-p38显著降低(P<0.01),SRH组的肝脏pp38显著降低(P<0.01),脂肪组织的p-p38显著升高(P<0.01)。运动高脂组(EH组)与各自的安静高脂组相比(RH组),各生理盐水注射的运动高脂组(SEH)的 p-p38均显著降低(P<0.05或 P<0.01),但是IL-6shTNA注射的动高脂组(PEH组)的pp38却没有显著性差异(P>0.05)。
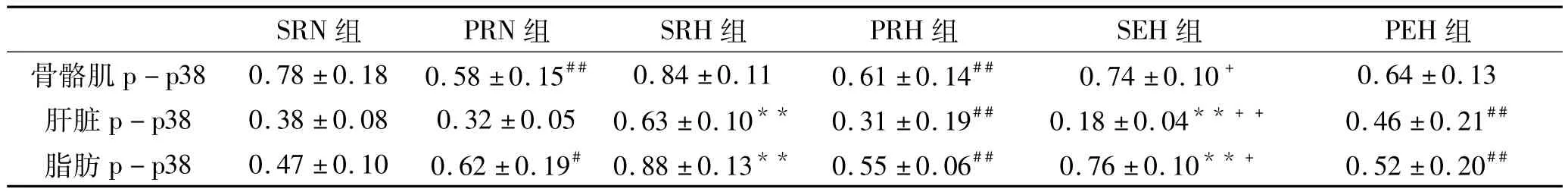
表4 各组大鼠各组织磷酸化p38MAPK水平(/GAPDH)的比较一览表(n=8)
3 讨论
从表2可以看出,与对照组相比,安静高脂饮食组空腹血糖与胰岛素浓度显著升高,葡萄糖输注率显著降低,并且空腹血糖浓度的平均值达到13.86 mmol/L,说明8周的高脂饮食确实形成了胰岛素抵抗。虽然高脂运动组与安静对照组相比,空腹血糖仍然显著升高,葡萄糖输注率仍然显著降低,但是高脂运动组与安静高脂组相比,空腹血糖显著降低,葡萄糖输注率显著升高,其空腹血糖浓度的平均值为8.26 mmol/L,该结果表明,运动只能一定程度地抑制高脂饮食形成的IR,并不能完全抑制高脂饮食所形成的胰岛素抵抗。本实验结果也表明生活方式(降低高脂饮食摄入)与适度的运动两者的结合对于预防胰岛素抵抗的发生的重要性。
虽然学者们对于运动抑制或改善胰岛素抵抗的机制进行了较多的研究,但是,它的确切机制仍然没有阐明。作为一种运动时释放最快,释放量最多的一种细胞因子[12],IL-6在安静时主要释放于脂肪组织,运动时主要释放于骨骼肌[13]。IL-6从组织释放后进入血液,以激素样作用于靶组织而调节物质与能量代谢[14],并且 IL-6 基因敲除鼠会形成继发性肥胖[2]。所有这些报道使我们相信,运动在抑制胰岛素抵抗形成或改善胰岛素抵抗的症状时很有可能通过IL-6而起作用。
为了消除IL-6的影响,我们采用了RNA干扰技术。自从1998年Fire[15]等发现RNA干扰技术以来,它已经成为广泛用于在体或离体沉默某特定基因的一种重要实验方法[16]。Lu[17]给大鼠在体注射 p65 siRNA(0.25 μmol/kg),对照组则注射生理盐水。他认为RNA干扰治疗是癌症治疗中一种较新的转染方法,可以避免一些副作用。Crosswhite[8]将腺病毒转染的IL-6 shRNA给大鼠尾静脉注射一次,结果与对照组相比,其组织内的IL-6基因表达显著降低。我们用真核细胞转染的shRNA给大鼠尾静脉注射4次,结果表明(如表3所示),各shRNA注射组与对照组相比,其骨骼肌、肝脏与脂肪组织的IL-6基因表达显著降低说明采用我们的方法,能够显著抑制大鼠机体组织内IL-6基因的表达。
通过表2和3可以发现,运动高脂IL-6RNA干扰组(PEH)虽然与安静高脂IL-6RNA干扰组(PRH)相比空腹血糖显著降低,葡萄糖输注率显著升高,但是与对照组(PRN)和运动高脂生理盐水注射组(SEH)组相比,空腹血糖显著升高,葡萄糖输注率显著降低。表明运动虽然可以一定程度上改善胰岛素抵抗,但是运动同时沉默IL-6基因的大鼠其改善胰岛素抵抗的作用明显减弱。因此,高脂形成胰岛素抵抗,运动在一定程度上抑制胰岛素抵抗的发生,但是运动+IL-6干扰却不能抑制胰岛素抵抗,反而形成了胰岛素抵抗。本结果充分表明,运动抑制胰岛素抵抗发生在一定程度上是通过IL-6而起作用。
虽然在血清IL-6和组织IL-6基因表达方面我们得到了和其他人比较一致的结果,但是我们的研究第一次比较了不同状态下不同组织IL-6表达的差异,结果发现,安静状态时,骨骼肌IL-6 mRNA水平最低,肝脏较高,脂肪组织最高。高脂饮食形成胰岛素抵抗和运动干预抑制胰岛素抵抗时,各组织IL-6基因表达均显著增加,但依然是骨骼肌IL-6表达最低,脂肪组织IL-6表达最高。高脂运动组中各组织IL-6基因表达也显著增加,但是骨骼肌中的增加幅度最大。据此,我们认为,安静状态下,相对于骨骼肌而言,在肝脏和脂肪组织中可能存在有强有力的激活IL-6基因表达的因素存在。而在运动时,运动应激则大幅度提高了骨骼肌IL-6的基因表达。
作为应激激活的蛋白激酶,p38MAPK与胰岛素抵抗的关系十分密切。目前对于胰岛素抵抗患者机体内的p38信号的激活状态与机制还不太清楚。Hemi[7]的研究发现,肝脏中p38MAPK被多种刺激因素激活,如游离脂肪酸等。他认为p38的激活对于胰岛素受体底物1丝氨酸磷酸化和胰岛素抵抗具有主要作用。Masharani的报道表明[18],在胰岛素抵抗患者的肌肉组织中,p38没有激活,但是磷酸化JNK和胰岛素受体底物1丝氨酸磷酸化均显著增加。本次研究发现,与对照组相比,高脂饮食形成胰岛素抵抗的大鼠骨骼肌组织的p38没有明显改变,但是肝脏和脂肪组织的p38却显著激活了。由此可以认为,脂肪和肝脏组织中p38MAPK信号通路的激活在胰岛素抵抗形成过程中具有重要作用。这可能与胰岛素抵抗形成时机体的慢性炎症反应有关[19],因为炎症反应会激活p38MAPK 信号通路[20]。
较多的实验已经证明,运动具有抗炎症作用[21]。本实验结果表明,高脂饮食8周,大鼠形成胰岛素抵抗。在这个过程中,运动组大鼠与安静组相比,胰岛素抵抗形成显著降低,同时,骨骼肌、肝脏与脂肪组织中的磷酸化p38水平也显著降低。因此,我们推测,运动抑制胰岛素抵抗的形成很有可能是通过下调p38MAPK等信号通路而影响机体的炎症反应来起作用的。而Bumrungpert[22]等人在研究山竹果的主要活性成分倒捻子素(mangostin,MG)时,发现MG可以减弱LPS诱导的人脂肪细胞炎症反应和胰岛素抵抗也是可能通过抑制p38MAPK等MAPK信号通路的激活而起作用。
如上所述,运动抑制胰岛素抵抗形成可能通过激活IL-6和/或抑制p38MAPK信号通路,那么在IL-6和p38MAPK之间是否存在一种联系?有部分实验研究了不同因素导致胰岛素抵抗时IL-6和p38MAPK的状态[23],但是并没有对这两者之间的关系进行探讨。通过本次研究,发现运动导致机体IL-6基因表达与蛋白释放显著增加,同时p38MAPK信号通路显著抑制。根据这个结果,我们可以推测IL-6基因表达与蛋白释放的激活可能会抑制p38MAPK信号通路,因为IL-6具有抗炎症作用。而大部分抗炎症作用的因素都可以下调p38MAPK信号通路。此外,我们通过 IL-6shRNA使 IL-6基因沉默,此时p38MAPK信号通路的激活却比较复杂,骨骼肌、肝脏与脂肪组织中p38激活、不变、甚至也会抑制。因此我们得出结论:IL-6基因表达与蛋白释放增加可能抑制p38MAPK信号通路,但是IL-6基因的沉默却不一定激活p38MAPK信号通路。
4 结论
(1)运动抑制胰岛素抵抗发生在一定程度上是通过IL-6而起作用的。
(2)安静和高脂饮食形成胰岛素抵抗状态下,肝脏和脂肪组织中IL-6基因表达最强;而运动应激则大幅度提高了骨骼肌IL-6的基因表达。
(3)高脂饮食形成胰岛素抵抗的大鼠肝脏与脂肪组织p38MAPK显著激活。
(4)运动抑制胰岛素抵抗的形成与p38MAPK信号的下调有关。
(5)IL-6激活可能抑制p38MAPK,但是IL-6基因的沉默却不一定激活p38MAPK。
[1]Fisman EZ,Tenenbaum A.The ubiquitous interleukin-6:a time for reappraisal[J].Cardiovasc Diabetol,2010,9(1):62 -67.
[2]Wallenius V,Wallenius K,Ahren B,et al.Interleukin-6-deficient mice develop mature - onset obesity[J].Nat Med.2002,8(1):75-79.
[3]Abe M,Okadak K,Maruyama T,et al.Relationship between erythropoietin responsiveness,insulin resistance,and malnutrition-inflammation-atherosclerosis(MIA)syndrome in hemodialysis patients with diabetes[J].Int J Artif Organs,2011,34(1):16 -25.
[4]Pedersen BK,Febbraio MA.Muscle as an endocrine organ:focus on muscle-derived interleukin-6[J].Physiol Rev.2008,88(4):1379-1406.
[5]Chu Y F,Jiang Y,Zhang JC,et al.The role of p38 mitogen-activated protein kinase in interleukin-6 induction by lipopolysaccharide in vascular smooth muscle cells[J].Zhongguo Wei Zhong Bing Ji Jiu Yi Xue,2010,22(5):291-294.
[6]Ehlting C,Lai WS,Schaper F,et al.Regulation of suppressor of cytokine signaling 3(SOCS3)mRNA stability by TNF-alpha involves activation of the MKK6/p38MAPK/MK2 cascade[J].J Immunol,2007,178(5):2813 -2826.
[7]Hemi R,Yochananov Y,Barhod E,et al.p38 Mitogen-Activated Protein Kinase-Dependent Transactivation of ErbBReceptor Family:A Novel Common Mechanism for Stress- Induced IRS-1 Serine Phosphorylation and Insulin Resistance [J].Diabetes,2011,60(4):1134-1145.
[8]Crosswhite P,Sun Z.Ribonucleic acid interference knockdown of interleukin 6 attenuates cold-induced hypertension[J].Hypertension,2010,55(6):1484-1491.
[9]Jung HL,Kang HY.Effects of endurance exercise and highfat diet on insulin resistance and ceramide contents of skeletal muscle in sprague- dawley rats[J].Korean Diabetes J,2010,34(4):244-252.
[10]Zhang Z,Xue HL,Liu Y,et al.Yi-Qi-Zeng-Min-Tang,a Chinese medicine,ameliorates insulin resistance in type 2 diabetic rats[J].World J Gastroenterol,2011,17(8):987 -995.
[11]Chen L,Cao ZL,Han F,et al.Chronic intermittent hypoxia from pedo-stage decreases glucose transporter 4 expression in adipose tissue and causes insulin resistance[J].Chin Med J(Engl),2010,123(4):463-470.
[12]Ostrowski K,Hermann C,Bangash A,et al.A trauma-like elevation in plasma cytokines in humans in response to treadmill running[J].J Physiol,1998,513(3):889 -894.
[13]Febbraio MA,Pedersen BK.Muscle-derived interleukin-6:mechanisms for activation and possible biological roles[J].FASEBJ,2002,16(11):1335 -1347.
[14]Febbraio MA,Hiscock N,Sacchetti M,et al.Interleukin-6 is a novel factor mediating glucose homeostasis during skeletal muscle contraction[J].Diabetes,2004 J,53(7):1643 -1648.
[15]Fire A,Xu S,Montgomery MK,et al.Potent and specific genetic interference by double-stranded RNA in Caenorhabditis elegans[J].Nature,1998,391(6669):806 -811.
[16]Ansaloni S,Lelkes N,Snyder J,et al.A streamlined sub -cloning procedure to transfer shRNA from a pSM2 vector to a pGIPZ lentiviral vector[J].J RNAi Gene Silencing ,2010,6(2):411 -415.
[17]Lu W,Zhang G,Zhang R,et al.Tumor site-specific silencing of NF-kappaBp65 by targeted hollow gold nanosphere-mediated photothermal transfection[J].Cancer Res,2010,70(8):3177-3188.
[18]Masharani UB,Maddux BA,Li X,et al.Insulin Resistance in Non-Obese Subjects Is Associated with Activation of the JNK Pathway and Impaired Insulin Signaling in Skeletal Muscle[J].PLoS One,2011,6(5):e19878.
[19]Festa A,Dagostino RJr,Williams K,et al.The relation of body fat mass and distribution to markers of chronic inflammation
[J].Int J Obes Relat Metab Disord,2001,25(10):1407-1415[20]Choi YH,Jin GY,Li GZ,et al.Cornuside Suppresses Lipopolysaccharide-Induced Inflammatory Mediators by Inhibiting Nuclear Factor- Kappa BActivation in RAW 264.7 Macrophages[J].Biol Pharm Bull,2011,34(7):959 -966.
[21]Halldin M,Rosell M,de Faire U,et al.The metabolic syndrome:prevalence and association to leisure-time and work-related physical activity in 60-year-old men and women[J].Nutr Metab Cardiovasc Dis,2007,17(5):349-357.
[22]Bumrungpert A,Kalpravidh RW,Chitchumroonchokchai C,et al.Xanthones from mangosteen prevent lipopolysaccharide-mediated inflammation and insulin resistance in primary cultures of human adipocytes[J].J Nutr,2009,139(6):1185 -1191.
[23]Green CJ,Macrae K,Fogarty S,et al.Counter- modulation of fatty acid-induced pro- inflammatory nuclear factor κBsignalling in rat skeletal muscle cells by AMP-activated protein kinase[J].Biochem J,2011,435(2):463-474.
The effects and mechanism study on the development of insulin resistance intervened by exercise and IL-6shRNA
TANG Hui et al
(Hunan University of Science and Technology,Xiangtan Hunan 411201)
Objective:To probe into whether exercise inhibited the development of insulin resistance(IR)through IL-6 and the possible effects of p38MAPK signal pathway.Methods:Rats were fed by 8 weeks high-fat diets to develop IR,and glucose infusion rates(GIR)were determined by hyperinsulinemic-euglycemic clamping to confirm the development of IR.8 weeks treadmill exercise and/or IL-6shRNA plasmid injection were adopted.The indexes of serum IL-6,fasting blood glucose,fasting serum insulin,GIR,IL-6 gene expression levels and p-p38 in various tissues were determined.Results:Rats fed by 8 weeks high-fat diets were developed IR and the IL-6mRNA levels in various tissues of IL-6shRNA injection groups were significantly lower than those of control group(P <0.05,or P <0.01).The development of IR in exercise rats significantly decreased,however,compared with that,the GIR of exercise rats injected by IL-6shRNA was lower(P<0.05,or P <0.01).The p-p38 significantly increased in the rats fed by high-fat diets,however,p - p38 in the exercise high - fat diets rats significantly decreased than that(P <0.05,or P <0.01).The changes of p-p38 in exercise rats injected by IL-6shRNA were irregular.Conclusions:These results suggested that exercise inhibited the development of IR by activating IL-6 and/or inhibiting p38 MAPK signal pathway.The upregulation of IL-6 gene expression possibly inhibited p38 MAPK signal pathway.
p38MAP;exercise;IL-6shRNA;IR
G804.2
A
1001-9154(2012)05-0072-07
G804.2
A
1001-9154(2012)05-0072-07
国家自然科学基金面上项目(30971413)
唐晖(1973-),男,湖南洞口人,博士,副教授,主要研究方向为运动内分泌。
2012-03-26
