豇豆枯萎病病原分离鉴定
2012-01-05吴仁锋杨绍丽万鹏金利容
吴仁锋,杨绍丽,万鹏,金利容
(1.武汉市农业科学技术研究院蔬菜科学研究所,湖北 武汉 430065;2.湖北省农业科学院植保土肥研究所,湖北 武汉 430064)
豇豆(Vignaunguiculata(L.) Walp.)作为全球范围内最重要的豆类作物之一,广泛栽培于热带亚热带地区和部分温带地区如非洲、亚洲、南美洲、地中海盆地和美国南部.豇豆也是我国重要的常规蔬菜品种之一,常年栽培面积达67万hm2以上.随着豇豆产业的发展,在生产中,常因栽培管理不当或环境条件的影响,造成病害的流行,特别是土传病害,由于重茬现象严重,有利于土传病害病原菌的生长繁殖,发生面积大、危害严重,对产量和品质的影响极大.
豇豆枯萎病[1]是豇豆上发生的一种重要土传病害,在我国许多豇豆产区普遍发生,特别是在高温高湿条件下,产量损失可达到70%左右.目前,对该病的研究主要集中在病害发生防治、病害侵染、抗性筛选等方面[2-6],关于该病病原菌分离鉴定的详细报道尚少见.湖北武汉新洲双柳作为湖北最大的豇豆生产基地,近年来,随着种植面积的不断扩大与栽培年限的增加,豇豆枯萎病发生危害逐年加重,严重限制了豇豆产业的发展,给种植户、加工企业造成了较大的经济损失.本研究对武汉不同豇豆种植区的枯萎病病样采集分离,并采用致病性测定、形态学及分子生物学方法对病原菌进行鉴定,旨在弄清引起武汉地区豇豆枯萎病的病原,为豇豆无公害化防控提供技术支持.
1 材料与方法
1.1标本来源与病原菌的分离纯化标样于2008-2009年分别采自武汉市蔬菜研究所实验基地、武汉市新洲区双柳街汪林村、武汉市新洲区双柳街汪铺村.参照文献[7]中有关病原真菌的分离方法,选取新发病的根茎作为分离材料,进行常规组织分离,经单孢纯化、培养获得单孢菌株,分别编号为JKW-1、JKW-2、JKW-3.
1.2致病性测定采用Kochps法将发病组织上分离到的病原菌纯培养物(孢子)制成悬浮液(孢子浓度为105~106个·mL-1).采用自然伤根浸孢子液接种植株.取生长良好长出两片真叶的豇豆苗,用无菌水将根茎部表面冲洗干净,然后使根完全浸在孢子悬浮液中30 min,最后将植株定植在装有灭菌沙土的花盆中.每个菌株接种8株苗,设置3次重复,以无菌水为对照,并置于25 ℃下光照培养箱中.接种后每隔1~2 d观察症状.发病后,从病株再次分离病原菌,确认致病菌.
1.3病原菌形态与培养性状测定将供试菌株接种到PDA培养基上,25 ℃条件下恒温培养.5 d后观察培养基上的菌落形态,制作玻片在光学显微镜下观察分生孢子及分生孢子梗的形态特征,测量分生孢子的大小.
1.4 病菌核糖体RNA基因内转录间隔区(rDNA-ITS)序列比较
1.4.1 菌丝体的培养与收集 将斜面保存的菌株接种在PDA培养基上进行活化.将活化的菌株移接在铺有灭菌玻璃纸的PDA平板上(每皿约30 mL培养基),每皿均匀接种2个菌丝块,每菌株接2~3个平板.于25 ℃暗培养4~6 d后,用灭菌解剖刀刮取菌丝,置于4 ℃保存备用.
1.4.2 基因组DNA的提取 基因组DNA的提取采用十六烷基三甲基溴化铵(cetyltriethylammonium bromide,CTAB)法提取和纯化[8].将300 mg菌丝体放入已灭菌的研钵中,倒入适量液氮充分研磨,将菌丝粉末装入灭菌的1.5 mL离心管中.每一离心管中加入600 μL 2×CTAB提取缓冲液(0.7 mol/L NaCl;100 mmol/L Tris-HCl,pH 8.0;20 mmol/L EDTA;10 g/L PVP-360;20 g/L CTAB;0.1%β-巯基乙醇),涡旋混匀,65 ℃水浴锅中温浴30 min,期间颠倒混匀3次.每管加入600 μL 氯仿/异戊醇(体积比24∶1)抽提液,充分混匀后于12 000 r/min离心15 min.吸取上清液至干净离心管中,加等体积氯仿/异戊醇再抽提一次.将上清转入干净的离心管中,加2倍体积的无水乙醇沉淀20 min,16 000 r/min离心10 min,去上清,沉淀用70%冰乙醇冲洗2遍.将离心管置于37 ℃温箱中干燥后用TE溶解沉淀,经1%琼脂糖凝胶电泳检测后-20 ℃冰箱保存备用.
1.4.3 ITS扩增 用真核生物核糖体DNA通用引物ITS1和ITS4进行PCR扩增[9].其序列为,ITS1:5′-TCCGTAGGTGAACCTGCGG-3′,ITS4:5′-TCCTCCGCTTATTGATATGC-3′.
1.4.4 PCR反应条件 PCR反应体系总体积为50 μL,反应液组分为:10×PCR Buffer 5 μL,25 mmol/L MgCl24 μL,10 mmol/L dNTP 2 μL,5 U/μL Taq酶0.3 μL,模板DNA 10 ng,引物ITS1和ITS4(25 μmol/L)各1 μL,用ddH2O使总体积达到50 μL,在PTC-100 PCR扩增仪上扩增.扩增条件:95 ℃预变性4 min;94 ℃变性1 min;54 ℃退火1 min;72 ℃延伸1 min,共35个循环;最后72 ℃延伸10 min.PCR产物委托南京金斯瑞生物公司进行纯化和测序.
1.4.5 ITS序列分析 将测序所得的菌株的核糖体DNA-ITS序列与互联网GenBank中核酸数据库中的ITS区相关序列进行同源性比较 (http://www.ncbi.nlm.nih.gov/blast/).
2 结果与分析
2.1豇豆枯萎病菌的分离和纯化从田间采集发病植株,切取病茎病健交界处的维管束组织,按常规的组织分离法进行分离.通过组织分离,获得3个枯萎病菌菌株,即JKW-1、JKW-2、JKW-3.选取代表性的菌株进行单孢纯化后,用于致病性测定.
2.2致病性测定将菌株JKW-1、JKW-2和JKW-3的分生孢子悬浮液接种自然伤根的豇豆植株,结果表明,分生孢子悬浮液接种植株基本都能发病.接种后初期病株下部叶片先变黄,逐渐向上发展,病叶叶脉变褐,近脉的叶肉组织变黄,终致叶片干枯、脱落,对照植株不发病(图1).致病性测定发现:JKW-1和JKW-3易发病、致病性较JKW-2强,症状与田间发病相同,从病斑处再次分离得到的菌株均与原菌株相同.致病性测定证明三者均为致病病原菌.

图1 枯萎病菌接种豇豆的致病性
2.3病原菌形态与培养性状菌株JKW-1在PDA培养基上于25 ℃上培养,菌落近圆形,气生菌丝白色絮状或粉绒状,培养基表面紫红色,背面深紫色.菌株菌丝浓密,呈同心轮纹,质地厚实,气生菌丝茂盛.大型分生孢子较易产生,镰刀形,顶细胞渐尖并弯曲成喙状,基细胞足状,多数为3隔,少数为4~7隔,大小为20.1~45.0 μm×2.5~5.1 μm;小型分生孢子为卵形或椭圆形,0~1个分隔,大小为 5.1~16.7 μm×2.0~5.1 μm;厚垣孢子较易产生,顶生或间生,多数单个,球形,细胞壁粗糙 (图2).
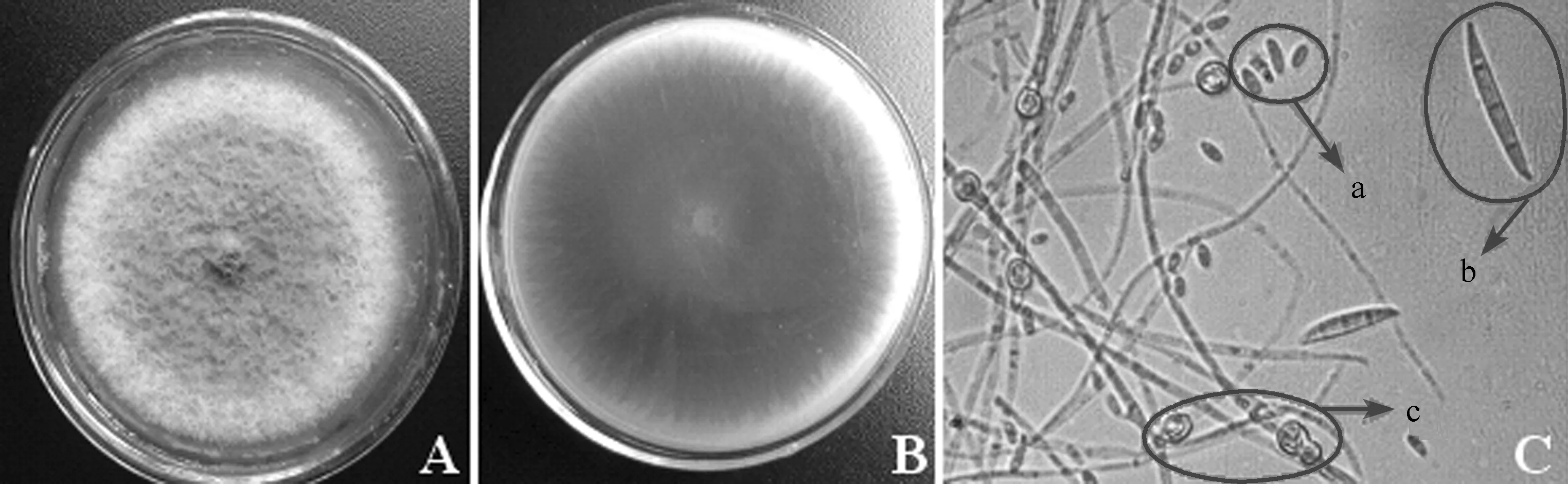
图2 枯萎菌菌株JKW-1的形态
菌株JKW-2在PDA培养基上于25 ℃上培养,菌落近圆形,初期菌落为白色,中间逐渐出现粉紫色,背面辐射状紫红色,气生菌丝少,贴着培养基平面生长.大型分生孢子较易产生,纺锤形至镰刀形,顶细胞渐尖并弯曲成喙状,基细胞足状,多数为3隔,少数为4~7隔,大小为20.6~56.6 μm×3.1~6.4 μm;小型分生孢子为卵形或棍棒状,0~1个分隔,大小为6.4~17.9 μm×2.5~5.1 μm;厚垣孢子较难产生,顶生或间生,多数单个,球形,细胞壁粗糙 (图3).
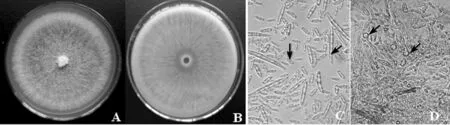
图3 枯萎菌菌株JKW-2的形态
菌株JKW-3在PDA平板上25 ℃培养,菌落为白色无色素,绒毛状,松软,中心隆起,气生菌丝多.大型分生孢子较难产生,顶细胞渐尖并弯曲成喙状,基细胞足状,多数为3隔,少数为4~7隔,大小为17.6~48.6 μm×2.0~4.6 μm;小型分生孢子为卵形或棍棒状,0~1个分隔,大小为5.1~14.6 μm×2.0~5.1 μm;厚垣孢子顶生或间生,较易产生,多数单个,球形,细胞壁粗糙(图4).
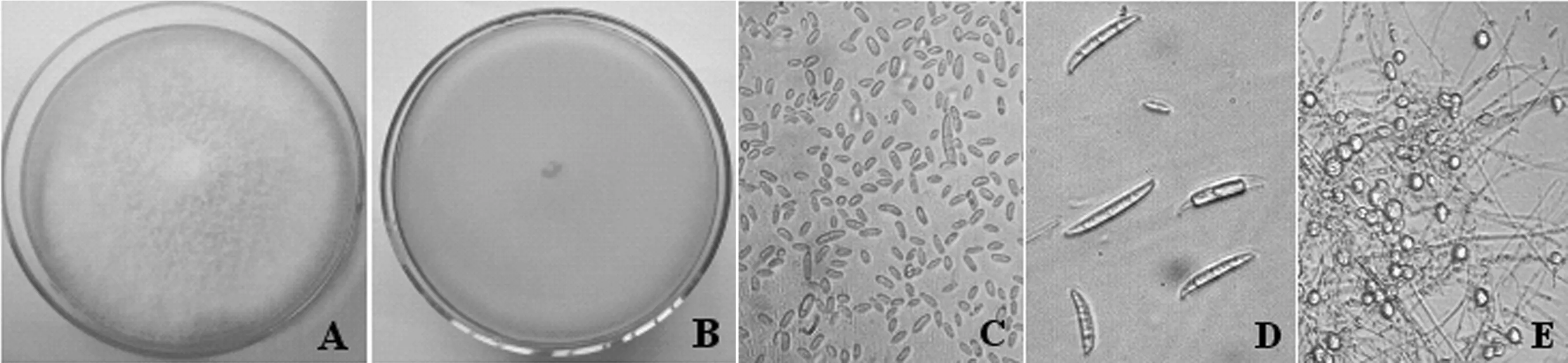
图4 枯萎菌菌株JKW-3的形态
通过对3个菌株菌落形态、色素颜色、分生孢子梗、大小分生孢子形态,厚垣孢子形态等特征描述,参照Booth[10]检索方法确定:3个枯萎病菌均为半知菌亚门尖孢镰孢菌(FusariumoxysporumSchl.).
2.4rDNA-ITS序列分析在形态学鉴定的基础上,采用分子生物学技术进行辅助鉴定,利用CTAB法提取菌株基因组DNA,以ITS1与ITS4为引物对ITS区进行扩增,通过对ITS区的双向测序,将菌株的rDNA-ITS序列与互联网GenBank中核酸数据库进行同源性比较.对3个菌株的核糖体DNA-ITS序列进行分析,结果显示:包括引物结合区,3个菌株的核糖体DNA-ITS基因序列长度均为544 bp,且3个菌株核糖体DNA-ITS序列完全一致.该序列与Genbank中的Fusariumoxysporum(GenBank登录号为:AB470894、FJ233193、EF590328、EF495230、DQ459007、DQ452454、AY684920)的相应片段完全一致,同源性为100%.根据生物信息学同源性比对的结果,将该菌鉴定为尖孢镰刀菌(FusariumoxysporumSchl.),该分子鉴定的结果与形态学鉴定的结果一致.
3 结论与讨论
本研究在病原菌鉴定中,主要根据病菌在PDA培养基上的菌落形态、色素、大型分生孢子、小型分生孢子和厚垣孢子的形态特征以及产孢表型参照Booth分类系统进行种级鉴定.根据孢子的形态和产孢表型将3个枯萎病的菌株鉴定为Fusariumoxysporum.并在形态学鉴定的基础上,通过对病原菌rDNA-ITS区扩增所得序列与GenBank中的序列进行同源性比较.结果表明:3个枯萎病菌株与Fusariumoxysporum的同源性最高,为100%,进一步验证了形态学鉴定结果.
从采集到的发病豇豆茎上都能够分离到典型的枯萎病菌,3个不同地点的菌株,在菌落色泽、孢子大小、培养性状和致病性等方面存在差异,其中JKW-1的培养性状同何希树[3]描述较一致.在产孢表型上,3个菌株都易产生小型分生孢子,JKW-2较JKW-1和JKW-3易产生大型分生孢子,而JKW-1和JKW-3较JKW-2易产生厚垣孢子.同时3个菌株致病性也存在一定差异,采自新洲区双柳街汪铺村的JKW-2比采自汪林村的JKW-1和蔬菜研究所JKW-3致病力要弱,表现在发病较迟且发病较轻,初步分析致病性强弱与菌丝生长形态有一定关系,菌株JKW-1和JKW-3菌丝浓密气生菌丝旺盛,侵染过程中更容易在维管束产生菌丝分泌毒素或堵塞导管,导致寄主细胞死亡或植株萎蔫,而菌株JKW-2菌丝稀薄气生菌丝不旺盛,侵染过程中不容易在维管束产生菌丝分泌毒素或堵塞导管,因此发病迟且轻.以上结果说明,不同地方的镰刀菌由于外界环境、地理条件的差异同种的菌易发生变异.对3个枯萎病菌的ITS序列比较发现,菌株间序列完全一致,虽然3个枯萎病菌菌株分别采自新洲汪林村、新洲汪铺村及武汉市蔬菜科学研究所3个地点,但是地理位置之间的差异并没有体现在ITS序列差别上.
在真菌鉴定上应以形态学鉴定为基础,分子鉴定为补充,rDNA-ITS序列分析结果可作为形态学鉴定的辅助验证[11].对于引起重大经济作物的真菌病害及属内种间较相似的病原物,除采用病原菌的形态鉴定和柯赫氏法则证明外,分子生物学检测手段可作为快速诊断病原物种类的可靠、简便的技术.本研究采用形态学及分子生物学的方法对武汉地区豇豆枯萎病的病原进行鉴定,为后续工作提供基础材料和条件.
[1] 吕佩珂,苏慧兰,高振江,等.中国现代蔬菜病虫原色图鉴[M].呼和浩特:远方出版社,2008:374-375.
[2] 方木壬,黄健坤.豇豆枯萎病抗原筛选研究[J].华南农业大学学报,1984,5(4):57- 61.
[3] 何希树.豇豆枯萎病的发生与防治研究[J].安徽农业科学,1989,41(3):64-66.
[4] 刘金文,陈德禄.豇豆枯萎病病原菌初侵染试验[J].福建农业科技,1995,6:13.
[5] 丁建成,胡宏云,刘小林,等.豇豆枯萎病防治药剂筛选研究[J].现代农业科技,2008,11:113.
[6] 张衍荣,李桂花,何自福,等.豇豆枯萎病抗病性鉴定技术研究[J].华南农业大学学报,2005,26(3):22-25.
[7] 方中达. 植病研究方法[M].3版.北京:中国农业出版社,1998:122-125.
[8] Graham G C,Mayser S P,Henry R J. A simplified method for the preparation of fungal genomic DNA for PCR and RAPD analysis[J].Biotechniques,1994,16: 48-51.
[9] 刘春来,文景芝,杨明秀,等.rDNA-ITS在植物病原真菌分子检测中的应用[J].东北农业大学学报,2007,38(1):101-106.
[10] Booth C. The genusFusarium[M].London: Eastern Press,1971:1-237.
[11] 孙广宇,彭友良,李振岐,等.核苷酸序列分析在真菌系统学研究中的应用[J].西北农林科技大学学报:自然科学版,2003,31(6):187-191.
