整体柱毛细管电泳与质谱联用检测肺癌患者尿液中的己醛和庚醛
2012-01-02闫志华郭晓希
徐 晖,闫志华,郭晓希
(华中师范大学 化学学院 农药与化学生物学教育部重点实验室,武汉 430079)
整体柱毛细管电泳与质谱联用检测肺癌患者尿液中的己醛和庚醛
徐 晖*,闫志华,郭晓希
(华中师范大学 化学学院 农药与化学生物学教育部重点实验室,武汉 430079)
采用外补充鞘流液的接口形式,实现毛细管电泳与质谱的联用,在石英毛细管(100μm i.d.)内原位合成3mm长的聚甲基丙烯酸-乙二醇二甲基丙烯酸酯[poly(MAA-co-EDMA)]整体柱,进行样品的在线衍生化、在线预富集以及分离检测.建立了醛类物质的毛细管电泳-质谱联用分析方法,并应用于肺癌患者尿样中己醛和庚醛的检测.对缓冲液浓度,分离电压等条件进行了优化,方法的相对标准偏差为6.7%~13.9%,检测限在0.15~0.18mol·L-1范围内.该方法分析速度快,灵敏度高,为CE/MS的联用提供了一种新的装置设计思路.
毛细管电泳/质谱;整体柱;醛类化合物;肺癌代谢标志物;尿液分析
毛细管电泳(capillary electropho-resis,CE)和质谱(Mass spectrometry,MS)分析技术的联用是一种具有优良应用前景的分析工具,因为这种方法既具有CE的低样品消耗量、高分离效率的优势,又兼备MS的快速、定性鉴定、高灵敏度的优势,二者的结合使该方法成为复杂样品中低含量组分分析的有力工具.CE/MS被广泛地应用于各个领域,包括基因组学[1-2],蛋白质组学[3-5],药物分析[6-7],代谢物鉴定[8-9],生物标记物的发 现[10],食品科学[11].CE/MS联用技术及其应用已有综述报道[12].
电喷雾离子化(Electro-spray ionization,ESI)是最适合于 CE/MS联用的离子化方式[13-14].其原因有两个:一是此方式可以检测多种不同质量数的荷电分子;二是经过CE分离过的样品可直接进入质谱进行分析.但是,ESI的电喷雾口需要在CE的末端带电,这比高效液相色谱/质谱联用(Highperformance liquid chromatrography/mass spectrometry,HPLC/MS)的接口要难得多.由于分离毛细管的内径很小,要使末端带电,这就成为了一个物理学的挑战.再者,毛细管电泳的流速很低(纳升级),不利于得到稳定的电喷雾流.解决这个问题的方式之一就是补充鞘流液,这个方法不仅可以得到了稳定的电喷雾流,而且使在电喷雾口处施加高电压更为便利[15-17].但是,鞘流会稀释样品溶液使分析灵敏度降低[17],Chen课题组采用了一个锥形的喷雾口以降低这种稀释作用[18].
无鞘流接口可降低鞘流在喷雾口的稀释作用,但在CE/MS的喷雾口施加分离电压仍然是一个问题.为解决这个问题可在毛细管末端的外缘粘上一个电极或可导电的聚合物,但这种接口的寿命很短.最好的解决方法是制造一个装置将CE和MS相连,无鞘 流补充[9,19-20],这种方法的缺点也是寿命短.另一种无鞘流补充的方法是将CE的出口和电喷雾的出口合二为一,但制作难度很大[21-23].
本实验采用外补充鞘流液的接口形式,实现了毛细管电泳与质谱的联用,并在毛细管中制备了poly(MAA-co-EDMA)整体柱,进行样品的在线预处理,建立了醛类肺癌代谢标志物的毛细管电泳-质谱联用的分析新方法.优化了一系列实验条件,并将此方法应用于肺癌患者尿样中己醛和庚醛的检测.为CE/MS的联用,提供了一种新的装置设计思路.
1 实验部分
1.1 仪器与试剂
乙二醇二甲基丙烯酸酯(EDMA)购自Sigma-Aldrich公司(Milwaukee,WJ);醋酸铵,甲基丙烯酸(MAA),十二醇和甲苯购自上海国药集团(Shanghai,P.R.China);2,4-二硝基苯肼(DNPH)购自CHEM SERVICE公司(West Chester,PA,USA);乙腈和甲醇为色谱纯试剂,均购自TEDIA 公 司(Tedia Company,Inc.,Fairfield,OH,USA);己醛(98%),庚醛(97%)均购自 ABCR GmbH公司(Germany).实验用水为高纯蒸馏水(Millipore Simplicity 185,Billerica,MA,USA).弹性熔融石英毛细管(100μm i.d.)购自河北永年光纤厂.
1.2 标准溶液的配置
己醛、庚醛的标准储备液(5mmol/L)配于甲醇中,于4℃下保存,不同浓度的标准溶液由磷酸盐缓冲溶液(PBS,25mmol/L,pH 2.2)逐级稀释而成.DNPH在乙腈∶水=1∶5的溶液中进行重结晶纯化,干燥后以乙腈为溶剂,配成10mmol/L的储备液,于4 ℃下保存.125μmol/L的标准溶液由PBS(25mmol/L,pH 2.2)稀释而成.
1.3 Poly(MAA-co-EDMA)整体柱毛细管的制备
1.3.1 毛细管的活化 将毛细管(ID:100μm,长25cm)依次以1mol·L-1NaOH和1mol·L-1HCl活化后,用二次蒸馏水洗至呈中性,再在160℃下通N2活化10h.
1.3.2 毛细管内壁修饰 将3-(三乙氧基硅丙基)甲基丙烯酸酯的甲醇溶液(50%,V∶V)注入毛细管中,两端以硅橡胶封口后于40℃下反应10h,再将溶液排出后以甲醇彻底清洗,并用N2吹干.
1.3.3 Poly(MAA-co-EDMA)整体柱毛细管的制备 取单体 MAA,交联剂EDMA,光引发剂Irgacgure 184,致孔剂甲苯和十二醇按一定比例混合,通N2除氧后将混合液注入毛细管中.毛细管两端立即以硅橡胶封口,刮去石英毛细管一侧(距端口2至3cm)的聚酰亚胺涂层,长约3mm,在紫外光下聚合3min.聚合完成后,以甲醇充分清洗毛细管,除去未反应的功能单体、交联剂和致孔剂.
1.4 仪器设备
Waters e2695ACQUITYTM型Waters液相色谱质谱联用仪,NJUASI-100芯片电泳程控高压电源,LSP02-1B型注射泵(Langer pump Co.,LTD,Bao Ding,China),紫外交联仪(420W 高压汞灯),KQ-100DE型数控超声波清洗器(昆山市超声仪器有限公司),0.2mL PCR管,1mL微量进样器.
质谱仪器的方法条件:
1)离子源:ESI;2)扫描方式:负离子扫描;3)检测方式:多反应监测;4)电喷雾电压:2.98kV;5)雾化气压力:599L·h-1;6)气帘气压力:49L·h-1;7)辅助加热气:350 ℃;8)离子源温度:119℃;9)检测离子对,碰撞气能量和去簇电压见下表1.

表1 检测离子对,碰撞气能量和去簇电压Tab.1 Experimental parameters of ion pair,energy of collision gas and cluster voltage
1.5 尿样制备
5份肺癌病人尿样取自湖北省肿瘤医院,4份正常人尿样取自健康自愿者.尿样在4℃下经过12 000r/min,转离心3min后保存在4℃下的冰箱中,测定时,取上层清液.
1.6 操作方法
CE-MS联用装置由本实验室自行搭建,如图1所示.在毛细管后端原位光引发合成一段3mm长的聚合物整体柱,以此为分离毛细管.由三通将毛细管和质谱连接起来,用微量注射泵恒速推动毛细管中的样品溶液进入三通,液-质联用仪的液相色谱泵驱动鞘流液,在三通中与毛细管中的样品溶液会合形成同轴液流,进入质谱的ESI离子源.同轴鞘流液能够保证稳定的液流,提高进样溶液在ESI喷口处的离子化效率.同时,以泵针和三通为电极,施加2 000V电泳分离电压.为了减少在三通交汇处的死体积以及样品在此处的稀释效应,采用了内径为65μm的三通,且对其进行了改造,提高了方法的灵敏度.
实验的具体操作方法如下:
a)用注射器吸取0.2mL的甲醇清洗、活化萃取柱.用0.2mL样品基质即PBS平衡柱子.泵速度为10μL·min-1;

图1 毛细管电泳与质谱联接装置图Fig.1 Installation diagram of the connection of capillary electrophoresis-mass spectrometry
b)取20μL的DNPH(125μmol·L-1,PBS)通过萃取柱,吸附DNPH;
c)20μL的醛混合溶液(10μmol·L-1,PBS)上样,衍生富集;
d)用0.1mL醋酸铵溶液(20mmol·L-1)清洗未反应的试剂;
e)用0.5mL醋酸铵(20mmol·L-1)∶乙腈=1∶1为解析液,外加泵驱动解析液辅助解吸,泵的流速为10μL·min-1,并在毛细管两端施加2000V的电压,补充鞘流液为甲醇∶水∶甲酸=50∶50∶1,流速为10μL·min-1,通过三通混合后进入ESI质谱分析.
2 实验结果讨论
2.1 运行液浓度的选择
选择挥发性有机盐醋酸铵作为毛细管电泳运行液,因其具有一定的离子强度和缓冲能力,且不会对质谱造成严重的污染.另外,由于醛类和DNPH的衍生化反应在酸性条件下的反应速率更高[24],因此pH 2.2被选作运行液的pH 值;除此之外,运行液的浓度会直接影响离子强度及电渗流,浓度高则电渗流速度大,浓度低则电渗流速度小.本实验在5~25mmol·L-1范围内优化了醋酸铵的浓度,最后选择20mmol·L-1醋酸铵(pH 2.2)为最佳鞘流液.
2.2 泵的流速的选择
由于电渗流的速度通常在几纳升到几十纳升之间,而实验所用质谱的离子源是常规的微升级离子源.因此,我们采取了外部辅助加速电泳溶液流速的方法提供稳定的喷雾流.另外,由此增加的背压有利于抵消离子源内高氮气压力,有利于毛细管电泳溶液顺利进入质谱.本实验研究泵流速在4~12μL·min-1范围内变化对目标分析物信噪比的影响,如下图2所示.随着泵流速的增加,分析物的信噪比也随之增加,这是由于泵的流速太慢造成进样溶液进入质谱的速度过慢,解析所需要的时间延长,峰展宽严重;但是,泵流速过快又使ESI喷口处流速增加,致使离子化效率降低.另外,过高的鞘流液速度对分析物的稀释作用增强,信号显著降低.因此最后选择10μL·min-1作为泵的流速.

图2 泵的流速对信噪比的影响Fig.2 Effect of flow rate of pump on S/N
2.3 毛细管电泳电压的选择
毛细管电泳的分离电压也是影响电泳分离的重要因素之一.它既能影响己醛和庚醛衍生化产物的分离效率,同时又能改变毛细管的电渗流.但是,由于有泵辅助推动毛细管中液体的流动,因此,分离电压对衍生化产物的分离效率影响甚微,对电渗速度有一定影响.本实验研究了分离电压从1 000V到5 000V的变化,对衍生化产物信噪比的影响,如图3所示.最后选择2 000V为最佳分离电压.
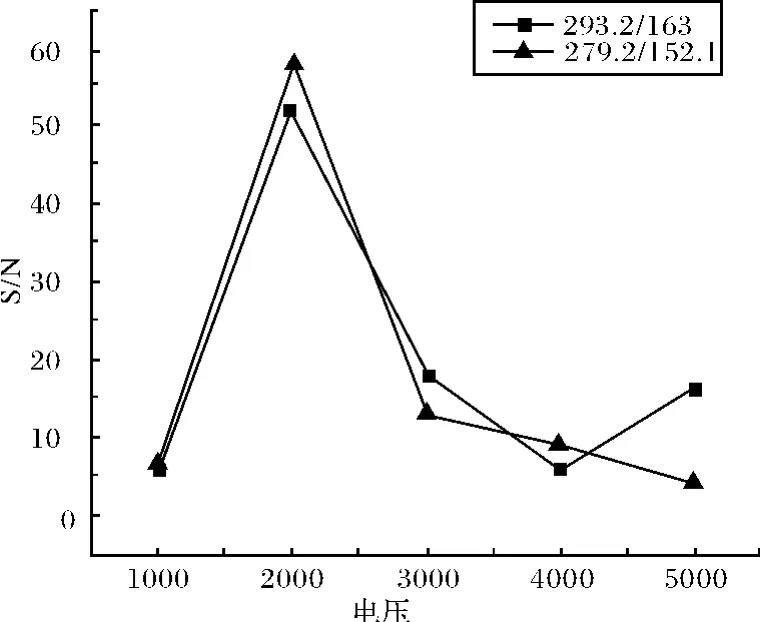
图3 分离电压对信噪比的影响Fig.3 Effect of separation voltage on S/N
2.4 解析液比例的优化
选择醋酸铵和乙腈的混合溶液作为解析液,其中,醋酸铵溶液作为毛细管电泳的运行液,乙腈作为整体柱的解析液,洗脱整体柱上富集的目标分析物,这二者比例的选择要兼顾毛细管电泳和解析效率两个方面.本实验研究了醋酸铵与乙腈的比例从6∶4改变至2∶8对分析信号的影响,如图4所示,选择了5∶5的比例为醋酸铵和乙腈的最佳比例.

图4 解析液的比例对信噪比的影响Fig.4 Effect of ratio of desorption solution on S/N
2.5 标准曲线及检出限
在最优的实验条件下,配置一系列己醛和庚醛的标准工作溶液,浓度范围在0.5~10μmol·L-1之间,进行CE/MS检测,以分析物浓度对离子强度做标准曲线,获得良好的线性,检出限(LOD)按照S/N=3计算,结果见表2.

表2 线性方程和检出限Tab.2 Linear equation and limit of detection
考察了本方法的日间和日内重现性,对0.5μmol·L-1和10μmol·L-1两组不同浓度的醛类标准溶液分别平行测定6次,结果见表3.测得的相对标准偏差(RSD)在6.7%~13.9%之间,表明此方法的重现性较好.

表3 重现性和回收率Tab.3 Reproducibility and recovery
2.6 富集效果
在同样条件下,我们做了醛衍生物直接CE/MS分析和采用本实验构建的在线预衍生富集/CE/MS系统分析的对比实验.如图5a所示,该图为己醛和庚醛的混合溶液(2(μmol·L-1)与衍生化试剂DNPH(125μmol·L-1)在室温下进行衍生化反应后,直接使用空毛细管与三通联接进质谱检测得到的多反应监测总离子流图.
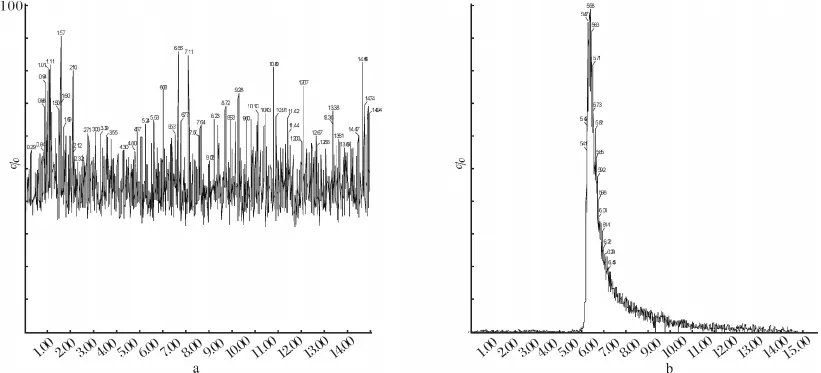
图5 醛衍生物在不同方法下的MRM图(a:CE/MS,b:在线衍生富集/CE/MS)Fig.5 The MRM chromatogram of aldehyde derivatives in(a)CE/MS and(b)online derivatization-preconcentration/CE/MS
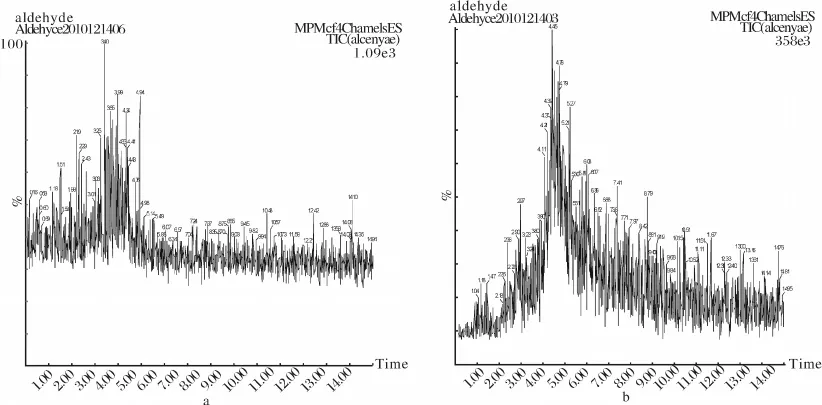
图6 空白和加标病人尿样的在线衍生富集/CE/MS的MRM图Fig.6 The MRM chromatogram of blank(a)and spiked urine(b)of lung cancer patients
图5b为在线衍生预富集/CE/MS系统分析的TIC图.具体条件如下,先在整体柱上富集20μL的衍生化试剂DNPH(125μmol·L-1);再将20μL的己醛、庚醛混合液(10μmol·L-1,PBS)上样,进入毛细管整体柱进行在线衍生反应和在线预富集;最后以醋酸铵和乙腈的混合溶液为运行缓冲溶液进行毛细管电泳质谱分析.分析物的响应信号大大增强,富集倍数是直接进样的123倍,可见,这种方法有一定的研究价值和扩展空间.
2.7 实际样品
用建立的方法检测了5份癌症患者和4份正常人尿样中的己醛和庚醛的含量.其中正常对照组中没有醛类分析物检出,而肺癌患者尿样中能检出己醛和庚醛,它们的含量范围分别是0.604~0.709μmol·L-1,0.926~1.01μmol·L-1.由此可见,肺癌患者尿样中两种醛的含量明显高于健康对照组.此外,还在实际样品中进行了加标回收实验.图6a,6b分别为癌症患者尿样和加标2μmol·L-1尿样的MRM图,方法的加标回收率为44.7%~54.5%,稳定的回收率表明此方法在实际样品的检测方面具有一定的应用价值.
3 结论
以poly(MAA-co-EDMA)整体柱为萃取介质,利用在线衍生化、在线预富集方法,并结合毛细管电泳与质谱在线联用技术,建立了尿样中癌症代谢标记物己醛和庚醛的分析方法.实验结果表明,这种方法具有很好的富集效果,分析速度快,灵敏度较高,具有一定的研究前景.
[1]Willems A V,Deforce D L,Van Peteghem C H,et al.Development of a quality control method for the characterization of oligonucleotides by capillary zone electrophoresis-electrospray ionization-quadrupole time of flight-mass spectrometry[J].Electrophoresis,2005,26:1412-1423.
[2]Von Brocke A,Freudemann T,Bayer E.Performance of capillary gel electrophretic analysis of oligonucleotides coupled on-line with electrospray mass spectrometry[J].Chromatogr A,2003,991:129-141.
[3]Moini M,Huang H.Application of capillary electrophoresis/electrospray ionization-mass spectrometry to subcellular proteomics of Escherichia coli ribosomal proteins[J].Electrophoresis,2004,25:1981-1987.
[4]Liang Z,Duan J,Zhang L,et al.Pressurized electrochromatography coupled with electrospray ionization mass spectrometry for analysis of peptides and protein[J].Anal Chem,2004,76:6935-6940.
[5]Stutz H.Advances in the analysis of proteins and peptides by capillary electrophoresis with matrix-assisted laser desorption/ionization and electrospray-mass spectrometry detection[J].Electrophoresis,2005,26:1254-1290.
[6]Smyth W F.Recent applications of capillary electrophoresiselectrospray ionization-mass spectrometry in drug analysis[J].Electrophoresis,2006,27:2051-2062.
[7]Smyth W F,Rodriguez V.Recent studies of the electrospray ionisation behaviour of selected drugs and their application in capillary electrophoresis-mass spectrometry and liquid chromatography-mass spectrometry[J].Chromatogr A,2007,1159:159-174.
[8]Benavente F,van der Heijden R,Tjaden U R,et al.Metabolite profiling of human urine by CE-ESI-MS using separation electrolytes at low pH[J].Electrophoresis,2006,27:4570-4584.
[9]Edwards J L,Chisolm C N,Shackman J G,et al.Negative mode sheathless capillary electrophoresis electrospray ioniza-tion-mass spectrometry for metabolite analysis of prokaryotes[J].Chromatogr A,2006,1106:80-88.
[10]Servais A C,Crommen J,Fillet M.Capillary electrophoresismass spectrometry,an attractive tool for drug bioanalysis and biomarker discovery[J]. Electrophoresis,2006,27:2616-2629.
[11]SimóC,Barbas C,Cifuentes A.Capillary electrophoresismass spectrometry in food analysis[J].Electrophoresis,2005,26:1306-1318.
[12]Gasper A,Englmann M,Fekete A,et al.CE with MS detection:A rapidly developing hyphenated technique[J].E-lectrophoresis,2008,29:66-79.
[13]Schmitt-Kopplin P,Frommberger M.Capillary electrophoresis-mass spectrometry:15years of developments and applications[J].Electrophoresis,2003,24:3837-3867.
[14]Issaq H J,Janini G M,Chan K C,et al.Sheathless electrospray ionization interfaces for capillary electrophoresis-mass spectrometric detection advantages and limitations[J].Chromatogr A,2004,1053:37-42.
[15]Hashimoto M,Ishihama Y,Tomita M,et al.Microelectrospray interface with coaxial sheath flow for high-resolution capillary electrophoresis/mass spectrometry separation[J].Rapid Commun Mass Spectrom,2007,21:3579-3584.
[16]Liu C C,Zhang J,Dovichi N J.A sheath-flow nanospray interface for capillary electrophoresis/mass spectrometry[J].Rapid Commun Mass Spectrom,2005,19:187-192.
[17]Moini M.Capillary electrophoresis mass spectrometry and its application to the analysis of biological mixtures[J].A-nal Bioanal Chem,2002,373:466-480.
[18]Chen Y R,Tseng M C,Her G R.Design and performance of a low-flow capillary electrophoresis-electrospray-mass spectrometry interface using an emitter with dual beveled edge[J].Electrophoresis,2005,26:1376-1382.
[19]Janini G M,Conrades T P,Wilkens K L,et al.A sheathless nanoflow electrospray interface for on-line capillary electrophoresis mass spectrometry[J].Anal Chem,2003,75:1615-1619.
[20]Whitt J T,Moini M.Capillary electrophoresis to mass spectrometry interface using aporous junction[J].Anal Chem,2003,75:2188-2191.
[21]Severs J T,Smith R D.Characterization of the microdialysis junction interface for capillary electrophoresis/microelectrospray ionization mass spectrometry[J].Anal Chem,1997,69:2154-2158.
[22]Tong W,Link A,Eng J K,et al.Identification of proteins in complexes by solid-phase microextraction/multistep elution/capillary electrophoresis/tandem mass spectrometry[J].Anal Chem,1999,71:2270-2278.
[23]Chen Z,Boggess B,Chang H C.Open-tubular capillary electrochromatography-mass spectrometry with sheathless nanoflow electrospray ionization for analysis of amino acids and peptides[J].Mass Spectorm,2007,42:244-253.
[24]Zhang H J,Huang J F,Wang H,et al.Determination of low-aliphatic aldehyde derivatizatives in human saliva using polymer monolith microextraction coupled to high-performance liquid chromatography[J].Anal Chim Acta,2006,565:129-135.
Determination of hexanal and heptanal in urine samples of lung cancer patients by monolithic columns capillary electrophoresis-mass spectrometry
XU Hui,YAN Zhihua,GUO Xiaoxi
(College of Chemistry,Huazhong Normal University,Wuhan 430079)
In this work,capillary electrophoresis was hyphenated with ESI mass spectrometer(CE/MS)with the assistant of external supplement of sheath liquid.A 3mm poly(metharylic acid-co-ethlyene dimethacrylate)monolith was in-situ synthesized inside a fused-silica capillary(100μm i.d.)for online derivatization and online preconcentration.An analysis method of CE/MS was established for the determination of hexanal and heptanal in the human urine samples.The condition parameters,including concentration of running buffer solution and separation voltage were optimized.The quantitative results showed that the limit of detection of aldehydes ranged from 0.15to 0.18μmol·L-1with the relative standard deviation of 6.7%~13.9%.The new method is simple,sensitive and efficient.It provides an alternative device strategy for the combination of CE with ESI/MS.
capillary electrophoresis/mass spectrometry;monolith;hexanal and heptanal;lung cancer biomarkers;urine analysis
O657.8
A
1000-1190(2012)01-0049-06
2011-10-07.
国家自然科学基金项目(20805017,21175052);武汉市晨光计划(201050231025).
*E-mail:huixu@mail.ccnu.edu.cn.
