Pd/CuO-Ce0.5Mn0.5O2 催化氧化合成葡萄糖醛酸及其内酯
2012-01-02肖丽萍罗文曼
肖丽萍,马 彦,陈 洁,罗文曼,袁 华
(武汉工程大学 绿色化工过程省部共建教育部重点实验室湖北省新型反应器与绿色化学工艺重点实验室,武汉 430073)
葡萄糖醛酸及其内酯是传统的肝脏解毒剂和免疫功能调节剂,同时也是功能性食品饮料、化装品等的添加剂[1-2].葡醛内酯在人体内水解后得到葡萄糖醛酸,葡萄糖醛酸分子中同时含有高反应活性的醛基和羧基,在尿苷二磷酸葡萄糖醛酸转移酶催化作用下,葡萄糖醛酸与含有羟基、巯基、羧基、氨基等基团的内源性和外源性有毒物质结合,使毒性物质的水溶性增加,从而易于随尿与胆汁排出体外,完成肌体解毒过程.现行的葡萄糖醛酸及其内酯的生产方法是以淀粉为原料的硝酸氧化法,该工艺氧化选择性差、氧化程度无法有效控制,产物分离困难,产品收率低,生产周期长,能耗高,环境污染严重,需要探索新的合成工艺[3],而以葡甲苷为原料的非均相催化氧化被认为是最有工业应用价值的研究方向.
采用氧化铈等稀土化合物对钯催化剂进行表面修饰是改善催化性能的有效手段.CeO2具有萤石结构,随着氧化还原氛的不同,Ce可以Ce4+/Ce3+价态存在,在结构中易于形成流动的氧空位,从而具有较好的氧存储性能和氧表面传递能力,并能和其他金属产生协同作用,因此被广泛用作催化剂的结构助剂和电子助剂以提高催化剂的活性、选择性和热稳定性.CeO2经掺杂后,其助催化氧化能力可进一步得到提高[4-6].
Pd/La0.5Pb0.5Mn0.9Sn0.1O3催化剂对葡甲苷伯羟基选择催化氧化合成葡萄糖醛酸表现出了较好的催化活性[7].但该催化体系引入了有害的重金属铅离子,葡萄糖醛酸及内酯的总收率为60%,因此有必要进一步优化催化剂组成、提高催化性能.本文以钯化合物为主活性组分,掺杂铈锰铜复合氧化物作为催化助剂和载体,制备了Pd/CuOCe0.5Mn0.5O2催化剂,以葡甲苷伯羟基选择催化氧化合成葡萄糖醛酸及其内酯的反应为评价对象,考察了不同CuO掺入量对催化剂活性的影响,为葡萄糖醛酸及其内酯的合成新工艺研究提供新途径.
1 实验
1.1 载体和催化剂的制备
1.1.1 载体的制备 采用溶胶-凝胶法制备载体.载体中CuO的质量百分数分别为0wt%、4wt%、9wt%和 11.5wt%.按比例 称取 Ce(NO3)3·6H2O、Mn(NO3)2、Cu(NO3)2·3H2O、柠檬酸,加入200mL蒸馏水使其溶解并搅拌反应3h,溶液经旋转蒸发仪蒸发得到淡黄色粘滞凝胶,凝胶转入红外炉干燥得到灰褐色泡沫状蓬松前体,前体经研磨后,于烘箱中110℃干燥过夜,然后再在马弗炉中于600℃下焙烧6h得到不同CuO掺入量的CuO-Ce0.5Mn0.5O2载体.
1.1.2 催化剂的制备 采用沉淀法负载活性组分制备催化剂.以PdCl2为活性Pd源负载0.5%的活性组分Pd,其负载方法为:称取0.167g PdCl2,加入100mL去离子水,用盐酸调节溶液pH值直至PdCl2完全溶解形成棕色溶液,加入20.0g载体,边搅拌边用0.5mol/L的 NaOH 溶液滴定至pH=9~10之间,搅拌3h后静置,分离出固体组分,用去离子水洗涤,烘干后经马弗炉300℃焙烧3h得到所需的催化剂.
1.2 载体及催化剂的表征
采用日本电子JEOL JSM_5510LV型扫描电镜对载体及催化剂表面形貌进行观察,放大倍数为20 000倍;在日本岛津50-A型X射线衍射仪上对载体的物相进行分析测定,采用CuKa靶,粉末法进行,仪器条件设置为30kV,20mA,对2θ值10°~80°范围进行扫描;采用美国康塔公司的NOVA2000e型比表面孔隙测定仪进行比表面积测定;采用美国VG公司的MULT1LAB2000型X射线光电子能谱仪(XPS)对催化剂表面上存在的离子价态组成、表面上氧物种类型及其相对含量进行分析,光源为 Mg Kα靶(Eb=1 253.6eV),功率为300W,工作条件12kV、20mA,分析室真空度低于0.2μPa,并以C1S结合能285.0eV为能量校正标准.
1.3 催化性能评价
取6.0g甲基葡萄糖苷(99.5%,工业级)于三口反应瓶中,加入50mL蒸馏水,溶解后加入1.0g催化剂,搅拌并导入空气.反应温度为70℃,通过滴加1mol/L NaOH 溶液维持反应混合液的pH值在8~10,反应液的pH值用pHS-25型数显pH计监测.5h后停止反应,过滤,滤液用稀盐酸将pH值调整至1~2,在90℃水解反应3 h,静置冷却,取样分析葡萄糖醛酸及内酯的含量.
葡萄糖醛酸及葡萄糖醛酸内酯标样(分析纯,国药集团上海化学试剂有限公司).用Agilent 1100型高效液相色谱仪(四元泵,二极管阵列检测器)检测葡萄糖醛酸及内酯含量[7],色谱条件:Inertsil ODS-3C18色谱柱(4.6mm×250mm);柱温30℃;流动相为水(含0.1%H3PO4)和乙腈混合溶液,体积比为水/乙腈=98/2;流速为1.0mL/min;检测波长194nm.
2 结果与讨论
2.1 CuO的掺入对催化剂结构与性能的影响
2.1.1 XRD结果分析 不同CuO引入量制得催化剂的XRD图如图1.

图1 不同CuO含量的催化剂XRD图Fig.1 XRD patterns of differnt CuO-doping content catalyst(1)0%CuO;(2)4%CuO;(3)9%CuO;(4)11.5%CuO
对照标准卡片,2θ分别为 28.70、47.65、56.49°时是CeO2的典型谱线.从XRD谱图中可以看出,不同CuO含量的催化剂主物相仍为CeO2,随着CuO的添加及其含量的升高,催化剂XRD谱图衍射峰逐渐变得尖锐,说明催化剂中主物相的晶相结构逐渐趋于完整,且Cu进入了催化剂主物相并起到了稳定其晶相结构的作用;当CuO的引入量为9%时,在2θ=38.76°附近开始出现CuO的单斜晶系特征峰,说明CuO的引入量过大时,催化剂中会出现CuO的聚集相.
2.1.2 BET及SEM测定与分析 不同CuO引入量得到的催化剂的比表面积及SEM测定结果分别如表1、图2.

表1 不同含量CuO制得催化剂的比表面积Tab.1 Surface area of different CuO-doping content catalyst

图2 不同CuO引入量的催化剂的SEM图Fig.2 SEM images of different CuO-doping content catalyst
从表1和图2可知,由于引入的CuO部分进入了催化剂主物相铈氧化物的晶相结构,对催化剂表面形貌的影响较大,随着CuO添加量的增大,催化剂的孔径分布趋于均匀,表面结构得到逐步改善,同时活性组分Pd的分散性变好.当CuO的添加量为9wt%时,催化剂具有较大的比表面积;当CuO的添加量为11.5wt%时,催化剂表面的孔结构由开放式的蜂窝状结构变为较封闭的结构,其比表面积呈下降趋势,可能是较多的晶相CuO填充了催化剂表面孔隙所致.
2.1.3 催化剂表面能谱分析 分别对CuO含量为0wt%、4wt%、9wt%和11.5wt%的催化剂进行X射线光电子能谱分析,其Ce3d能谱图分别如图3所示.

图3 不同CuO引入量制得催化剂的Ce3d能谱Fig.3 Ce3dspectra of different CuO-doping content catalyst
由图3可知,不同CuO引入量的催化剂的Ce3d能谱基本相同.Ce为镧系过渡金属,受X光激发后,产生多电子激发过程,因此Ce4+的Ce3d谱峰结构复杂,纯CeO2(A.R.级)的Ce3d谱图[8]的谱峰位置 分 别 为 881.9eV、888.5eV、897.7eV、900.1eV、906.8eV、916.0eV.对照纯CeO2标准谱图,能谱(1)在a、c、d、f处能峰与标准谱图中881.9eV、897.7eV、900.1eV、916.0eV 处能峰相吻合,可以确定在催化剂表面Ce主要以Ce4+存在;同时,能谱(1)还在b和e两处产生两个较为平坦的能峰,这是Ce3+的特征峰.
元素间的相互作用,特别是价电子的传递,可通过测量分析能峰的化学位移、峰形改变进行研究.四组催化剂样品的Ce3d能谱形状基本相同,说明在不同CuO引入量催化剂中,表面皆为Ce3+和Ce4+的共混物,且主要以Ce4+形式存在.对比不同催化剂的Ce3d能谱可知,CuO的引入导致Ce3d谱峰产生了不同程度的化学位移,这种位移是金属组分间相互作用的结果,其中当CuO含量为9%时催化剂能峰化学位移最大.结合XRD结果可知,此时金属组分间协同作用最为强烈.
不同CuO含量的催化剂的O1s能谱如图4所示.
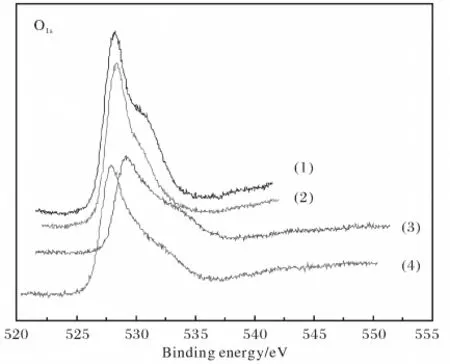
图4 不同CuO引入量的催化剂O1s能谱Fig.4 O1sspectra of different CuO-doping content catalyst
由图4可知,在催化剂样品表面存在着两种类型的氧,其中528~529eV对应于晶格氧,而531~532eV对应于吸附氧.综合对比两峰强度和峰面积可知,在催化剂样品中氧种主要表现为吸附氧.随着CuO的掺入,晶相中晶格氧的含量相对减少,晶体不完整性大大增加,这与XRD结果是一致的.由于晶格氧的缺陷,晶体中产生大量的氧空位,晶相中吸附氧增多.
经XPS分析,不同CuO引入量的催化剂表面元素含量如表2.

表2 不同CuO引入量的催化剂表面元素含量Tab.2 Relative element contents on different CuO-doping catalyst
由表2可以看出,随着CuO的引入,催化剂样品表面活性组分Pd的浓度增加,同时Ce、Mn和O元素的浓度随着CuO引入量的增加呈现先上升,后下降的趋势.这表明CuO的引入可以促进活性组分在催化剂表面的分散,提升催化剂表面活性组分浓度,从而提升催化剂活性.当CuO引入量低于9%时,CuO的引入促进了Ce、Mn元素在催化剂表面的分散,使得具有助催化作用的Ce-Mn复合氧化物更多地富集于催化剂表面,对催化剂性能的提高有促进作用;当CuO引入量达到11.5%时,结合XRD及SEM结果可知,由于催化剂中出现晶相CuO的聚集,催化剂表面Cu元素含量由1.2%迅速增加到2.25%,催化剂表面被大量晶相的CuO所覆盖,表面晶格缺陷也被CuO晶体部分覆盖,氧吸附位减少,使得催化剂表面Ce-Mn复合氧化物及表面氧含量均有不同程度的降低,催化剂活性随之降低,这与催化剂活性评价结果是一致的.
2.2 反应机理分析
由XRD结果可知,采用溶胶-凝胶法制备载体,CuO能较好地进入催化剂主物相的晶相结构中,Mn在催化剂中主要以CexMn1-xO2形式存在,这种物相的形成使得催化剂具有较高的氧存储和释放能力,从而增强该催化剂的氧化还原性和提高催化剂的活性[9].XPS分析结果表明,CuO掺杂后产生了两种作用,一是使得催化剂晶格不完整性增加,表面吸附位增多,晶格氧含量下降,吸附氧含量增加,总表面氧含量增加,有利于还原组分的再氧化;二是促进了具有助催化性能的Ce-Mn复合氧化物及活性组分Pd物种在催化剂表面的分散,这两方面的综合影响可提高催化剂的催化性能.同时,CuO的引入在不同程度上促进了金属组分间的协同作用,且当CuO引入量为9%时,协同作用最为强烈,这种CuO与Ce-Mn复合氧化物的协同作用[10-13]使得 Ce-Mn复合氧化物表面氧含量增加,有利于Ce3+被氧化为Ce4+,从而促进活性组分Pd的氧化还原循环,这种协同作用过程可能为:当主活性组分Pd2+被还原成Pd0时,Mn4+可将被还原的主活性组分Pd0氧化为Pd2+,同时Mn4+被还原成 Mn2+.Mn2+很快被与之结合的Ce4+氧化为 Mn4+,而Ce4+同时被还原为Ce3+,Ce3+又能很快地被氧气氧化为Ce4+.可能的反应机理如图5所示.

图5 可能的催化反应机理Fig.5 A proposed mechanism of catalytic reaction
2.3 反应结果检测
甲苷氧化产物甲苷酸钠在酸性条件下水解得到葡萄糖醛酸,在其水溶液中,葡萄糖醛酸和葡萄糖醛酸内酯可以相互转化,相对含量随温度和水解时间以及酸碱度不同而不同.按照本文1.3的实验条件,不同CuO掺入量得到的催化剂对甲苷伯羟基选择氧化的反应结果如表3所示.
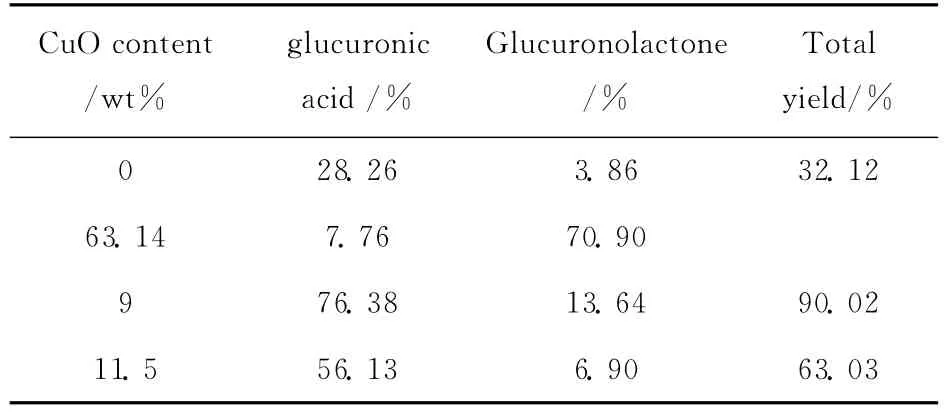
表3 不同CuO引入量的催化剂的催化活性Tab.3 Catalytic activity of different CuO-doping content
从表3可知,CuO的掺入可以明显提高催化剂的反应活性.当CuO引入量为9%时,催化剂的催化活性最好,葡萄糖醛酸及其内酯的总收率达到90%.
3 结论
Pd/CuO-Ce0.5Mn0.5O2催化剂对甲基葡萄糖苷的伯羟基的选择氧化具有较好的催化活性.CuO的掺入不仅可以显著改善Ce-Mn复合金属氧化物为载体的催化剂表面结构,增加吸附氧含量,而且可以促进金属组分间的协同作用,从而有效实现活性组分的氧化还原循环,提高催化剂的催化性能.在Pd的负载量为0.5%,CuO的掺入量为9%时,葡萄糖醛酸及其内酯的总收率可达到90%.
[1]Nigel P,Rhona M D,Stephen J W,et al.Synthesis of a glucuronic acid and glucose conjugate library and evaluation of effects on endothelial cell growth[J].Carbohydr Res,2004,339:1873-1887.
[2]Jonathan A S,James N B.The Hofer– Moest decarboxylation of D-glucuronic acid and D-glucuronosides[J].Carbohydr Res,2007,342:610-613.
[3]袁 华,孙炎彬,邬 茂,等.Pd/La0.5Pb0.5MnO3催化氧化甲苷合成葡萄糖醛酸[J].过程工程学报,2008,8(3):572-575.
[4]贾艳秋,明素荣.氧化羰基化法合成碳酸二苯酯研究进展[J].化学工业与工程技术,2003,24(3):11-14.
[5]Ilya I M,Micheal N V,Tatiana V C.Catalysis with a palla-dium giant cluster:Phenol oxidative carbonylation to diphenyl carbonate conjugated with reductive nitrobenzene conversion[J].J Mol Catal A:Chem,1996,108(1):77-85.
[6]Ho Y S,Park E D,Lee J S.Oxidative carbonylation of phenol to diphenyl carbonate over supported palladium catalysts[J].J Mol Catal A:Chem,2000,154(2):243-250.
[7]袁 华,杜治平,闫志国,等.Pd/La0.5Pb0.5Mn0.9Sn0.1O3催化剂对甲苷伯羟基的选择氧化[J].化学学报,2009,67(4):345-351.
[8]韩 伟,林仁存,谢兆雄.乙苯脱氢CeO2催化剂的XRD和XPS研究[J].厦门大学学报:自然科学版,2008,47(5):701-704.
[9]Wu Guangwen,Wu Yuanxin,Ma Peisheng,et al.Direct synthesis of diphenyl carbonate over heterogeneous catalyst:effects of structure of substituted perovskite carrier on the catalytic activities[J].Front Chem Eng China,2007,1(1):59-64.
[10]王幸宜,卢冠忠,吴善良.Cu对 Cu-Mn-Ce-O 和 Cu-Mn-Ce-Pd-O催化剂三效性能的影响[J].燃料化学学报,1995,23(2):156-161.
[11]Imamura S,Shono M,Okamoto N,et al.Effect of cerium on the mobility of oxygen on manganese oxides[J].Appl Catal A:General,1996,142(2):279-288.
[12]Xiaojun Yang,Jinyu Han,Zhiping Du,et al.Effects of Pb dopant on structure and activity of Pd/K-OMS-2catalysts for heterogeneous oxidative carbonylation of phenol[J].Catalysis Communications,2010,11:643-646.
[13]涂 毅,赵元弟.左旋多巴在纳米材料修饰界面上的电子传递[J].华中师范大学学报:自然科学版,2010,44(1):86-91.
