微生物还原针铁矿胶体的动力学特征及其影响因素
2011-12-20朱维晃吴丰昌西安建筑科技大学西北水资源与环境生态教育部重点实验室陕西西安70055中国环境科学研究院国家环境保护湖泊污染控制重点实验室北京000
朱维晃 ,臧 辉 ,吴丰昌 (.西安建筑科技大学,西北水资源与环境生态教育部重点实验室,陕西 西安70055;.中国环境科学研究院,国家环境保护湖泊污染控制重点实验室,北京 000)
微生物还原针铁矿胶体的动力学特征及其影响因素
朱维晃1*,臧 辉1,吴丰昌2(1.西安建筑科技大学,西北水资源与环境生态教育部重点实验室,陕西 西安710055;2.中国环境科学研究院,国家环境保护湖泊污染控制重点实验室,北京 100012)
基于典型的希瓦氏金属还原菌(Shewanella decolorationis S12)和针铁矿相互作用的现象,探讨了电子供体、针铁矿浓度及氧化还原中介体2-磺酸钠蒽醌(AQS)对其相互作用的影响.结果表明, AQS加入使针铁矿的微生物还原程度得到加强,在添加AQS的0.5mmol/L针铁矿体系中,厌氧培养38天后,被还原解离出的Fe(II)浓度是未添加AQS的394%.针铁矿的归一化还原速率表明,当电子供体浓度一定时,随着针铁矿浓度增加,针铁矿的还原酶促反应显著减弱.米氏拟合方程表明,以不同浓度的针铁矿为底物时, S12菌-针铁矿相互作用过程的拟合相关系数R2分别为0.843(添加AQS)和0.998(未添加AQS),电子转移载体的存在以及底物类型的不同均对Vmax和Km值均有一定程度的影响.在微生物在还原针铁矿过程中,其还原速率越大,用于 ATP合成所需能量∆E值也随之升高,S12菌和针铁矿的还原反应达到平衡时, Gibbs自由能变化(∆Gr)达最大值.
微生物还原;针铁矿胶体;乳酸钠;动力学特征
金属元素在与微生物相互作用过程中,充当电子受体的角色已被相关实验研究所证实[1-2].在金属-微生物相互作用过程中,高价态金属及其氧化物作为电子受体的角色而发生的“异化金属还原”,对维系厌氧微生物繁衍是不可或缺的.微生物还原高价态的铁锰氧化物不仅影响重金属的生物环境地球化学循环,同时也影响了有机物污染物、重金属污染物以及营养物质(N,P)在环境中的归宿[3-5].在异养型金属还原过程中,有机物作为电子供体,在失去电子的过程中被氧化而得到降解[6-7];充当电子受体的金属得到电子而被还原,故其价态发生变化;而不同价态的金属离子在环境中的迁移、转化能力和生态效应是存在差异的,并由此影响污染物的生物地球化学循
环[8-10].
就沉积物和土壤中大量存在的铁锰氧化物而言,一旦铁锰氧化物被异养型金属还原菌还原而发生解离,原本结合在其上的有机和重金属污染物就会释放到环境中,从而造成潜在的污染危害,故阐明微生物对铁氧化物及水合物还原作用的机制是必要的[11-13].本研究基于此,以典型的金属还原菌-希瓦氏金属还原菌(Shewanella decolorationis S12)与沉积物和土壤中广泛存在的针铁矿(α-FeOOH),构建铁还原菌-针铁矿相互作用体系,探讨了微生物异化还原铁氧化物的动力学特征及其影响因素,以期为后续拟揭示在微生物驱动下,氧化还原敏感性元素铁和锰参与的“微生物-铁锰-污染物”耦合的环境地球化学循环特征和规律提供初步的研究思路和理论支持.
1 材料与方法
1.1 针铁矿的制备
配制 1.0mol/L的 Fe(NO3)3100mL溶液和4.5mol/L的KOH溶液200mL.在剧烈搅拌情况下,将KOH溶液快速加入到FeCl3溶液中,并迅速把混合溶液稀释到 1L.将稀释的溶液在 70℃水浴中恒温反应60h,在反应过程中,搅拌反应液3-5次,水浴反应得到黄褐色沉淀.60h后,用漏斗过滤、洗涤至滤出液的pH值呈中性; 将洗涤后的沉淀用去离子水稀释定容为500mL的胶体悬浮液[14].
1.2 菌种,培养基及实验方案
希瓦氏菌 S12[15-16]由广东省微生物研究所提供.该菌具有利用高价态金属氧化物和有机污染物作为电子受体进行厌氧呼吸能力.S12菌与α-FeOOH相互作用体系的成分,包括不同浓度的乳酸钠、2-磺酸钠蒽醌 (AQS)、α-FeOOH以及 0.15mmol/L的 HIPES缓冲溶液(pH7.2).在32℃的 LB培养基中好氧培养 12h后,菌体经5000r/min离心 5min,无菌超纯水洗涤重悬浮,此操作重复3次,最终配成一定浓度的菌悬液,按体积比为 2%比例将菌体接种于反应体系中.反应体系分装于 25mL的西林瓶中,用高纯氮充气排氧,然后用橡胶塞压紧,置于厌氧培养箱(SHELLAB-Bactron III)中于32℃静置培养.每隔一定时间间隔取样,测定上清液中针铁矿被还原而生成的 Fe(II)浓度,Fe(II)浓度分析测试方法见文献[17].
2 结果与讨论
2.1 不同浓度针铁矿胶体下的微生物还原特征
各不同浓度(0.5,2.0,10.0,50.0mmol/L)的针铁矿悬液体系中,乳酸钠浓度为20mmol/L, AQS为 0.1mmol/L.蒽醌类磺酸盐能作为电子转移载体,即氧化还原中介体,使得电子在微生物与金属氧化物之间能发生高效的传递,从而促进异化还原过程[18-19].为考察添加电子转移载体对S12菌还原针铁矿的影响,本实验用0.1mmol/L 的AQS.添加AQS后,不同浓度的针铁矿的还原程度得到较为明显的加强(图 1),特别是在低浓度(0.5mmol/L)的针铁矿体系中,反应经38d后,如在添加AQS的0.5mmol/L针铁矿体系中,被还原解离出的Fe(II)浓度是未添加AQS的394%.
较高浓度(10.0,50.0mmol/L)的针铁矿体系中,添加和未添加AQS前后,Fe(II)浓度差别程度没有低浓度针铁矿体系中明显. 首先,针铁矿浓度上升,相互聚集效应加强,胶体颗粒增加,使得微生物-针铁矿相互接触难易程度减弱,AQS作为电子转移载体角色在针铁矿还原过程中的促进作用得到一定程度的减弱;其次,Fe(II)可作为AQS向AH2QS(2-磺酸钠蒽二酚)转变过程中的还原剂[20],使得针铁矿在被还原过程中生成的Fe(II)浓度增幅减弱.因为存在醌式结构的 AQS向含酚官能团结构的AH2QS转变,使得分子的共轭效应增强[21],故实验中,明显可观察到反应体系由无色变渐变为橙黄色.在 0~7d的时间内,不同浓度的针铁矿受到 S12菌还原而解离出的Fe(II)浓度大致呈线性增加,7d后,Fe(II)浓度随时间变化程度减弱,并达到稳定的峰值,显示出明显的酶促反应特征.
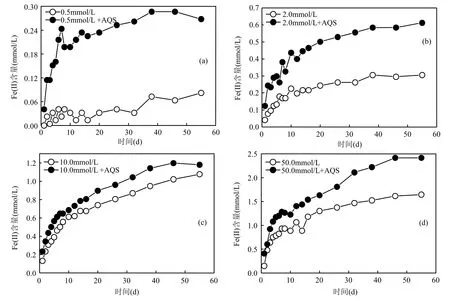
图1 S12菌还原不同浓度的针铁矿过程中Fe(II)浓度的变化Fig.1 The Fe(II) concentration during the microbial reduction of different content goethite
2.2 不同浓度的电子供体对针铁矿微生物还原特征的影响
考察各不同浓度(0.5,2.0,10.0,20.0mmol/L)的乳酸钠对针铁矿还原特征影响时,针铁矿悬液浓度为40mmol/L,其他成分及浓度同2.1节.添加电子转移载体AQS后,各浓度针铁矿和S12菌相互作用程度得到加强,针铁矿生物可利用性程度(可还原率),分别增加了 83.00%,43.94%,67.87%和83.84%(图2);Fe(II)浓度峰值的出现比无AQS体系经历的反应时间长,即表明了 AQS的添加,使得针铁矿还原反应得到进一步的加强.
2.3 微生物-针铁矿相互作用的动力学特征
各酶促反应下的针铁矿归一化还原速率表明(图3),当乳酸钠浓度为一恒定值时(20mmol/L),随着针铁矿浓度增加,还原速率减小.随着针铁矿浓度增加,反应体系可见有聚集现象发生,比表面积减小,对菌体的吸附能力减弱,微生物和针铁矿表明得不到有效的接触,故针铁矿的酶促反应得到显著减弱.
乳酸钠作为电子供体条件下,针铁矿的还原作用可用式(1)表示:
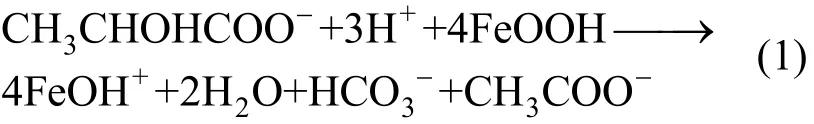
由式(1)的化学计量系数比,结合图2,可知该体系中,乳酸钠浓度超过0.5mmol/L时,电子供体浓度即达到饱和,故当乳酸钠浓度为2mmol/L时,还原反应相对于乳酸钠而言,可视为零级反应,其浓度对反应速率的影响比其在低浓度条件下要微弱的多.故在针铁矿浓度为 40mmol/L定值时,针铁矿的归一化还原速率随着乳酸钠浓度增加而增加,且在乳酸钠浓度大于2mmol/L以后,还原速率增加程度减弱(图 3).图 3还表明:在添加AQS后,不同浓度的电子供体(乳酸钠)以及不同浓度的针铁矿体系中,针铁矿的归一化还原速率均高于未添加AQS条件下.这和Fe(II)浓度随时间变化的趋势类似(图1、图2),再次验证了AQS等氧化还原中介体对微生物-铁氧化物相互作用过程中的促进效应.
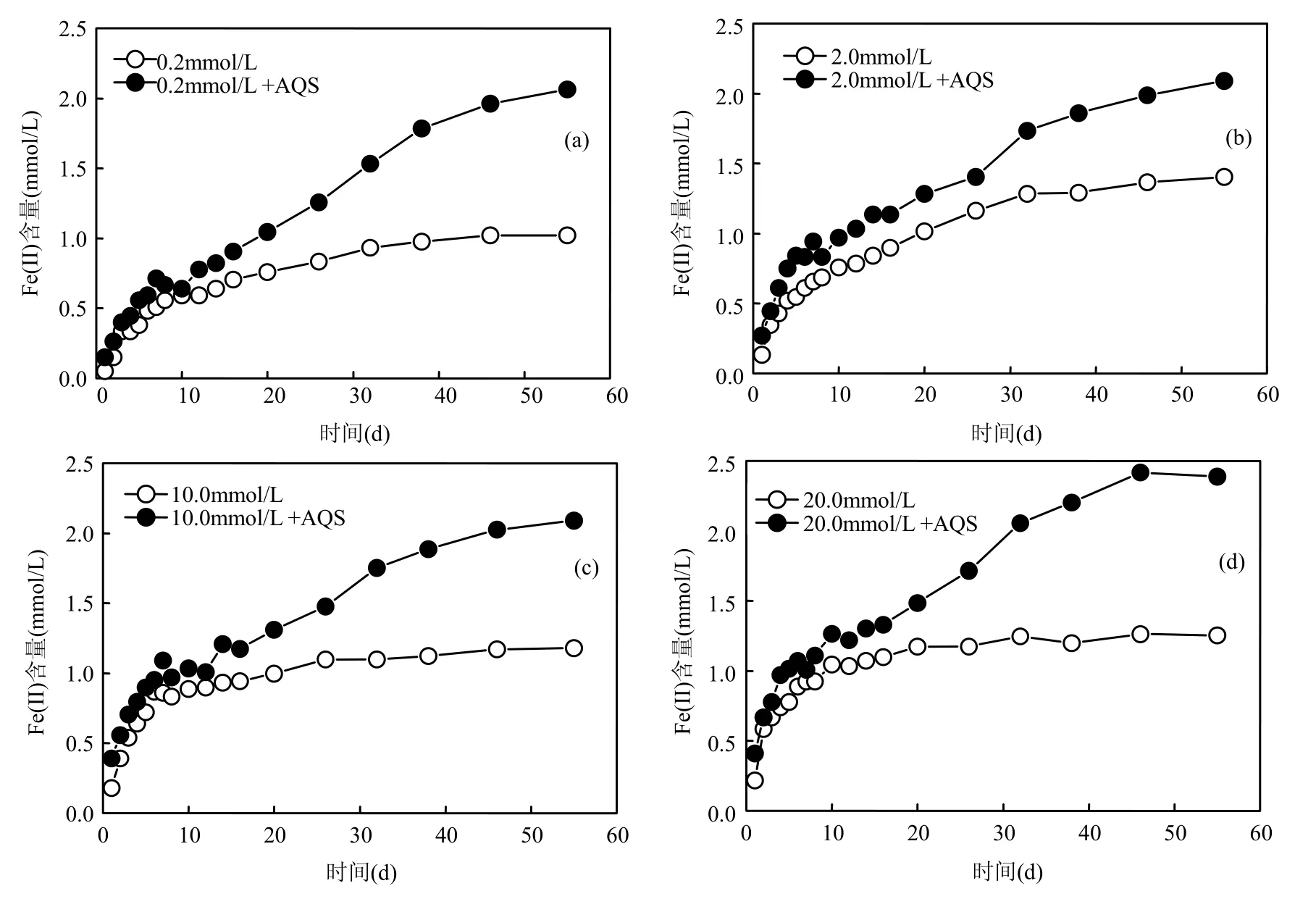
图2 乳酸钠浓度对S12菌还原针铁矿的影响Fig.2 The Fe(II) concentration during the microbial reduction of goethite in different content of lactate
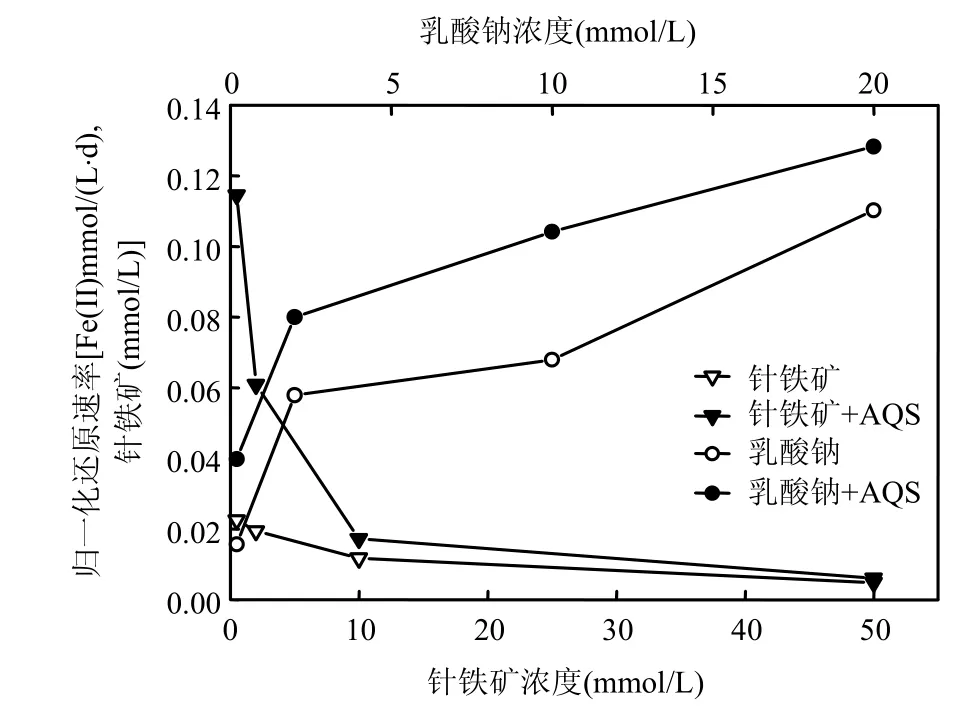
图3 乳酸钠和针铁矿浓度对针铁矿归一化还原速率的影响Fig.3 the effect of concentration of lactate and goethite on the normalized microbial reduction rate
微生物参与的针铁矿还原反应可用米氏方程来描述,它表示一个酶促反应的起始速度(V)与底物浓度(S)关系的方程,米氏方程形式如下:
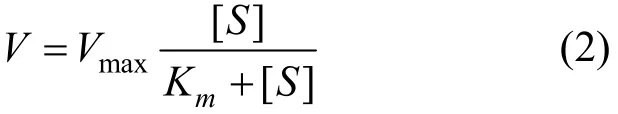
式中: Vmax为酶被底物饱和时的反应速度;Km值称为米氏常数.分别以针铁矿和乳酸钠为底物,考察了针铁矿的微生物还原反应特征,并用米氏方程进行了拟合,结果见图4.米氏方程拟合结果表明:添加 AQS时,不同的底物(针铁矿,乳酸钠)所对应的 Vmax几乎相等,约为0.3d-1左右(表1);而未添加 AQS时,以针铁矿作为底物条件下的Vmax大于以乳酸钠为底物条件下的Vmax,即表明S12菌有明显的以铁氧化物为电子受体的厌氧呼吸特征.添加AQS后,微生物和针铁矿之间的相互作用更易进行,其良好的电子转移载体的作用使得底物性质差异对Vmax的制约作用不再明显,Vmax值相差无几.Km可以反映酶与底物亲和力的大小,Km值越小,其亲和力越大[22].Km在添加AQS后显著降低,这表明 AQS的加入,使得 S12菌-针铁矿之间的亲和程度加强,电子在微生物-针铁矿之间的传递更易进行,促进了反应的进行,故该条件下的 Vmax比未添加 AQS的要大.
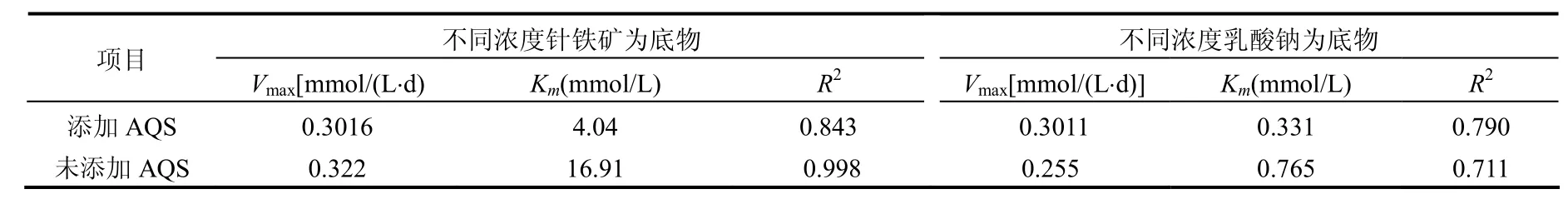
表1 针铁矿还原的米氏方程拟合结果Table 1 The fitted parameters of the Michaelis-Menten Equation
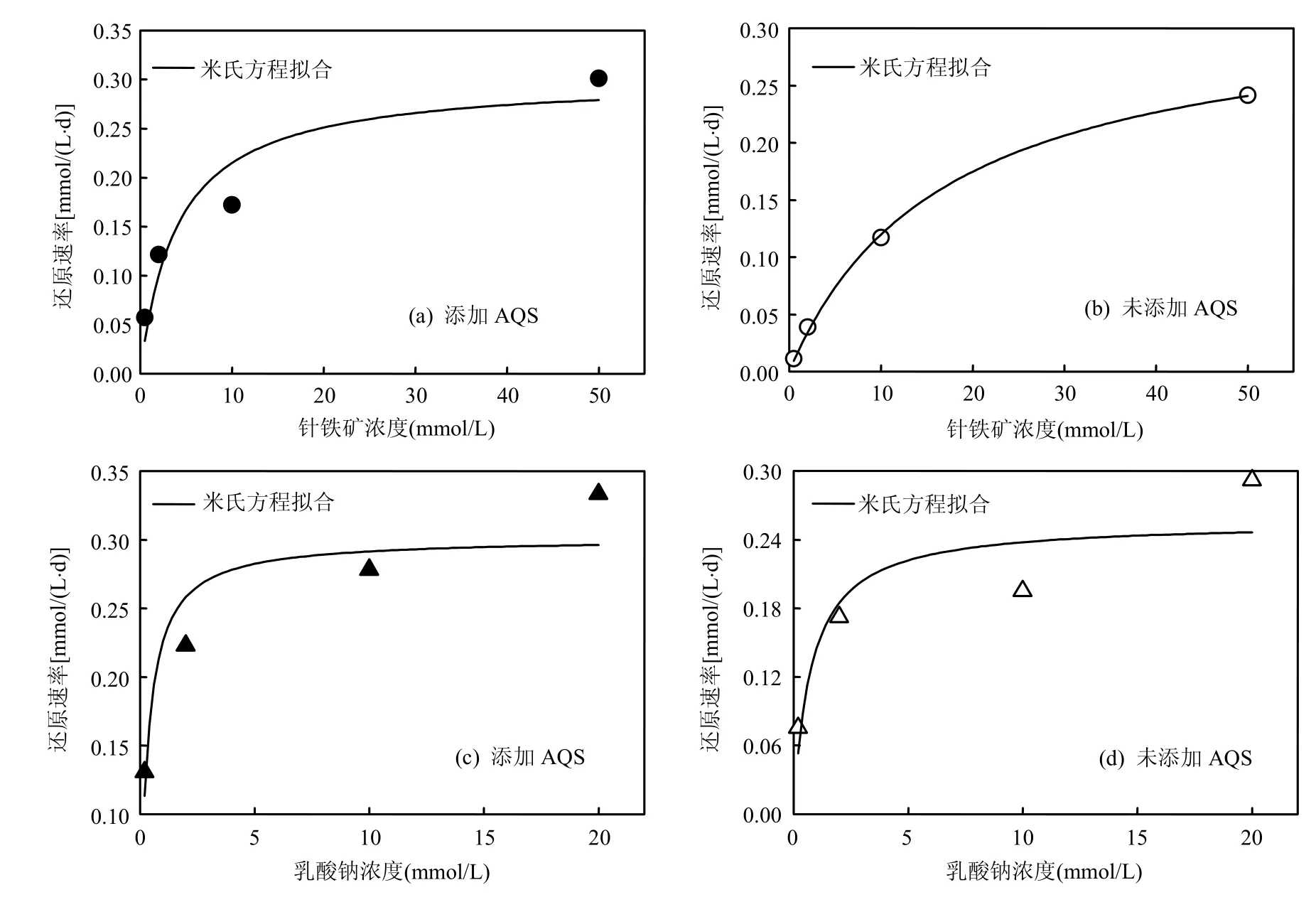
图4 S12菌还原针铁矿过程中的米氏方程拟合Fig.4 The reduction of the Michaelis-Menten Equation fitted type
根据式(1),针铁矿还原过程中的Gibbs自由能变化(∆Gr)可用式(3)表示:
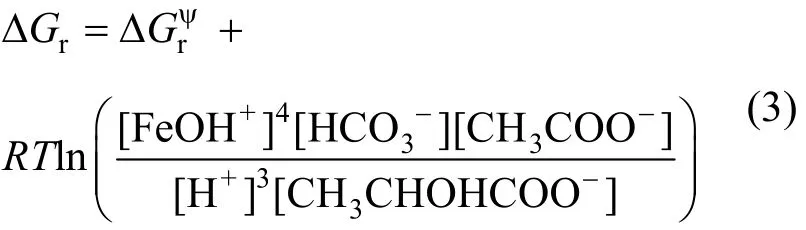
微生物厌氧呼吸时所产生的能量一部分用于三磷酸腺苷 (ATP)的合成,以维持代谢的正常进行,假设ATP合成所需能量为∆E,则在S12菌参与下的针铁矿还原过程中的 Gibbs自由能变化(∆Gr')为式(4):
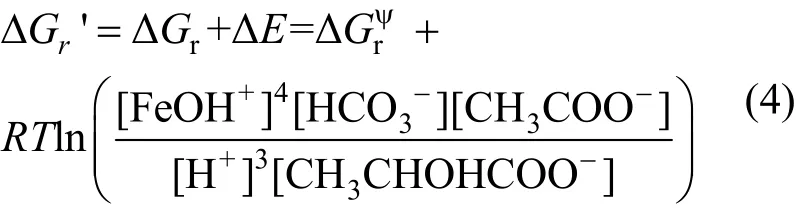

表2 不同底物条件下反应体系的∆E(kJ/mol)Table 2 The ∆E values in conditions of different concentration of substrate (kJ/mol)
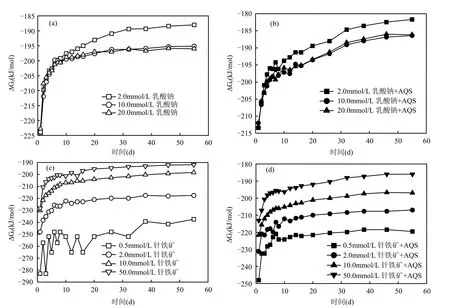
图5 S12菌还原针铁矿反应过程中的Gibbs自由能变化Fig.5 The Gibbs free energy during the microbial reduction of goethite
未接种体系中的被还原而解离的Fe(II)浓度未检测出,均接近或低于检测限,这主要是针铁矿为难溶物(Ksp=10-44),故未接种的针铁矿和乳酸钠体系,在热力学上是稳定的,在室温下几乎不能进行([FeOH+]≈0).接种后的体系,可明显观察到针铁矿的还原解离现象(图1,图2),微生物的参与使得式(1)的活化能降低,使针铁矿还原反应得以进行,当式(1)达到平衡时,即 ∆Gr'= ∆ Gr+∆E =0,故∆ E=-∆ Gr,说明反应体系必须提供∆E的最低能量以维持ATP的合成,使得微生物还原针铁矿的过程得以维持.由反应体系中各反应物和产物其在标准状况下的∆,可得∆,由式(3),并根据反应体系中各反应物和产物的浓度,可计算出体系经历不同反应时间所对应的∆Gr,结果见图5.式(1)平衡时,由 ∆ E=-∆ Gr可知不同体系中所需的∆E(表 2).在以针铁矿充当底物的体系中,∆E随着针铁矿浓度减小而增加,由针铁矿浓度和针铁矿归一化还原速率之间的关系(图3)可知,针铁矿浓度在较低的情况下,其S12菌对针铁矿的还原速率快,微生物活动参与程度越高,用来合成ATP所需的能量也随之上升.而随着乳酸钠浓度越高,针铁矿的归一化还原速率逐渐增加(图 3),在其过程的∆E也随之增加,当乳酸钠浓度大于 2.0mmol/L,还原速率增加程度减弱(图3),∆E值变化已不明显(图 5).未添加 AQS后的反应体系,不论底物的类型何如,其∆E均比添加AQS条件下的高,这验证了类似的结论:即 AQS等氧化还原中介体的缺失,使得电子在S12菌和针铁矿表面传递变得困难,需要更多的∆E用来合成ATP,使微生物还原反应过程得以有效进行.
3 结论
3.1 氧化还原中介体 AQS的加入,使得针铁矿的微生物还原程度加剧.反应经38d后,乳酸钠浓度为20m mol/L时,在添加AQS的0.5mmol/L针铁矿体系中,被还原解离出的 Fe(II)浓度是无AQS体系中的 394%.当针铁矿悬液浓度为40mmol/L时,不同浓度(0.5,2.0,10.0,20.0mmol/L)乳酸钠条件下,添加电子转移载体 AQS后,针铁矿的还原率分别增加了 83.00%,43.94%,67.87%和83.84%.
3.2 当乳酸钠浓度一定时,随着针铁矿浓度增加,针铁矿的归一化还原速率得到显著减弱.随着乳酸钠浓度的升高,针铁矿的归一化还原速率也随之上升.以针铁矿为底物时,未添加AQS时,S12菌-针铁矿相互作用的米氏方程拟合相关系数R2可达 0.998;电子转移载体的存在使得不同底物条件下的Vmax趋于一致,针铁矿为底物时的Km值大于乳酸钠为底物的Km值,表明了S12菌与不同底物亲合的难易程度.
3.3 对S12菌-针铁矿相互作用过程中的Gibbs自由能计算结果表明:在反应末期,随着反应速率的减缓,∆Gr值也趋于平稳;S12菌以针铁矿为电子受体进行厌氧呼吸时,针铁矿的还原速率越大,用于ATP合成所需∆E值也随之升高;体系中未加AQS时, S12菌对针铁矿的还原程度降低,需要更多的∆E用来合成 ATP,使微生物还原反应过程得以有效进行,从而使得∆E值升高.
[1] Ruebush S S, Icopini G A, Brantley S L, et al. In vitro enzymatic reduction kinetics of mineral oxides by membrane fractions from Shewanella oneidensis MR-1 [J]. Geochimica et Cosmochimica Acta, 2006,70(1):56-70.
[2] 许 伟,胡 佩,李艳红,等.微生物铁呼吸机制研究进展 [J]. 生态学杂志, 2008,27(6):1037-1042.
[3] Nealson K H, Myers C R. Microbial reduction of manganese and iron: new approaches to carbon cycling [J]. Appl. Environ. Microbiol., 1992,58(2):439-443.
[4] Lovley D R, Phillips E J P. Novel Mode of Microbial Energy Metabolism: Organic Carbon Oxidation Coupled to Dissimilatory Reduction of Iron or Manganese [J]. Appl. Environ. Microbiol., 1988,54(6):1472-1480.
[5] 卢晓霞,李广贺,张 旭,等.不同氧化还原条件下氯乙烯的微生物脱氯 [J]. 环境科学, 2002,23(2):29-33.
[6] Hertkorn N, Claus H, Schmitt-Kopplin P, et al. Utilization and Transformation of Aquatic Humic Substances by Autochthonous Microorganisms [J]. Environ. Sci. Technol., 2002,36(20):4334-4345.
[7] 李晓敏,李永涛,李芳柏,等.有机氯脱氯转化的铁还原菌与铁氧化物界面的交互反应 [J]. 科学通报, 2009,54(13):1880-1884.
[8] Vanbroekhoven K, Van Roy S, Gielen C, et al. Microbial processes as key drivers for metal (im)mobilization along a redox gradient in the saturated zone [J]. Environmental Pollution, 2007,148(3):759-769.
[9] Grybos M, Davranche M, Gruau G, et al. Is trace metal release in wetland soils controlled by organic matter mobility or Fe-oxyhydroxides reduction? [J]. Journal of Colloid and Interface Science, 2007,314(2):490-501.
[10] Cooper D C, Picardal F F, Coby A J. Interactions between microbial iron reduction and metal geochemistry: Effect of redox cycling on transition metal speciation in iron bearing sediments [J]. Environ. Sci. Technol., 2006,40(6):1884-1891.
[11] 曲 东,贺江舟,孙丽蓉.不同水稻土中氧化铁的微生物还原特征 [J]. 西北农林科技大学学报(自然科学版), 2005,33(4):97-101.
[12] 武春媛,李芳柏,周顺桂,等.成团泛菌MFC-3的分离鉴定及其腐殖质/Fe(Ⅲ)呼吸特性研究 [J]. 环境科学, 2010,31(1):237-242.
[13] Liu C, Kota S, Zachara J M, et al. Kinetic Analysis of the Bacterial Reduction of Goethite[J]. Environ. Sci. Technol., 2001, 35(12): 2482-2490.
[14] Schwertmann U, Cornell R M. Goethite [M]. Wiley-VCH Verlag GmbH, 2007:67-92.
[15] Xu M, Guo J, Cen Y, et al. Shewanella decolorationis sp. nov., a dye-decolorizing bacterium isolated from activated sludge of a waste-water treatment plant [J]. Int. J. Syst. Evol. Microbiol., 2005,55(1):363-368.
[16] 孔祥义,许玫英,陈绵才,等.脱色希瓦氏菌 S12的铁还原性能研究 [J]. 微生物学通报, 2006,27(3):98-103.
[17] Stookey L L. Ferrozine-a new spectrophotometric reagent for iron [J]. Analytical Chemistry, 1970,42(7):779-781.
[18] Nevin K P, Lovley D R. Potential for Nonenzymatic Reduction of Fe(III) via Electron Shuttling in Subsurface Sediments [J]. Environ. Sci. Technol., 2000,34(12):2472-2478.
[19] 张丽新,曲 东,易维洁.温度及 AQDS对氧化铁微生物还原过程的影响 [J]. 西北农林科技大学学报(自然科学版), 2009, 37(3):193-199,207.
[20] Zegeye A, Ruby C, Jorand F. Kinetic and Thermodynamic Analysis During Dissimilatory γ-FeOOH Reduction: Formation of Green Rust 1 and Magnetite [J]. Geomicrobiology Journal, 2007,24(1):51-64.
[21] Rau J, Knackmuss H-J, Stolz A. Effects of Different Quinoid Redox Mediators on the Anaerobic Reduction of Azo Dyes by Bacteria [J]. Environ. Sci. Technol., 2002,36(7):1497-1504.
[22] Freitas A C, Malcata F X. Michaelis-Menten kinetics: explicit dependence of substrate concentration on reaction time [J]. International Journal of Mathematical Education in Science and Technology, 1993,24(4):527-539.
The kinetic characteristics of the microbial reduction of goethite.
ZHU Wei-huang1*, ZANG Hui1, WU Feng-chang2(1.Key Laboratory of Northwest Water Resources, Environment and Ecology, Ministry of Education, Xi'an University of Architecture and Technology, Xi’an 710055, China;2. State Environmental Protection Key Laboratory for Lake Pollution Control, Chinese Research Academy of Environmental Sciences, Beijing 100012, China). China Environmental Science, 2011,31(5):820~827
Dissimilatory Fe(III) and Mn(IV) oxide reduction by microorganisms has an important influence on the geochemistry and fate of organic or metal contaminants in environments. To explore the kinetic characteristics of the microbial reduction of Fe(III) and Mn(IV) oxide is the key to understand the mechanism of the interaction of“microbial-oxide-contaminants”. The current study mainly discussed the influence of anthraquinone-2-sulfonate (AQS), the concentration of the electron donor and goethite on the reduction of goethite by S12. The results showed the electron shuttle, AQS, could enhance the degree of goethite reduction. After 38 days incubation, the dissolved Fe(II) concentration was as much as 3.94 times of that in the non-AQS addition cell-goethite reaction system. The Michaelis-Menten kinetic model fit calculations showed the significant correlation between the initial reduction rate and the substrate concentration with a correlation coefficient, R2, high enough to 0.998. The electron shuttle, AQS, could have considerable influence on Vmaxand Kmvalues. The more reduction rate raised, the more energy(∆E) will be more needed to drive ATP synthesis. When the microbial redox reaction almost kept in balance, the ∆G values reached the maximum.
microbial-reduction;goethite;lactate;kinetic characteristics
X172
A
1000-6923(2011)05-0820-08
2010-09-16
国家自然科学基金资助项目(40903042);教育部博士点新教师科学基金(20096120120012);中国博士后科学基金(20080441167);环境地球化学国家重点实验室开放基金(SKLEG8004)
* 责任作者, 副教授, zhuweihuang@yahoo.com.cn
朱维晃(1977-),男,安徽庐江人,副教授,博士,研究方向为环境介质中铁锰-污染物相互作用.发表论文20余篇.
