单肺移植治疗终末期慢性阻塞性肺疾病患者单中心经验
2011-12-13陈乾坤姜格宁何文新丁嘉安周晓汪浩陈昶朱余明高文王海峰杨健
陈乾坤 姜格宁 何文新 丁嘉安 周晓 汪浩 陈昶 朱余明 高文王海峰 杨健
随着近30年来肺移植外科技术的完善和器官保存方法的改进、免疫抑制剂的发展,肺移植受者术后长期存活已成为可能。近5年来国内各地争相开展肺移植,病例数增长较快,但多数单位的总例数仍非常少。目前国内肺移植手术的主要适应证之一为慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)。作为国内主要的肺移植中心之一,同济大学附属上海市肺科医院胸外科从2003年起至今8年期间共完成23例COPD患者的单肺移植手术,总体效果满意,现就这些资料作一回顾性分析,供同道参考。
1 对象与方法
1.1 研究对象
2003年1月至2011年2月期间共行同种异体单肺移植40例,其中终末期COPD患者23例(54.8%)。COPD患者中男性19例,女性4例,平均年龄为(57.3±9.8)岁(32~75岁);小于60岁10例(43.5%),大于等于60岁13 例(56.5%)。供、受者血型相同,补体依赖的细胞毒性试验阴性,群体反应性抗体水平低于10%。受者术前均接受呼吸康复训练。在移植术中体外循环使用率为13%(3/23)。
1.2 术中处理
供肺灌洗采用UW液(含前列腺素E1250μg/L)肺动脉顺灌+肺静脉逆灌,灌洗过程中持续通气(氧浓度50%)使供肺呈半膨状态。支气管和血管吻合完毕后,如移植肺过大与受者胸腔体积不匹配,则以Endo-GIA Stapler行移植肺上叶减容术。3例COPD患者术前发现有肺动脉高压,术中给予常规体外循环或体外膜肺氧合(ECMO)支持,术中血流动力学稳定,氧合满意,术毕停止转流。
1.3 呼吸机支持治疗
患者术毕改为经鼻气管插管返监护室后,常规予以呼吸机支持治疗。根据病情采用容量控制通气或同步间歇指令通气模式,依据动脉血气分析及生命体征调节通气参数直至脱离呼吸机、拔除气管插管。短期内无法停机的患者,尽早予以气管切开。
1.4 术后感染防治
术后先给予头孢哌酮钠舒巴坦钠(商品名舒普深)+左氧氟沙星(商品名可乐必妥)经验性联合抗感染治疗,随后根据痰培养结果及时调整抗生素。术后均立即给予预防性抗真菌治疗:制霉菌素液漱口,并联合雾化吸入两性霉素B,同时静脉或口服抗真菌药物(伏立康唑或伊曲康唑,近几年主要采用副作用相对较小的卡泊芬净)治疗1个月。术后均立即常规给予预防性抗病毒治疗:更昔洛韦250 mg,每天2次静脉滴注14 d,后改口服。
1.5 免疫抑制方案
术前2 h内及术后第4天巴利昔单克隆抗体(商品名莱舒)诱导治疗[早年采用术前1 d、术后第14天抗Tac单克隆抗体(商品名赛尼哌)诱导治疗],术后他克莫司+吗替麦考酚酯+糖皮质激素三联维持治疗。定期复查他克莫司血药浓度,以此调整用药剂量。
1.6 术后观察及随访
术后有专职人员对受者进行终身随访和观察,包括免疫抑制剂血药浓度的定期监测和剂量调整、定期体检、康复指导以及移植后相关疾病的处理等。
1.7 统计学方法
计量资料用中位数(第25~75百分位数)或均数±标准差表示,组间比较采用Student-Newman-Keuls检验;计数资料用频数(n)或率(%)表示,组间比较采用Fisher’s精确检验;采用Kaplan-Meier法估算存活率,组间存活率比较采用Log-Rank检验。
2 结果
23例COPD受者ICU住院时间中位数为30.50(21.25 ~47.75)d,气管插管(或切开)时间中位数为3(2 ~4.75)d。
2.1 术后肺功能监测情况
受者术后肺功能及动脉血气分析随访结果(部分参考本中心2009年随访资料[1])见表1。术后6个月、1年及2年肺功能测定显示第1秒用力呼气量、最大通气量及第1秒用力呼气量/用力肺活量均较术前有显著提高(均P<0.05),术后动脉血氧分压(PaO2)和二氧化碳分压(PaCO2)也均较术前有明显改善(均P<0.01)。术后不同时期的肺功能差异均无统计学意义,但是术后2年肺功能略呈下降趋势。
2.2 并发症发生情况
23例受者肺移植后并发症发生及其转归见表2(其中排斥反应另述)。
2.2.1 手术相关并发症
无支气管吻合口瘘发生,不同程度支气管吻合口软化、狭窄3例(13.0%),这3例受者均有曲霉菌感染史。其中1例经支架植入后好转,2例经支气管镜烧灼和扩张后缓解。支气管吻合口并发症均发生在早年应用伏立康唑+两性霉素B的受者中,而后期应用伊曲康唑(或卡泊芬净)+两性霉素B的受者无支气管吻合口并发症发生。
2.2.2 自体肺病变
1例受者因对侧自体肺严重感染伴大咯血可能危及移植肺,行对侧自体肺全切除;2例受者因对侧自体气肿肺组织过度膨胀引起纵膈移位,使移植肺扩张受限,行对侧肺减容术。经上述处理后所有患者均恢复良好。
表1 23例COPD患者移植前后肺功能及动脉血气分析的比较±s)
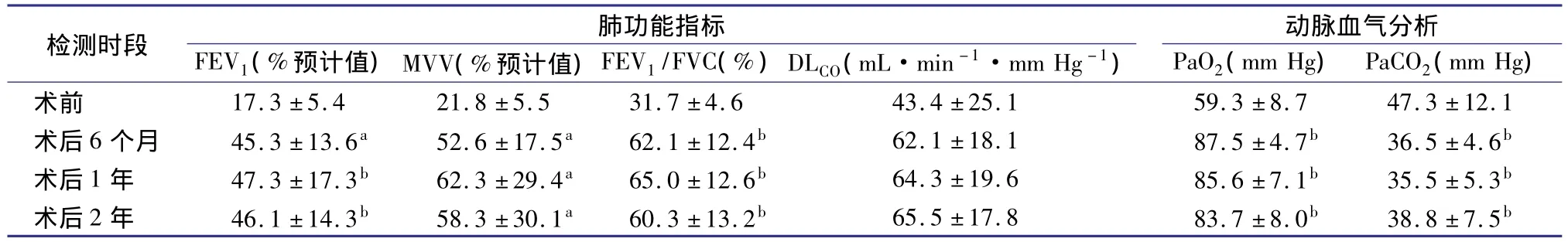
表1 23例COPD患者移植前后肺功能及动脉血气分析的比较±s)
注:与术前比较,a P<0.05,b P<0.01;FEV1,第1秒用力呼气量;MVV,最大通气量;FVC,用力肺活量;DLCO,肺一氧化碳弥散量;PaO2,动脉血氧分压;PaCO2,动脉血二氧化碳分压;1 mm Hg=0.133 kPa
检测时段 肺功能指标FEV1(%预计值)MVV(%预计值)FEV1/FVC(%)DLCO(mL·min-1·mm Hg-1)动脉血气分析PaO2(mm Hg)PaCO2(mm Hg)术前 17.3 ±5.4 21.8 ±5.5 31.7 ±4.6 43.4 ±25.1 59.3 ±8.7 47.3 ±12.1术后6 个月 45.3 ±13.6a 52.6 ±17.5a 62.1 ±12.4b 62.1 ±18.1 87.5 ±4.7b 36.5 ±4.6b术后1 年 47.3 ±17.3b 62.3 ±29.4a 65.0 ±12.6b 64.3 ±19.6 85.6 ±7.1b 35.5 ±5.3b术后2 年 46.1 ±14.3b 58.3 ±30.1a 60.3 ±13.2b 65.5 ±17.8 83.7 ±8.0b 38.8 ±7.5b
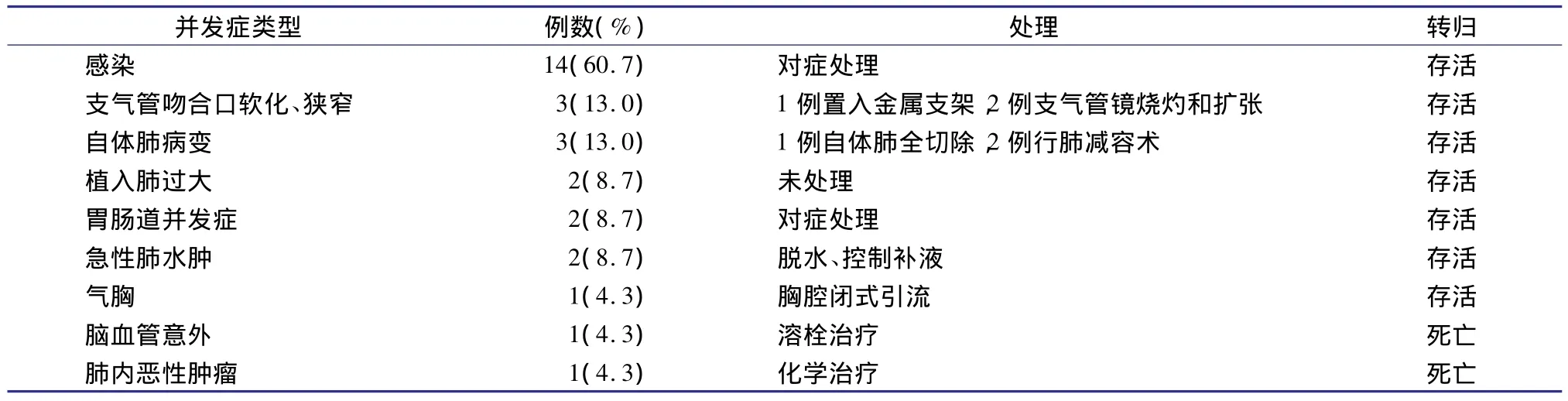
表2 23例COPD患者肺移植后并发症发生情况及转归
2.2.3 感 染
术后移植肺或双侧肺细菌感染共5例(21.7%),痰培养提示肺炎克雷伯菌、阴沟肠杆菌、金黄色葡萄球菌和嗜麦芽假单胞菌感染。真菌感染9例(39.1%),其中侵袭性真菌感染(均为曲霉菌)4例、真菌定植(为白色念珠菌或曲霉菌)5例。接受伏立康唑+两性霉素B预防性治疗的10例受者中,4例(40%)术后发生侵袭性真菌感染;而接受伊曲康唑(或卡泊芬净)+两性霉素B治疗的15例受者中,有5例(33.3%)发生真菌定植而无侵袭性真菌感染。与接受伏立康唑+两性霉素B预防性治疗的受者比较,应用伊曲康唑(或卡泊芬净)+两性霉素B的受者术后真菌感染的发生率降低(P=0.035)。
2.3 排斥反应发生情况
急性排斥反应均根据临床表现诊断,主要有低热、中性粒细胞数增加、活动后气促、X线摄片示肺门阴影增大或肺内云雾状阴影、大剂量糖皮质激素冲击治疗后症状缓解。术后6个月内共有8例(34.8%)受者出现轻度急性排斥反应,激素冲击治疗后均缓解。共有6例(26.1%)受者出现慢性排斥反应,均通过纤维支气管镜病理检查明确为闭塞性细支气管炎(BFO)。其中2例受者分别于术后14个月和2年因原发性移植物失功(PGD)和BFO行再次移植;2例给予大剂量甲泼尼龙冲击(500 mg/d,连用3 d)并增加他克莫司剂量提升血药浓度等治疗后症状明显改善;2例死于后期合并肺部感染。
2.4 受者存活情况及与原发病、性别、年龄关系
截至2011年5月,中位随访时间为38(3~93)个月,COPD受者术后1、3和5年存活率分别为83%、66%、45%,与非 COPD受者(78%、17%、17%)比较差异有统计学意义(P=0.013),见图1。
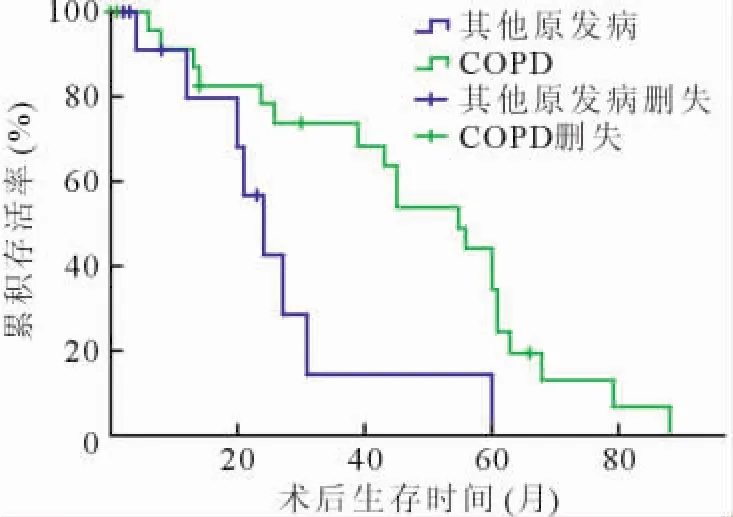
图1 不同原发病受者术后存活率比较
COPD受者中小于60岁者与大于等于60岁者术后1、3、5年存活率分别为78%与86%、70%与75%、31%与43%,差异无统计学意义(P=0.963),见图2。
COPD受者男性与女性术后1、3、5年存活率分别为93%与76%、79%与48%、32%与48%,差异无统计学意义(P=0.543),见图3。
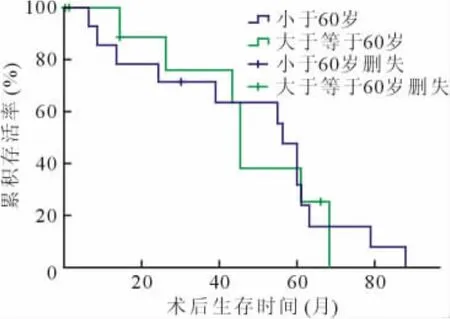
图2 不同年龄慢性阻塞性肺疾病受者术后存活率比较
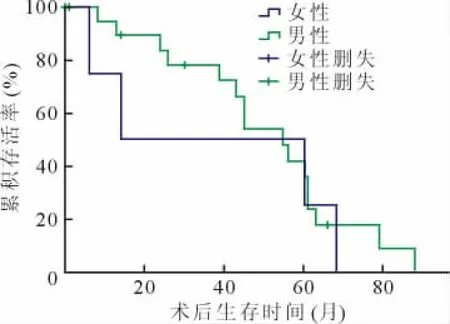
图3 不同性别慢性阻塞性肺疾病受者术后存活率比较
2.5 转 归
截至2011年5月,术后共17例受者存活,中位存活时间为43(3~93)个月,其肺功能与生活质量均有明显改善和提高。23例受者中共死亡6例,其中围手术期死亡1例(4.3%),死因为脑血管意外。与非COPD受者围手术期病死率23.5%(4/17)比较,COPD受者围手术期病死率较低(P=0.031)。此外,1例受者死于移植术后肺内恶性肿瘤;2例死于慢性排斥反应合并肺部感染;1例死于再次移植术中出血性休克;1例再次移植术后存活39个月死于排斥反应。
3 讨论
自1983年Cooper领导的多伦多肺移植组成功完成首例临床肺移植以来,经过近30年的发展,肺移植在世界各地广泛开展,目前已成为治疗许多终末期肺病的唯一有效方法,而终末期COPD是肺移植的最主要适应证[2]。我们曾报道2003—2007年的肺移植单中心资料[1],本文系病例继续积累和随访资料,希冀为国内COPD患者肺移植的疗效和预后评价提供素材。
3.1 肺移植适应证
国际心肺移植学会(ISHLT)资料显示,1995—2009年期间终末期COPD患者占所有肺移植患者的36%,其中在单肺移植中占48.0%,双肺移植中占26.4%,是肺移植的最主要适应证,其术后存活率较理想[2]。本文资料显示原发病构成中COPD占54.8%,COPD患者术后1、3和5年存活率均好于非COPD患者。虽然COPD患者年龄大,但围手术期病死率较非COPD患者低[2],这可能与COPD患者术中体外循环的使用率较低有关,因为体外循环所致的一系列并发症是增加受者围手术期病死率的重要因素[3]。本组有2例受者术中使用ECMO取得满意效果。ECMO适用于围手术期低氧血症和循环不稳定的辅助支持,有减少肝素的使用量、减轻移植肺的炎症反应和获得较好的手术视野等优点。虽然ECMO对机体的生理影响要小于常规体外循环,但是ECMO是否能完全取代常规体外循环作为肺移植术中体外循环支持的标准术式目前还存在争议[4]。
再次肺移植比首次肺移植手术更具风险,应该严格掌握手术指征。本组的2例分别于术后14个月和24个月因PDG和BFO接受再次移植。前者由于术中出血性休克而死亡,后者再次移植术后存活39个月。Aigner等[5]的研究显示因早期PGD行再次移植的受者术后30 d、1年和5年的存活率分别为52.2%、34.8%和29.0%;因后期 BFO 行再次移植的受者术后30 d、1年和5年的存活率分别为89.2%、72.5%和61.3%。早期因PGD行再次移植的受者病死率较高,而且长期生存获益率较低,应该避免对此类患者行再次移植;而对于后期因BFO或气管并发症行再次移植的受者可以获得较长的生存时间,则可考虑积极的再次移植手术治疗。
2010年ISHLT的统计数据显示自1994年起,每年单肺移植的数量基本不变,而双肺移植的数量逐年增多,约占每年肺移植总量的71%。对于COPD受者,单肺、双肺移植术后的短期存活率无差别,不过双肺移植能显著提高长期存活率[2]。但是,对于大于60岁的高龄患者,双肺移植手术的围手术期风险及病死率较高,所以对于高龄患者双肺移植的这个优势很难体现出来[6-7]。鉴于上述原因,本组COPD受者均采用单肺移植。目前国内双肺移植的数量少、成功率极低,经验较少。对一些相对年龄较低的COPD受者,是否可采用双肺移植值得探讨。
3.2 肺移植受者存活率分析
2010年ISHLT数据肺移植术后1、3、5年的存活率分别为79%、63%、52%[2],本文资料为83%、66%、45%。一些术后并发症如自体肺过度膨胀、急性肺水肿、植入肺过大以及支气管吻合口软化、狭窄等多发生在我们开展移植工作早期阶段(2003—2005年期间)。随着经验的积累和技术的提高,此类并发症已较少在近年的肺移植病例中出现。
ISHLT资料表明存活率与移植受者的年龄密切相关,1年存活率大于65岁的患者为73%,小于50岁患者为80%;5年存活率大于65岁的患者为36%,小于50岁患者为55%[2]。本组以60岁为分界点,发现2个年龄组的存活率无差异,可能与样本数量少有关。虽然不排除其他可能影响存活率的因素如原发病、其他脏器功能状态、营养状况等,但高龄确实是影响肺移植术后远期存活率的重要因素之一[2]。事实上,移植技术随着时代的发展而进步,近些年来,高龄移植受者所占比例明显增加,同时其术后存活率也有很大的提高。本研究中的最高龄COPD患者75岁,现存活良好。所以只要严格掌握筛选标准和加强围手术期管理,高龄也非肺移植手术的禁忌。
在本研究中,供者均为男性,结果显示男性和女性COPD受者的术后存活率差异没有统计学意义。2006年ISHLT的统计数据显示受者的预后与供受者间的性别匹配有关,接受女性供者的女性受者预后最好,接受女性供者的男性受者预后最差[8],但是在2010年ISHLT的报告中对此却无说明[2],所以还有待于深入探讨。
3.3 移植后并发症的发生及处理
除了感染、气胸等并发症外,自体肺过度膨胀是COPD移植术后常见的问题之一。过度的自体肺膨胀可导致纵膈受挤压移位,限制并扰乱移植肺的正常通气从而严重影响移植肺功能。本组2例受者因术后对侧自体气肿肺组织过度膨胀行对侧肺减容术,取得良好效果,肺功能得以恢复。对于COPD单肺移植受者,如果移植术中情况稳定,可考虑行同期对侧自体肺减容术。值得注意的是,移植肺过大与受者胸腔体积不匹配时,也会造成移植肺组织损伤、肺不张和通气、血循环失调,影响其功能[9]。本组研究早期有2例出现植入肺过大的情况,但在后期的移植手术过程中出现尺寸不匹配时,则以Endo-GIA Stapler行移植肺上叶减容术,取得满意效果。如果移植肺减容后体积仍大,则可考虑行肺叶移植术。
肺移植受者术后真菌感染的发生率仅次于细菌感染,可达14%~32%,且一旦发生,病死率高、治疗费用昂贵[10]。我们在国际常用抗真菌治疗方案的基础上,结合国人的具体情况作了相应的调整[1]。本研究中,抗真菌药物的剂量和疗程均低于文献报道,但真菌感染的发生率仅为36%。本文资料中,出现了支气管吻合口并发症的受者均有曲霉菌感染,提示真菌感染尤其是曲霉菌感染是支气管吻合口并发症发生的重要因素[11-12]。此外,Weigt等[13]的近期研究也显示移植肺真菌定植是术后发生BFO的一个重要危险因素。因此早期预防性抗真菌治疗具有非常重要的临床意义。值得注意的是,某些抗真菌药物(如两性霉素B、伏立康唑和伊曲康唑)会影响他克莫司血药浓度,所以在同时用药时,应密切监测他克莫司血药浓度,以便及时调整药物用量。
3.4 免疫抑制方案的选择
在肺移植术后第1年内有36%的患者出现至少1次急性排斥反应。免疫诱导治疗能有效提高移植受者存活率,减少急性排斥反应的发生率[2]。大量研究表明急性排斥反应发生的次数和严重程度与后期的BFO的发生率呈显著正相关[14]。目前国际上免疫抑制治疗尚无统一的方案,本组采用IL-2受体拮抗剂(抗Tac单克隆抗体和巴利昔单克隆抗体)作为移植手术的常规诱导治疗,他克莫司+吗替麦考酚酯+糖皮质激素维持治疗,效果满意。术后6个月内本组COPD患者中仅有8例(34.8%)出现轻度急性排斥反应。本研究结果显示受者术后急性排斥反应的发生次数和慢性排斥反应的发生率与ISHLT的统计数据接近[2],提示该免疫抑制治疗方案适合国人。术后需密切监测并及时调整他克莫司的血药浓度,以便更好防治急慢性排斥反应。
综上所述,合适的COPD受者、移植术式及治疗方案对COPD肺移植受者长期生存有重要的意义。国内COPD肺移植受者术后生存影响因素和治疗方案的探讨还有待于今后大样本、多中心资料分析。
1 何文新,姜格宁,丁嘉安,等.23例次肺移植术后受者的临床分析[J].中华器官移植杂志,2009,30(4):41-43.
2 Christie JD,Edwards LB,Kucheryavaya AY,et al.The Registry of the International Society for Heart and Lung Transplantation:twentyseventh official adult lung and heart-lung transplant report—2010[J].JHeart Lung Transplant,2010,29(10):1104-1118.
3 Dalibon N,Geffroy A,Moutafis M,et al.Use of cardiopulmonary bypass for lung transplantation:a 10-year experience[J].JCardiothorac Vasc Anesth,2006,20(5):668-672.
4 Bittner HB,Binner C,Lehmann S,et al.Replacing cardiopulmonary bypass with extracorporeal membrane oxygenation in lung transplantation operations[J].Eur J Cardiothorac Surg,2007,31(3):462-467.
5 Aigner C,Jaksch P,Taqhavi S,et al.Pulmonary retransplantation:is it worth the effort?A long-term analysis of 46 cases[J].J Heart Lung Transplant,2008,27(1):60-65.
6 Thabut G,Christie JD,Ravaud P,et al.Survival after bilateral versus single lung transplantation for patients with chronic obstructive pulmonary disease:a retrospective analysis of registry data[J].Lancet,2008,371(9614):744-751.
7 Lawrence EC.Lung transplantation for COPD:one lung,two lungs,or none?[J].Lancet,2008,371(9614):702-703.
8 International Society of Heart and Lung Transplantation Registry,Sato M,Gutierrez C,et al.The effect of gender combinations on outcome in human lung transplantation:the International Society of Heart and Lung Transplantation Registry experience[J].J Heart Lung Transplant,2006,25(6):634-637.
9 Oto T,Date H,Ueda K,et al.Experimental study of oversized grafts in a canine living-donor lobar lung transplantation model[J].J Heart Lung Transplant,2001,20(12):1325-1330.
10 Kubak BM.Fungal infection in lung transplantation[J].Transpl Infect Dis,2002,4(Suppl 3):S24-S31.
11 Nunley DR,Gal AA,Vega JD,et al.Saprophytic fungal infections and complications involving the bronchial anastomosis following human lung transplantation[J].Chest,2002,122(4):1185-1191.
12贾向波,姜格宁,丁嘉安,等.肺移植术后气道吻合口狭窄的原因和治疗[J].中华器官移植杂志,2006,27(2):84-85.
13 Weigt SS,Elashoff RM,Huang C,et al.Aspergillus colonization of the lung allograft is a risk factor for bronchiolitis obliterans syndrome[J].Am JTransplant,2009,9(8):1903-1911.
14 Dumonceaux M,Knoop C,Rondelet B,et al.Complications of lung transplantation:perioperative complications,acute and chronic rejection[J].Rev Mal Respir,2009,26(6):639-653.in French.
