雷氏大疣蛛粗毒对DRG细胞上钠钾钙离子通道的影响
2011-12-08王小娟朱阳慧刘中华
王小娟,朱阳慧,刘中华
(湖南师范大学生命科学学院,蛋白质组学与发育生物学教育部重点实验室,中国长沙 410081)
雷氏大疣蛛粗毒对DRG细胞上钠钾钙离子通道的影响
王小娟,朱阳慧,刘中华*
(湖南师范大学生命科学学院,蛋白质组学与发育生物学教育部重点实验室,中国长沙 410081)
采用全细胞记录(whole-cell recording)模式膜片钳技术在大鼠背根神经节细胞(dorsal root ganglia,DRG)上检测了雷氏大疣蛛粗毒对电压门控钠通道、钾通道及钙通道的影响.结果表明,雷氏大疣蛛粗毒对TTX-R型钠电流、电压门控钾电流以及钙电流均无明显作用,但对TTX-S型钠电流表现出较强的浓度依赖性抑制效应,半有效抑制浓度(IC50)为11.04 mg/L.100 mg/L雷氏大疣蛛粗毒对DRG细胞TTX敏感性钠电流的电压-电流(I-V)曲线的激活阈值和逆转电位均有近-10 mV的漂移作用,并使稳态失活曲线向超极化方向漂移15 mV左右,但并不影响失活曲线的常数k.
雷氏大疣蛛;粗毒;大鼠背根神经节(DRG);全细胞膜片钳;河豚毒素敏感型钠通道
雷氏大疣蛛(Macrothele raveni)[1]是最近在我国广西壮族自治区宁明县境内发现并由河北大学朱明生教授定名的异仿蛛科大疣蛛属新种,大部分生活于热带和亚热带,其粗毒中含有多种生物活性成分,可使昆虫及小型脊椎动物致死.有毒动物分泌的毒液所含的成分十分复杂,根据相对分子质量大小可分为3类:小分子无机物或有机物(<1 000)、多肽类(1 000─10 000)和蛋白质类(>10 000)[2].本研究室通过膜片钳技术和电压钳技术研究发现,很多蜘蛛毒素具有毒性是由于它们作用于细胞膜表面的离子通道,是多种离子通道受体,长期以来本实验室在蜘蛛毒素研究方面主要集中于神经毒素研究.
很多蜘蛛粗毒中含有对哺乳动物及昆虫神经系统有阻断作用的活性成分,如对钠通道的影响可抑制神经系统兴奋传导.肖玉成等人[3]发现雷氏大疣蛛粗毒对NG10-15细胞上的电压门控钠通道有阻断作用,但目前还未报道从雷氏大疣蛛粗毒中分离纯化出对钠通道具有阻断活性的毒素分子.曾雄智等人从雷氏大疣蛛粗毒中纯化得到雷氏大疣蛛毒素-Ⅱ[4]和雷氏大疣蛛毒素-Ⅵ[5],这两种毒素经实验表明都是神经毒素肽,但不具有离子通道活性.
另外,雷氏大疣蛛粗毒还具有其他生物学活性.Jackson T[6]等人发现雷氏大疣蛛粗毒含有纤溶酶活性,具有较好的纤溶作用.还有研究表明,雷氏大疣蛛粗毒对肝癌细胞的增殖具有抑制作用[7],对于肿瘤细胞株Hela[8]和HepG2[9]的生长具有较为明显的抑制作用,这说明雷氏大疣蛛粗毒中很可能含有细胞毒活性成分.
本研究通过在大鼠背根神经节(DRG)细胞上进行膜片钳全细胞记录实验,研究雷氏大疣蛛粗毒对电压门控钠、钾、钙通道的影响,进行了初步生物学活性鉴定,发现毒素对TTX-S型钠通道具有明显的阻断作用,并对这种阻断作用进行了较为深入的研究和分析.
1 材料和方法
1.1 粗毒和动物
雷氏大疣蛛粗毒购自广西南宁市南方蜘蛛研究所.
SD大鼠(即Sprague-Dawley品系大白鼠)购买自湖南农业大学并在本实验室动物房短期饲养.
1.2 实验仪器
膜片钳研究用倒置显微镜OlympusⅨ70;PC-10型电极拉制仪为Narishige产品;膜片钳加药用微量注射器为Narishige IM-5B型.使用EPC-10膜片钳放大器(HEKA,国产),该放大器由PC机下运行的Pulse+pulsefit8.0软件控制(HEKA,Germany),内置于EPC-10中的ITC-16多功能数据采集卡(Instrutech,USA)控制接口和数据的采集和记录.
1.3 溶液配制
DRG细胞培养液:称取DMEM干粉346 mg+NaHCO374 mg,溶于20 mL双蒸水后,用1 mol/L NaOH调pH至7.4,如DMEM中不含HEPES,则需按2∶1的物质的量之比加入.溶液配好后用99.9%的氧气饱和10 min左右,溶液颜色变为橙红色即可,并于36℃水浴预热备用.
消化液:胶原酶(Collagenase IA 1.56 mg)+胰蛋白酶(Trypsin 0.66 mg),用上述充氧饱和的DMEM培养液5 mL溶解后于36℃预热备用.
消化抑制剂:胰蛋白酶抑制剂(Zn-inhibitor,1.2 mg).
记录钠通道的电极内液为(mmol/L):CsF 135,NaCl 10,HEPES 5.用1 mol/L CsOH和HCl将pH值调至7.0.
细胞外液为(mmol/L):NaCl 30,MgCl21,CaCl21.8,CsCl 5,KCl 5,D-glucose 25,HEPES 5,Triethanolamine Chlorine(TEA-Cl)20,Tetramethylammonium Chloride 70.用1 mol/L TEA-OH将pH值调至7.4.
记录钾通道的电极内液为(mmol/L):KF 120,NMG 20,EGTA 10,MgATP 2,GTP 0.5,HEPES 10.用1 mol/L KOH将pH值调至7.4.
细胞外液为(mmol/L):choline chloride 130,KOH 5,HEPES 10,D-glucose 12,MgCl22,CaCl22.用1 mol/L KOH将pH值调至7.4.
记录钙通道的电极内液为(mmol/L):CsCH3SO3108,MgCl24,EGTA 9,HEPES 9,MgATP 3.6,creatine kinase(50 units/mL).用1 mol/L CsOH将pH值调至7.4.
细胞外液为(mmol/L);BaCl25,tetraethylammonium chloride 160,EGTA 0.1,HEPES 10.用1 mol/L TEAOH将pH值调至7.4.
DMEM干粉、胶原酶、胰蛋白酶、胰蛋白酶抑制剂均购自Sigma公司.
1.4 大鼠背根神经节细胞急性分离和培养
取体重180~200 g的SD大白鼠,雌雄不拘,断颈处死后,用手术剪迅速取出脊椎剪至胸腰椎段,剪成2~3段,再沿与肋骨平面垂直的方向将椎管剪开,放入盛有少许DMEM培养液的小烧杯中浸泡.用尖头镊子剥除脊髓,并撕去附着在椎管内壁上的一层粘膜,暴露位于椎孔的背根神经纤维,挑取10~20个左右并放入盛有2 mL培养液的培养皿中.用维纳斯剪和尖头镊子分离出神经节,切除包在节外的絮状物和轴索后,放入盛有0.5 mL培养液的培养皿中.用吸管吸去培养液,将分离好的所有神经节用维纳斯剪剪碎(剪碎时间5~8 min为宜),越碎越好.之后转入消化液中于36℃,200 r/min环境中酶解20~25 min,期间每隔7~8 min用1 mLTip头吹打均匀.于消化液中加入酶的抑制剂,终止酶解反应.转入15 mL离心管中进行离心(1 000 r/min,3 min),弃上清,加入体积分数为5%的小牛血清培养液.重悬细胞后分装于2~3个35 mm培养皿中(事先铺一层多聚赖氨酸促进贴壁),再放入培养箱(VCO2∶V空气=1∶19)中培养3 h贴壁.贴壁后的DRG细胞有球形和椭球形两种,并带有一或长或短的轴突,质膜光滑可见,胞质均匀.DRG细胞的急性分离受外界条件的干扰较严重,如环境温度、季节、酶的浓度、消化时间等,故在实验过程中应随时注意调整几种酶的量与消化时间,以达最佳分离效果.
1.5 膜片钳全细胞记录
实验前先将1.5 mL恢复至室温的细胞外液更换培养皿内的组织培养液,实验在20~25℃室温条件下进行.注意换液时一定要格外小心,液流速度不能过快,防止贴壁的细胞从培养皿底部脱落而悬浮于液面上.
首先将细胞置于倒置显微镜下观察细胞状态,选择质膜光滑可见、胞质均匀且不与其他细胞重叠的健康细胞作为实验细胞.与膜片钳放大器相连的电极银丝在实验前进行AgCl泛极化处理,避免银丝与电极内液、细胞外液发生离子交换产生Ag+.参考电极与细胞外液之间用150 mmol/L NaCl-琼脂盐桥与细胞外液相连,琼脂盐桥可以防止参考电极NaCl溶液进入细胞外液而改变细胞周围的离子浓度.硼硅酸盐玻璃毛细管(100 μL,VWR company,USA)在电极拉制仪(PC-10,Narishige)上经两步拉制而成尖端口径为1.5~2.0 μm的钳制玻璃电极.钳制电极充灌细胞内液后用注射器加入少许正压然后入水,一般入水后所测电阻为1.5~2.5 MΩ为佳,随后补偿消除电极液与细胞外液之间的液结电位(LJ).当调动微操让电极不断靠近细胞时,电极电阻会逐渐增大,当增大0.2 MΩ时,停止电极继续靠近细胞并释放正压,然后轻轻给予一负压,电极与细胞膜之间就可形成吉欧(GΩ)封接.补偿消除电极快电容(fastcapacitance).将细胞膜电位钳制在-60 mV,继续给予负压,将电极钳制的那小块细胞膜吸破.补偿消除细胞慢电容(Slow capacitance).形成全细胞记录模式后,把细胞电位钳制在-80 mV并稳定4~6 min,让电极内液和细胞膜内成分之间相互平衡,再施加去极化脉冲测试电流大小.记录电流信号经EPC-10膜片钳放大器以3 kHz和10 kHz双重滤波过滤.系统串联电阻一般补偿(Rseriescompensation)在60%~80%之间.实验过程中系统电阻(Rs)始终保持在5~10 MΩ的范围之内.线性漏电流和电容电流用P/4程序予以删除,数据和图形用pulsefit+pulse 8.0软件采集分析并储存在PC机微机硬盘上.PC机内置EPC-10的ITC-16多功能数据采集卡控制接口和数据的采集记录.
1.6 加药
实验过程中均采用微量注射器(IM-5B,Narishige)进行加药.加药管为软质玻璃毛细管经一步拉制而成,尖端口径为30~50 μm.当加药管灌满液体后,施加少许正压,防止当加药管入水时,细胞外液因为管内负压被倒吸而稀释药物浓度.加药时,加药管尖端置于距离实验细胞80~100 μm左右,且在显微镜的一个视野平面内细胞和加药管均应清晰可见.每次加药的剂量为10 μL,加药管内液体在10 s之内加完.之后立即给予细胞电刺激诱导,观察药物对电流的影响.
2 结果与讨论
大鼠背根神经节(DRG)是一种单级感觉神经元细胞,其细胞膜上含有的离子通道类型非常丰富,有电压门控钠通道、电压门控钾通道和电压门控钙通道[10].为了研究雷氏大疣蛛粗毒的生物学活性,作者采用全细胞膜片钳记录模式检测了粗毒对大鼠背根神经节(DRG)细胞上电压门控钠、钾、钙通道的影响.
2.1 雷氏大疣蛛粗毒对电压门控钠通道的影响
DRG细胞上的电压门控钠通道有2种不同的类型:河豚毒素敏感型(TTX-S)和河豚毒素不敏感型(TTX-R).一般来说,直径大于40 μm的细胞几乎只含有TTX-S型钠通道,而直径小于15 μm的细胞则同时含有2种类型的钠通道.在记录河豚毒素不敏感型钠电流时,可在细胞外液中加入200 nmol/L河豚毒素,通过阻断河豚毒素敏感型钠通道而分离出河豚毒素不敏感型钠通道.
2种类型的钠电流均以同一种去极化单脉冲方式诱导激活:将细胞膜电位钳制在-80 mV,测试电压-10 mV,持续时间50 ms,每隔5 s重复一次.在全细胞记录模式下,电流峰值幅度稳定后,用微量注射器施加毒素,同时给予重复刺激,并观察毒素对内向电流的影响.结果如图1A、B所示,100 mg/L粗毒对TTX-R型钠电流没有明显影响,但对TTX-S型钠电流具有明显抑制作用,说明粗毒中含有TTX-S型钠通道阻断活性的成分.100 mg/L粗毒抑制TTX-S型钠电流图形的形状和对照电流基本保持一致,说明粗毒不影响TTX-S型钠电流的激活相和失活相.
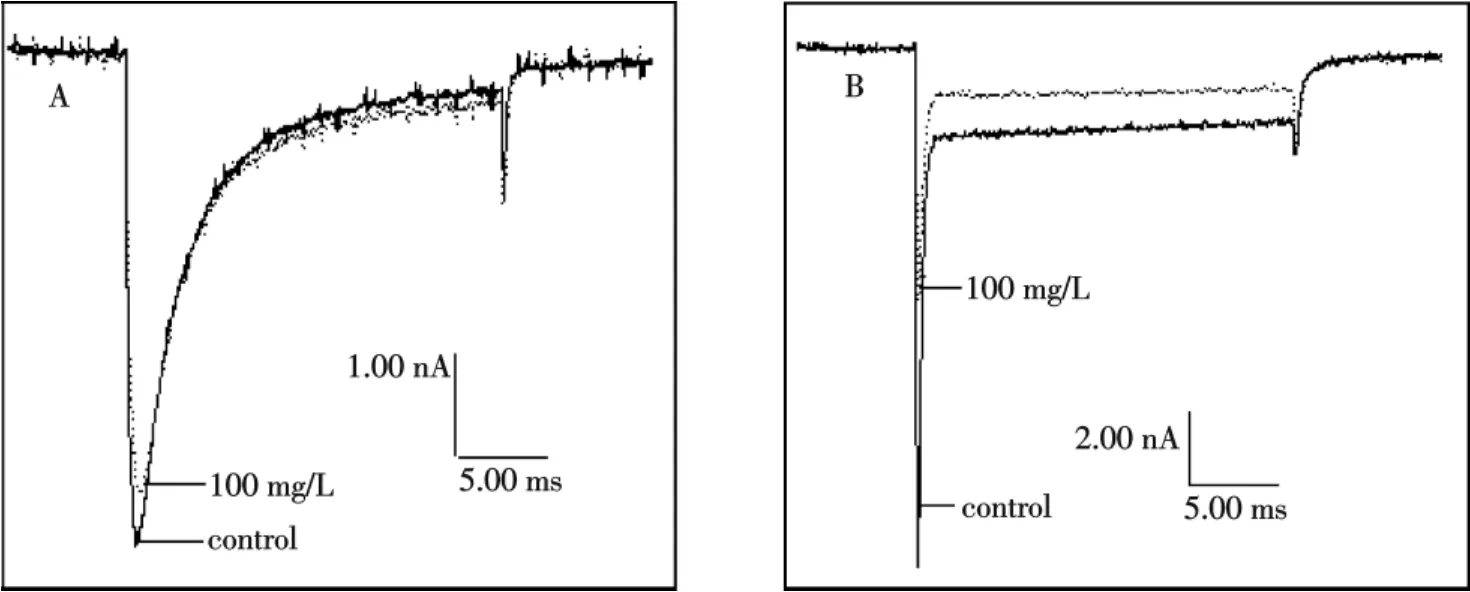
图1 雷氏大疣蛛粗毒(100 mg/L)对大鼠DRG细胞上TTX-R型(A)和TTX-S型(B)钠电流的影响(n=4)
作者进一步发现雷氏大疣蛛粗毒对TTX-S型钠电流的抑制效应具有浓度依从性,其半数有效抑制浓度(IC50)为11.041 mg/L(图2).图2中每个点的数据来自于4~6个实验细胞,用平均值±标准误差(mean±S.E.)来表示.浓度曲线用Boltzmman方程进行拟合得出IC50.方程Inhibition%=100/[1+exp(C-IC50)/k]中,C代表毒素浓度,IC50代表毒素半数有效抑制浓度,k是斜率.100 mg/L粗毒能抑制峰值电流幅度62.23%,但在6 min后可见较为明显的恢复现象,这可能与毒素浓度因扩散而降低有关,同时也预示着雷氏大疣蛛粗毒与钠通道的结合能力较弱.本研究室在研究3种蜘蛛粗毒对NG108-15细胞电压门控钠通道抑制作用时也发现,与雷氏大疣蛛粗毒相比,海南捕鸟蛛粗毒和虎纹捕鸟蛛粗毒中可能含有与TTX-S型钠通道结合能力更强的配体[3],也印证了雷氏大疣蛛粗毒与钠通道结合能力较弱.
在全细胞膜片钳记录模式下,将细胞钳制在-80 mV,分别给予一组测试电压,其变化范围为-80~+60 mV,步幅为+10 mV,持续时间为50 ms,可在DRG细胞上得到TTX-S型钠通道的激活电流-电压(I-V)关系曲线图(图3),并能揭示出通道的激活阈值(起始激活电压)、最大激活峰值电流电压和逆转电位大小.在空白对照条件下,TTX-S型钠通道的起始激活电压为-60 mV,最大峰值电流激活电压为-30 mV左右,逆转电位为+25 mV左右.在细胞周围加入100 mg/L雷氏大疣蛛粗毒后,让毒素与细胞作用1~2 min,再以相同的去极化脉冲诱导I-V曲线,结果见图3.粗毒几乎在各个测试电位水平均能抑制TTX-S型钠电流,但不改变内向电流最大峰值电流的激活电压,对激活阈值和逆转电位均有近-10 mV的漂移作用.激活阈值漂移说明雷氏大疣蛛粗毒使TTX-S型钠通道更易激活,逆转电位发生近-10 mV的漂移作用可推断,粗毒中可能含有影响通道对钠离子选择透过性的配体.
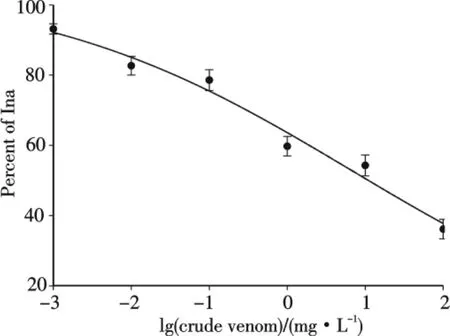
图2 雷氏大疣蛛粗毒抑制大鼠DRG细胞TTX-S型钠电流的浓度效应曲线
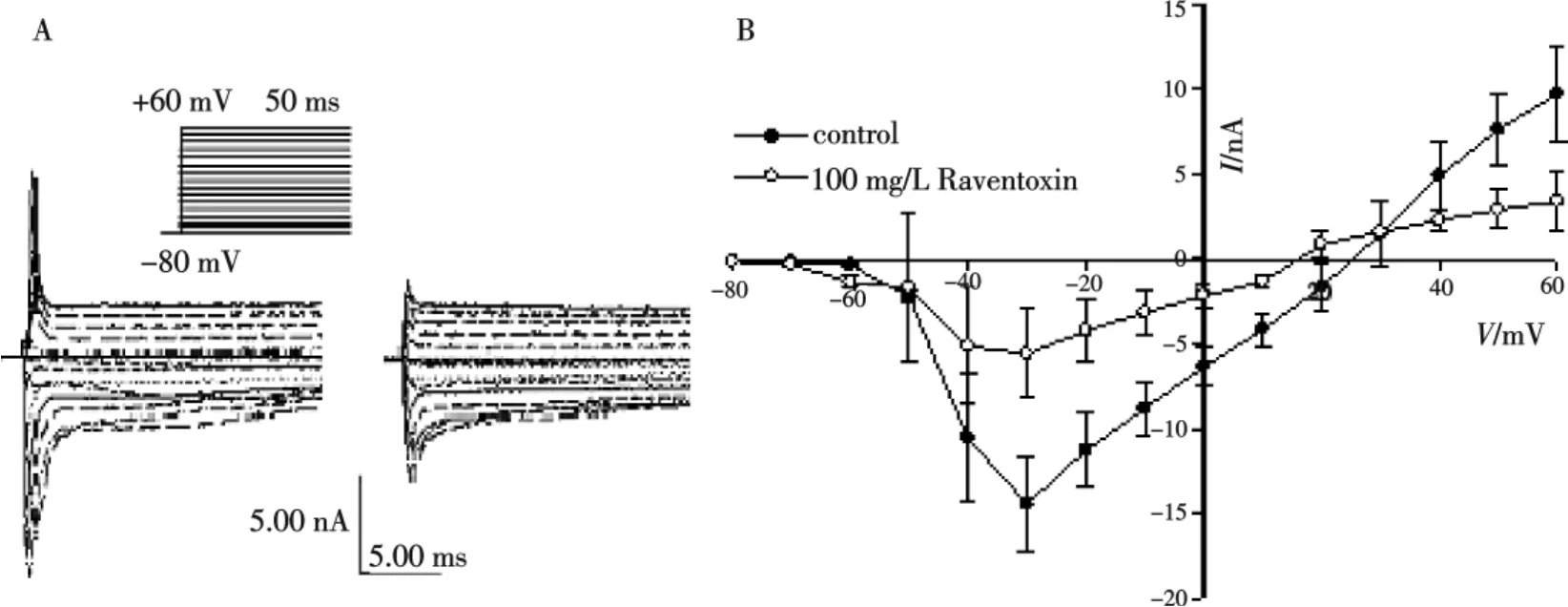
图3 雷氏大疣蛛粗毒(100 mg/L)对大鼠DRG细胞TTX-S型钠通道电流-电压关系(I-V curve)的影响
采用一标准双脉冲刺激方式,进一步观察了雷氏大疣蛛粗毒对TTX-S型钠通道的稳态失活特征的影响(图4).双脉冲刺激参数为:先将细胞膜电压预钳制在-130 mV,持续时间为1 s,再将膜电位变为-80 mV,持续时间为0.5 ms,以消除细胞膜电容的充电状态,再将去极化电压跃迁至-10 mV,去极化持续时间为50 ms,之后,膜电位回到-80 mV.进行下一次刺激时,只需改变预钳制电压(-130 mV~-20 mV,步幅为+10 mV,持续时间1 s),测试电压水平同上所述.在不同预钳制电压条件下,发现一般细胞预钳制在-130 mV时诱导出的峰值电流幅度最大,随着预钳制电压的增大,峰值电流幅度逐渐减小,当预钳制在-30 mV时起,相同测试电压几乎不能诱导出电流.图4中每个点的数据均来自5个实验细胞,用平均值±标准误差(mean±S.E.)来表示.两条光滑曲线经Boltzmann方程拟合获得:I/Imax=1/[1+exp(VV1/2)/k],其中V1/2是半数稳态失活电压,k是斜率,V是指预钳制电压.图4展示了在空白对照条件下,TTX-S型钠通道的半数稳态失活电压(V1/2)为-61.68 mV(n=5),在加入100 mg/L粗毒后,V1/2变为-78.44 mV (n=5).结果表明,雷氏大疣蛛粗毒能影响TTX-S型钠通道的稳态失活特征,并使曲线向超极化方向漂移15 mV左右,雷氏大疣蛛粗毒使TTX-S型钠通道更容易失活.
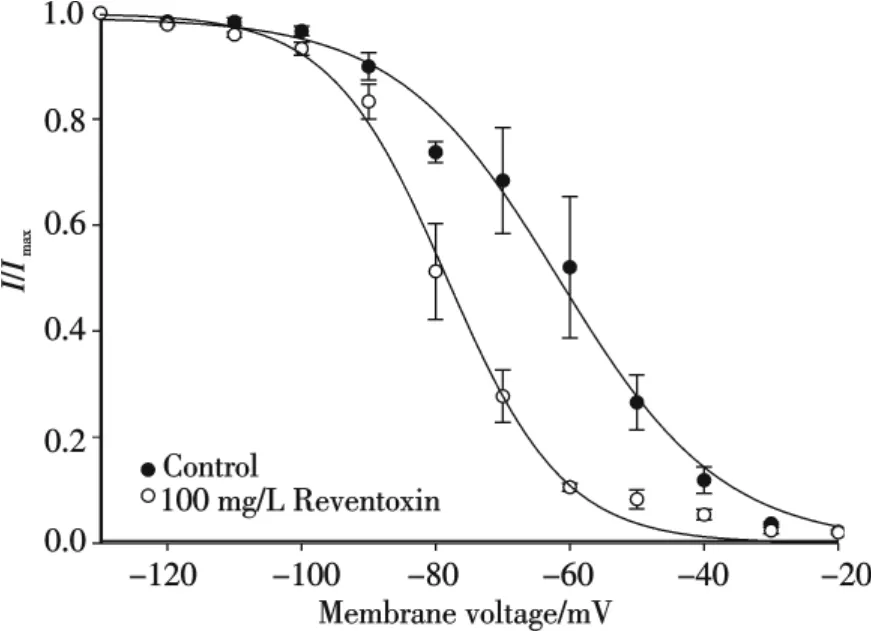
图4 雷氏大疣蛛粗毒(100 mg/L)对大鼠DRG细胞TTXS型钠通道稳态失活动力学特征的影响(n=5)
2.2 雷氏大疣蛛粗毒对电压门控钾通道的影响
在DRG细胞上全细胞记录模式下,将细胞膜电位钳制在-80 mV并去极化至+30 mV,持续时间为300 ms时,可观察到一明显的外向延迟整流钾电流,待峰值电流稳定,加入100 mg/L粗毒后,再以相同去极化脉冲刺激,电流峰值幅度几乎不降低(图5 A);同样的刺激方式也可以观察到瞬时激活钾电流,100 mg/L粗毒对电流峰值也没有明显改变(图5 B),表明雷氏大疣蛛粗毒中可能不含有阻断电压门控钾通道的活性成分.
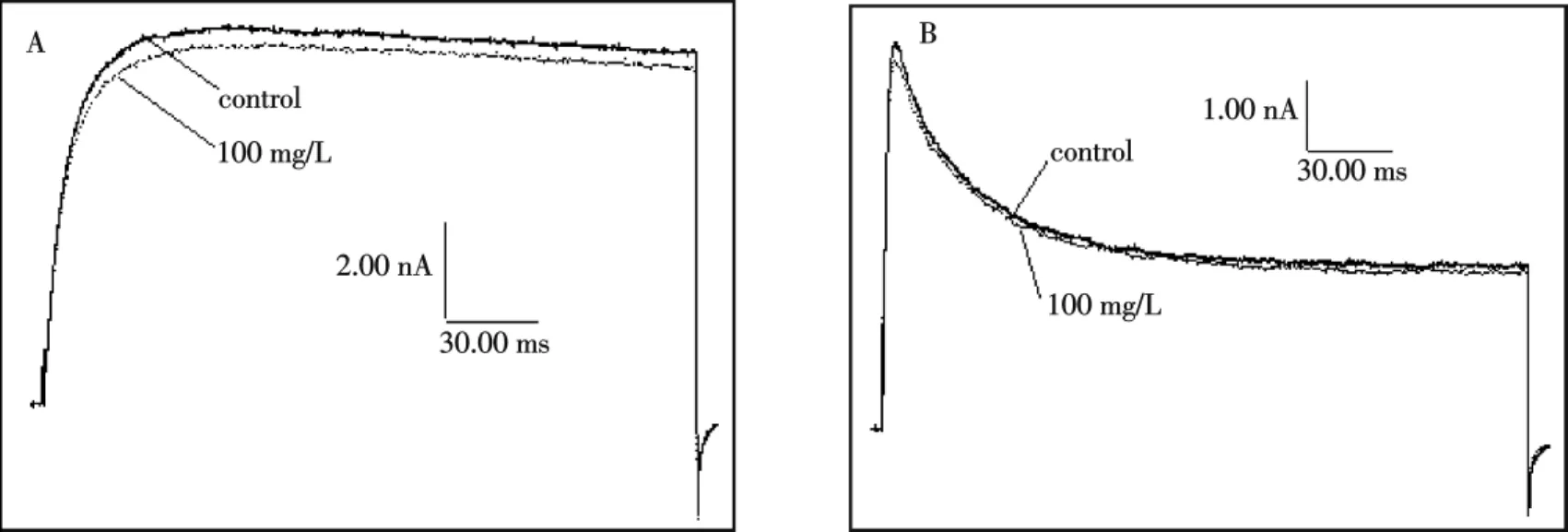
图5 雷氏大疣蛛粗毒对大鼠DRG细胞钾电流的影响(A为延迟整流钾电流,B为瞬时激活钾电流)
2.3 雷氏大疣蛛粗毒对电压门控钙通道的影响
在DRG细胞膜上主要分布着两种类型的电压门控钙通道:高阈值激活(high voltage-activated,HVA)钙通道和低阈值激活(low voltage-activated,LVA)钙通道.根据这两类钙通道不同的药理学特征和结合配体,可将二者区分开来.在全细胞记录模式下,将细胞膜电位钳制在-90 mV并去极化至-40 mV时只能诱导LVA钙通道激活产生电流;而将细胞膜电位钳制在-40 mV并去极化至0 mV时只能诱导HVA钙通道激活产生电流.此外,LVA钙通道又称T(transient)型钙通道,其失活速度远快于HVA钙通道.HVA钙通道包含N型和L型两种类型.目前,已经在蜘蛛、芋螺等动物毒素中找到了多种多肽类钙通道毒素,且针对HVA型和LVA型钙通道具有不同选择性,专一性强,如HWTX-I、ω-agatoxin IIIA等能阻断N型钙通道,但对T型或L型钙通道均无作用.ProTx I-II能阻断T型钙通道.
图6表明,在加入100 mg/L粗毒后,持续时间150 ms,HVA型(图6A)和LVA型(图6B)钙电流峰值电流幅度均无明显变化,说明雷氏大疣蛛粗毒对钙通道不敏感,粗毒可能不含阻断钙通道的活性物质.
[1]朱明生,李廷辉,宋大祥.中国大疣属(蜘蛛目:异仿蛛科)一新种[J].河北大学学报:自然科学版,2000,20(4):358-361.
[2]ESCOUBAS P,DIOCHOT S,CORZO G.Structure and pharmacology of spider venom neurotoxins[J].Biochimie,2000,82(9-10):893-907.
[3]肖玉成,彭宽,陈湘定,等.三种蜘蛛粗毒对NG108-15细胞电压门控钠通道的抑制作用[J].生命科学研究,2001,5 (1):45-46.
[4]曾雄智,梁宋平.雷氏大疣蛛毒素-Ⅱ的纯化与初步毒性研究[J].生命科学研究,2001,5(3):217-220.
[5]张鹏飞,陈平,肖顺勇,等.大疣蛛毒素-Ⅵ的分离纯化及部分生物学活性鉴定[J].生命科学研究,2003,7(2):129-133.
[6]JACKSON T,CLARK S,BERRYMAN S,et al.Integrin alphavbeta8 functions as a receptor for foot-and-mouth disease virus: role of the beta chain cytodomain in integrin-mediated infection[J].Virol,2004,78(9):4533-4540.
[7]GAO L,FENG W,SHAN B E,et al.Inhibitory effect of the venom of spider Macrothele raveni on proliferation of human hepatocellular carcinoma cell line BEL-7402 and its mechanism[J].Chin J Canc,2005,24(7):812-816.
[8]GAO L,SHAN B E,CHEN J,et al.Effects of spider Macrothele-raven venom on cell proliferation and cytotoxicityin HeLa cells[J].Acta Pharmacol Sin,2005,26(3):369-376.
[9]GAO L,SHEN J B,SUN J,et al.Effect of the venom of the spider Macrothele raveni on the expression of p21 gene in HepG2 cells[J].Sheng Li Xue Bao,2007,59(1):58-62.
[10]SU X,WACHTEL R E,GEBHART G F.Capsaicin sensitivity and voltage-gated sodium currents in colon sensory neurons from rat dorsal root ganglia[J].Am J Physiol,1997,277(6):G1180-G1118.
Effects of Venoms from the Spider Macrothele Raveni on Voltage-Gated Na+,K+and Ca2+Channels in Rat Dorsal Root Ganglia Neurons
WANG Xiao-juan,ZHU Yang-hui,LIU Zhong-hua*
(Key Laboratory of Protein Chemistry and Developmental Biology,Ministry of Education,
College of Life Science of Hunan Normal University,Changsha 410081,China)
By whole-cell patch-clamp recording,it was observed the effects of the vemon from the spider Macrothele raveni on voltage-activated Na+,K+and Ca2+channels in adult rat dorsal root ganglia(DRG)neurons.It has no evident effect on tetrodotoxin-resistant(TTX-R)Na+currents,K+currents and Ca2+currents,while it is able to inhibit tetrodotoxin-sensitive(TTX-S)Na+currents.The inhibition is dose-dependent with an IC50value of 11.04 mg/L.At a concentration of 100 mg/L it can cause both the initial activated voltage and the membrane reversal potential to shift 10 mV in the hyperpolarizing direction.And it also causes the steady-state inactivation curve of TTX-S Na+channels to shift approximate 15 mV in the hyperpolarizing direction without changing the slope factor (k)significantly.
Macrothele raveni;crude vemon;dorsal root ganglian(DRG);whole-cell patch-clamp;tetrodotoxin-sensitive sodium channel
Q424
A
1000-2537(2011)05-0080-06
2011-03-21
国家自然科学基金资助项目(31070699;30700127)
*通讯作者,E-mail:liuzh@hunnu.edu.cn
(编辑王健)
