TAT-N24穿膜融合多肽对前列腺癌细胞增殖的影响*
2011-12-08邓豫王桂华左学良董硕金源李维娜龚建平胡俊波
邓豫,王桂华,左学良,董硕,金源,李维娜,龚建平,胡俊波
(华中科技大学同济医学院附属同济医院1.肿瘤研究所/胃肠外科;2.感染性疾病研究所,武汉 430030)
磷脂酰肌醇-3-激酶(phosphoinositide-3-kinase,PI3K)是连接胞外细胞生长信号与信号通路的重要蛋白,参与了细胞增殖、凋亡、分化及糖代谢等重要作用[1]。研究表明,PI3K的活性与多种人类肿瘤的发生发展密切相关[2-4]。2003 年,XIA 等[5]发现:PI3K调节亚基p55PIK氨基端(N末端)的24个氨基酸(N24)能够结合细胞周期调节蛋白Rb,并使后者磷酸化,进而调控细胞周期进程。胡俊波等[6-11]在体外和体内实验中证实:高表达N24能够抑制胃癌、肝癌和结肠癌等细胞的生长。为了高效安全地将N24应用于肿瘤治疗,胡俊波等合成并纯化了TAT-N24穿膜融合多肽(简称TAT-N24),研究证实其能有效抑制结肠癌等的生长[12-14],这为针对PI3K信号通路的分子靶向治疗开辟了新的手段。前列腺癌(prostate carcinoma,PC)是较常见的男性恶性肿瘤,且发病率逐年上升[15],40 a来发病率增加了近5倍[16]。前列腺癌的治疗以手术为主,辅以内分泌治疗等,预后较差。近年来分子靶向治疗在肿瘤治疗领域进展迅速,笔者在本研究将初步探讨TAT-N24对前列腺癌PC3细胞增殖的影响。
1 材料与方法
1.1 主要试剂与仪器 前列腺癌PC3细胞株由本实验室常规培养,高糖达尔伯克改良必需基本培养基(dulbecco'smodified minimal essentialmedium,DMEM)及胎牛血清购于Hyclone公司,鼠抗人BrdU单抗购于Santa Cruz公司,异硫氰酸荧光素(fluorescein isthiocyanate,FITC)荧光标记的IgG购于丹麦Dako公司,流式细胞仪FACSort由美国Becton Dickson公司生产。
1.2 细胞培养和处理 PC3细胞用含10%小牛血清和双抗(青霉素100 U·mL-1及链霉素 100μg·mL-1)的DMEM培养液培养,置于37℃、5%二氧化碳培养箱,待细胞生长至融汇度为60%~70%时分为TAT-N24多肽组,对照多肽组(终浓度均为100μg·mL-1)和无干预对照组(空白组),24 h后收取细胞进行相应检测。
1.3 BrdU/PI双掺法测定细胞DNA合成 PC3细胞接受相应干预24 h后,加入BrdU,终浓度为10μmol·L-1,30min后用0.25%胰酶消化收集细胞,磷酸盐缓冲溶液(phosphate buffered solution,PBS)洗1次后用75%冰乙醇固定,-20℃保存过夜。取固定后细胞PBS洗1次,PBS-T[含 0.1% 苯磺酸(benzenesulfonic acid,BSA),0.2%聚山梨酯20]洗1次,2 mol·L-1盐酸作用45 min,以0.1 mol·L-1四氢硼砂(pH=8.0)洗1次,PBS-T(含0.1%BSA,0.2%聚山梨酯20)洗1次,加鼠抗人BrdU一抗(1∶100),37℃孵育2 h,PBS洗3次后再加FITC标记的羊抗鼠IgG(1∶20),室温孵育1 h,PBS洗3次,加入碘化丙啶(propidium iodide,PI),终浓度为4 μmol·L-1,和 RNAase,终浓度为2 μg·mL-1,室温孵育15 min,后放入流式细胞仪检测。
1.4 Western blot检测相关蛋白表达 PC3细胞接受相应干预24 h后,用0.25%胰酶消化收集细胞,PBS洗2次后,用适量放射免疫沉淀测定(radioimmune precipitation assay,RIPA)细胞裂解液冰上裂解30min,4℃下,12 000 r·min-1(离心机半径10 cm)离心10 min,取上清液,加等体积2×十二烷基硫酸钠(sodium dodecyl sulfate,SDS)上样缓冲液,混匀后置于100℃水浴5 min。蛋白样品行聚丙烯酰胺凝胶电泳,聚偏二氯乙烯(polyvinylidene dichloride,PVDF)膜转膜(350 mA,90 min),5%BSA封闭非特异性结合,然后孵育一抗[兔抗人硫酸甘油醛脱氢酶(phosphoribosyl glucinamide synthetase,GAPDH)、总蛋白激酶 B(protein kinase B,又称AKT)及磷酸化AKT抗体],4℃过夜。次日用 TBST洗3次,然后孵育辣根过氧化物酶(horseradish peroxidase,HRP)标记的抗兔IgG,室温孵育2 h后,TBST洗3次,每次15 min,最后用电致化学发光(electrochemiluminescence,ECL)显色。
1.5 统计学方法 采用SPSS12.0软件对组间进行均数t检验,P<0.05为差异有统计学意义。
2 结果
2.1 TAT-N24对前列腺癌PC3细胞DNA合成的影响对目的时间收取并固定的细胞进行BrdU掺入法染色,流式细胞仪检测细胞合成期(S期)的BrdU阳性细胞比例。结果显示:空白组(37.9±3.2)%,对照多肽组(36.2±4.1)%,TAT-N24组(21.5% ±2.4)%;TAT-N24组与空白组和对照多肽组比较,差异有统计学意义(P<0.05)。结果提示:TAT-N24能有效抑制前列腺癌PC3细胞的DNA合成。
2.2 TAT-N24对前列腺癌PC3细胞系细胞周期的影响 上述细胞BrdU染色后,进行流式细胞仪检测,进行细胞周期分析。结果显示:空白组G0/G1期(56.9±6.1)%,S期(27.0±2.3)%,G2/M 期(16.1±1.3)%;对照多肽组G0/G1期(57.9±4.8)%,S期(24.2±3.1)%、G2/M 期(27.8±1.4)%。TAT-N24组G0/G1期(68.6±5.4)%,S期(19.4±1.5)%,G2/M 期(12.3±1.4)%.结果提示:TAT-N24能有效阻滞PC3细胞周期进程于G0/G1期。统计学分析显示TAT-N24组与其他两组G0/G1期细胞比例比较差异有统计学意义(P<0.05)。
2.3 TAT-N24对前列腺癌PC3细胞系的AKT磷酸化的影响 PI3K下游信号通路的活性主要表现为AKT的磷酸化状态,AKT磷酸化后进而促进细胞生长和存活等。细胞处理至目的时间,收集细胞提取总蛋白进行Western blot检测,观察 TAT-N24对 PC3细胞的AKT磷酸化水平的影响。应用NIH Image J软件对结果进行定量分析,组间进行均数t检验,差异无统计学意义(P>0.05)。提示TAT-N24对PC3细胞的AKT磷酸化水平无明显影响。见图1。
3 讨论
PI3K是由催化亚基和调节亚基形成的异二聚体结构,二者结合后能够激活下游信号通路[17]。研究表明该通路在多种人类实体肿瘤中异常活化[18]。针对PI3K信号通路的抑制剂在肿瘤治疗方面取得了较大进展。但由于这些经典的PI3K抑制剂最终通过抑制AKT磷酸化水平而发挥作用,这影响了PI3K的正常生理功能,导致高血糖和免疫失衡等不良反应[18]。
P55PIK是PI3K的调节亚基之一,同其他调节亚基一样具有较为保守的结构域,除此之外,其氨基端(N端)的24个氨基酸(N24)是其区别于其他调节亚基的最重要的特征[5]。此外 XIA等[5]发现 N24能够结合并磷酸化细胞周期调节蛋白Rb,进而调控细胞周期进程。因此,在细胞内高表达N24可能影响肿瘤细胞的细胞周期进程,达到抑制肿瘤生长的目的。
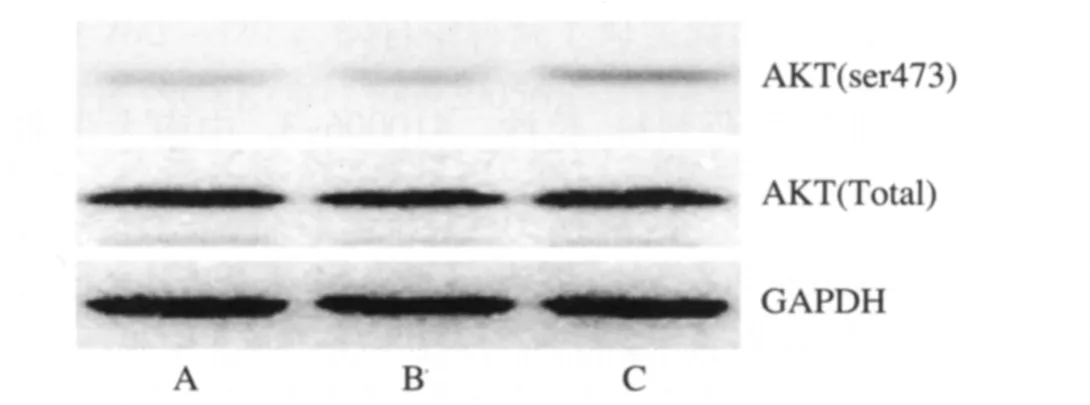
图1 3组前列腺癌PC3细胞的AKT磷酸化的比较A.空白组;B.对照多肽组;C.TAT-N24组Fig.1 The comparison of AKT phosphorylation of prostate cancer cell line PC3 in three groups A.the blank group;B.the control peptide group;C.the TATN24 group
本研究显示:TAT-N24能有效抑制前列腺癌PC3细胞的DNA合成,阻滞细胞周期进程于G0/G1期。其可能的机制为:外源性N24通过竞争性结合Rb蛋白,降低了内源性p55PIK对Rb的磷酸化作用,进而影响Rb对细胞周期的调节,导致细胞周期被阻滞于G0/G1期,同时抑制细胞的DNA合成。此外,结果提示TATN24未影响PI3K经典通路下游AKT的磷酸化水平,在减少不良反应方面,这可能比经典的PI3K/AKT抑制药更具优势,但此点有待动物实验进一步证实。TAT-N24作为特异性抑制p55PIK信号转导的分子靶向药物,具有较好应用前景。
[1] VIVANCO I,SAWYERSC L.The phosphatidylinositol-3-kinase AKT pathway in human cancer[J].Nat Rev Cancer,2002,2(7):489-501.
[2] WILLIAM G K Jr.Functions of the retinoblastoma protein[J].Bioessays,1999,21(11):950-958.
[3] VANHAESEBROECK B,LEEVERS S J,PANAYOTOU G,et al.Phosphoinositide 3-kinases:a conserved family of signal transducers[J].Trends Biochem Sci,1997,22(7):267-272.
[4] 高霞,龙浩成,刘双又,等.信号传导途径p55P13K-Rb在胃肠道肿瘤中的表达及意义[J].华中科技大学学报:医学版,2006,35(6):761-763.
[5] XIA X ,CHENG A ,AKINMADE D,et a1.The N-terminal 24 amino acids of the p55 gamma regulluatory subunit of phosphoinositide-3-kinase binds Rb and induces cell cycle arrest[J].Mol Cell Biol,2003,23(5):1717-1725.
[6] HU J,XIA X,CHENG A ,et al.A peptide inhibitor derived from p55PIK phosphatidylinositol 3-kinase regulatory subunit:a novel cancer therapy[J].Mol Cancer Ther,2008,7(12):3719-3728.
[7] 孙黎,袁响林,王桂华,等.磷脂酰肌醇-3-激酶调节亚基N末端24个氨基酸对肝癌细胞增殖的抑制[J].华中科技大学学报:医学版,2009,38(4):430-432,437.
[8] 王桂华,胡俊波,龚建平,等.磷脂酰肌醇-3激酶N末端的24个氨基酸抑制结肠癌细胞增殖的作用[J].癌症,2007,27(10):1034-1038.
[9] 刘双又,王晶,胡俊波,等.磷脂酰肌醇3-激酶上的一段多肽对Jurkat细胞的周期阻滞作用[J].中华血液学杂志,2005,26(12):758-759.
[10] 王晶,刘双又,胡俊波,等.N24p55γPl3K靶向抑制胃癌细胞增殖的研究[J].中华实验外科杂志,2006,23(10):1221-1223.
[11] HU J B,LIU S,WANG J,et al.Overexpression of the N-terminal end of the p55γ regulatory subunit of phosphatidylinositol-3-kinase blocks cell cycle progression in gastric carcinoma cells[J].Int J Oncol,2005,26(5):1321-1327.
[12] 王桂华,邓豫,李小兰,等.TAT-N24穿膜融合多肽的表达与鉴定[J].华中科技大学学报:医学版,2010,39(2):175-178.
[13] 吕峰,王桂华,邓豫,等.穿膜融合多肽TAT-N24对S180腹水瘤生长的抑制作用[J].华中科技大学学报:医学版,2010,39(3):369-371,380.
[14] 王桂华,邓豫,杨锐,等.穿膜融合多肽TAT-N24对结肠癌细胞增殖的影响[J].肿瘤防治研究,2010,37(7):766-768.
[15] 吴阶平,顾方六,郭应碌,等.吴阶平泌尿外科学[M].济南:山东科学技术出版社,2005:965-980.
[16] 潘玉琢,李扬,赵雪俭,等.STEAPl在人前列腺组织中的表达与分布[J].吉林大学学报:医学版,2005,31(6):843-845.
[17] ENGELMAN JA,LUO J,CANTLEY LC.The evolution of phosphatidylinositol 3-kinases as regulators of growth and metabolism [J].Nat Rev Genet,2006,7(8):606-619.
[18] YUAN T L,CANTLEY L C.PI3K pathway alterations in cancer:variations on a theme [J].Oncogene,2008,27(41):5497-5510.
