三氯生水凝胶乳化抗菌剂在兔膝损伤模型血液内药动学的对比实验*
2011-12-08吕晓东蔡谞张英
吕晓东,蔡谞,张英
(1.解放军总医院骨科,北京 100853;2.济南军区总医院骨科,济南 250031)
感染是骨科手术后最严重的并发症之一。细菌耐药性是抗感染治疗面临的难题。近年来三氯生被广泛应用,作为氯化联苯醚家族中最常用而且药效最强的抗菌剂,三氯生对革兰阳性菌较革兰阴性菌更有效,如外科手术感染的常见菌金黄色葡萄球菌。三氯生在周围环境中易降解,不产生细菌耐药性,作为国际上推崇的安全、高效、广谱抗菌药,相关数据证明三氯生口服安全系数高,也无明显致癌性,针对各种濒危物种,包括人,三氯生具有良好的生物耐受性[1-4]。但三氯生在作用部位存留时间不长(4~6 h),期待开发一种特殊复合抗菌药,能够在更长的时间段渐渐地释放出活性的三氯生,以达到持久的抗菌效果。凝胶型乳剂在单位时间内有着比较恒定的释放剂量,以维持血药浓度恒定。代表现代制剂技术的新方向。
1 材料与方法
1.1 材料
1.1.1 实验动物 6个月龄同窝新西兰大耳白兔,北京科宇动物养殖中心,合格证号:xcxk(京)2003-0007);解放军总医院动物实验中心具体实施,使用许可证号:syxk(军)2007-009。
1.1.2 仪器与设备 Hitachi7170全自动生化分析仪(日立公司);Agilent 1100型高效液相色谱分析仪及化学工作站(惠普公司);安捷伦公司ZOBAX SB-C18分析色谱柱(4.6 mm×250 mm,5μm);Tu-1901双光束紫外可见分光光度计(北京普析通用仪器有限公司);AL104电子分析天平(梅特勒-托利多):量程20 g,精度0.001 g;Kesp-1000超声波震荡器(上海安亭科学仪器厂);ZH-2自动漩涡混合器(上海医科大学仪器厂);LDZ52微量离心机(上海科学仪器四厂)。
1.1.3 试药 三氯生(Triclosan,Ciba Specialty Chemicals,Switzerland,批号:F80028,分析纯);医用玻璃酸钠水凝胶(hydrogel acid,日本生化学工业株式会社,批号:8H121Z,规格:每支2.5 mg);医用几丁糖水凝胶(chitosan,石家庄亿生堂医用品有限公司,批号:081012,规格:每支30 mg);羟化蓖麻油聚氧乙烯醚(Cremophor EL,BASF Group,德国,批号:04061821);甲醇(BASF Group,德国,批号:K37218907-719,分析纯,HPLC 级)。
1.2 方法
1.2.1 实验模型的制备 同一批次同时制备左侧膝关节创伤性关节炎模型。制备方法:实验性兔麻醉后取膝关节外侧切口,显露髌股关节面,作直径4.5 mm,深3 mm钻孔(深达软骨下骨质),获得关节软骨缺损模型。术后各组动物膝关节不予外固定,自由活动。术后第6天,关节囊初步愈合,试注射0.9%氯化钠溶液至关节囊充盈,观察创面无渗出,观察创缘无皮下积液。
1.2.2 抗菌乳剂的制备 给药前24 h配制三氯生乳液,静置24 h不分层,达到稳定状态,成为三氯生储备液。方法:因三氯生晶体颗粒较粗大(直径4μm),将精确称量的三氯生粉剂1.0 g置玛瑙研钵中轻轻研细,加入羟化蓖麻油聚氧乙烯醚1.12 g,轻轻研磨,使均匀混合,缓慢加入0.9%氯化钠溶液20 mL,形成乳液,移液管将乳液移送至刻度试管中,0.9%氯化钠溶液10 mL洗涤研钵及移液管后加入刻度试管,在刻度试管中添加0.9%氯化钠溶液至总量40 mL,放置超声震荡器内20 min,混合均匀,得到浓度为25 mg·mL-1的三氯生乳液,静置24 h不分层,成为满足试验要求的三氯生储备液。
给药前现场制备4种实验乳剂,分别保留原液2 mL,经预处理后,于给药后2 h采用高效液相色谱分析测得4种乳剂的回收率。制备方法:准备4支量程为20 mL的刻度试管(Ⅰ~Ⅳ),用移液管精确量取三氯生储备液6 mL添加至刻度试管备用。试管Ⅰ中添加0.9%氯化钠溶液至总量15 mL。试管Ⅱ中添加玻璃酸水凝胶6 mL后继续添加0.9%氯化钠溶液至总量15 mL。试管Ⅲ中添加几丁糖水凝胶6 mL后继续添加0.9%氯化钠溶液至总量15 mL。现场取等量的玻璃酸水凝胶和几丁糖水凝胶,经超声震荡10 min混合均匀后得到聚合水凝胶,试管Ⅳ中添加聚合水凝胶6 mL后继续添加0.9%氯化钠溶液至总量15 mL。超声震荡20min混合均匀后得到4种乳液,室温静置2 h取上清液后用0.9%氯化钠溶液稀释250倍,漩涡混合器上充分混匀后取上清液0.25 mL甲醇稀释4倍,高效液相色谱(HPLC)分析测得回收率。
1.2.3 动物分组与造模 同窝新西兰大耳白兔30只(雌雄各15只),随机分为5组,每组6只(雌雄各3只)。所有动物体质量均为2.5 kg,每组各取同性别的动物1只,组成1个区组(包括雄兔5只或雌兔5只),共得到6个区组,同一区组同时手术,术后置于同一观察室,喂养及摄食情况无差异,观察精神状态无明显异常,满足实验要求。各区组同样在术后第7天给药,给药及采血方式无差异。每1区组包括5只动物,分别来自A、B、C、D、E组,术后第7天给药清晨空腹给药,A、B、C、D组分别给予不同乳剂(Ⅰ~Ⅳ)。E组不给药,严格要求同时给药,组间前后间隔时间不超过5 min。术后动物自由活动,喂养及观察情况无差异。根据预实验,A、B、C、D 组分别于术后 6,12,24,48,72,96 h在右耳静脉反复取血2 mL,测血液三氯生水平。比较4种乳剂关节腔注射后,血液三氯生药物水平和维持时间。
1.2.4 空白对照液的配制 E组动物的血液2 mL,静置 24 h后,取上层血清0.4 mL,向血清中添加50μg·mL-1的三氯生溶液0.1 mL,自动涡旋混合器充分混合后,取上清液0.2 mL,作为空白对照液,浓度10 μg·mL-1。
1.2.5 选定标准液 空白对照液用甲醇稀释4倍,微量离心机4℃下12 000×g离心10 min,以浓度10μg·mL-1的三氯生溶液作为标准液,测得空白对照液三氯生的回收率为95.8% ~96.9%,日间RSD为3.5%。使用空白对照液作为标准液测量各标本。
1.2.6 标本的制备 各组实验动物均取血液2 mL静置24 h,取上清液0.25 mL,甲醇稀释4倍至1 mL,微量离心机4℃下12 000×g离心10 min,取上清液0.2 mL,进行HPLC分析。测得标本吸收峰,与三氯生标准液比对后得到标本的三氯生浓度,计算血清内三氯生浓度。
1.2.7 HPLC分析 色谱条件:ZOBAX SB-C18色谱柱(4.6 mm×250 mm,5 μm),流动相为甲醇-水缓冲液(80∶20),流速 1.0 mL·min-1,进样量 40 μL,压强1.20×104kPa,标准液为10μg·mL-1空白对照液。
1.2.8 空腹血糖的测定 A、B、C、D、E组于给药前,给药后24,48,72,96 h 在左耳静脉反复取血 2 mL,置氟化钠抗凝管,以Hitachi 7170全自动生化分析仪测得空腹血糖。计算各组给药前后空腹血糖变化的差值。①与给药前比较,计算给药后每只实验动物各时间点血糖升高或降低的情况,得到血糖升高和降低的最大值和平均值;②将各组血糖升高(血糖降低)的情况汇总,得到最大值、平均值的均数和标准差;③各组与空白对照组比较,计算注射乳剂与不注射乳剂比较空腹血糖变化的差异;④4种乳剂比较,空腹血糖变化的差异。
1.3 统计学方法 数据采用SPSS11.0软件包进行处理,血液三氯生峰浓度,血液三氯生平均浓度的比较采用F检验。空腹血糖升高最大值、平均值,空腹血糖降低最大值、平均值的比较采用多组比较的秩和检验Kruskal-Wailis H检验。
2 结果
2.1 实验乳剂的回收率 结果见表1。

表1 4种乳剂的回收率和精密度实验结果Tab.1 The recovery and precision of four kinds of emulsions %
2.2 血液三氯生浓度 结果见表2。峰浓度和平均浓度按正态分布计量统计资料进行完全随机设计的方差分析。方差分析得出:①对照组三氯生水平显著高于其他各组(P<0.05);②在玻璃酸组,几丁糖组和聚合水凝胶组中,玻璃酸组三氯生水平最低,聚合水凝胶组三氯生水平最高,三者之间两两比较,差异均有统计学意义(均P<0.05)。
2.3 各组血液三氯生维持时间比较 各组血液内均检测到三氯生,对照组和聚合水凝胶组的维持时间较短,短于玻璃酸组和几丁糖组。见图1。
2.4 空腹血糖浓度变化差异 结果见表3。
3 讨论
3种水凝胶中的三氯生胶团均可以分成两个部分,被水凝胶包裹的三氯生胶团(包括被重新释放的和不能被释放的),不被水凝胶包裹的自由三氯生胶团。自由三氯生胶团微粒运动较活跃,易于黏附关节囊壁。三氯生分子被黏膜组织回吸收入血,三氯生释放入血的量受到自由三氯生胶团数量的直接影响,而受到被水凝胶包裹的三氯生胶团数量的间接影响,可以看作是储存和缓释的过程。而这种缓释过程,在不同的水凝胶其差别非常大。
表2 4种乳剂在各时间点测得血液的三氯生浓度Tab.2 The blood concentration of triclosan at different time points after injection of four kinds of emulsions mg·mL-1±s

表2 4种乳剂在各时间点测得血液的三氯生浓度Tab.2 The blood concentration of triclosan at different time points after injection of four kinds of emulsions mg·mL-1±s
与对照组比较,*1 P<0.05;与几丁糖组和聚合水凝胶组比较,*2 P<0.05;与几丁糖组比较,*3 P<0.05Compared with control group,*1 P <0.05;Compared with chitosan emulsions group and polymer hydrogelgroup,*2 P <0.05;Compared with chitosan emulsions group,*3 P <0.05
组别 6 h 12 h 24 h 48 h 72 h 96 h 峰浓度 平均浓度玻璃酸组 7.365±0.624 13.532±1.04722.172±1.146 20.854±1.346 9.831±1.086 7.206±1.375 22.172±1.146*1*2 13.525±1.385*1*2几丁糖组 10.163±1.174 18.014±1.68127.735±2.124 18.675±1.248 12.363±1.360 5.164±2.124 27.735±2.124*1 15.352±1.837*1聚合水凝胶组 30.325±1.215 33.637±1.06213.726±1.428 4.684±0.973 <0.5 <0.5 33.637±1.062*1*3 20.593±1.346*1*3对照组 23.553±1.207 41.375±1.80625.486±1.456 6.756±0.845 <0.5 <0.5 41.375±1.806 24.295±1.556
对照组的三氯生胶团全部是自由三氯生胶团,没有被储存和缓释。直接释放入血,因此血液中三氯生的维持时间短,峰浓度和平均浓度最高。
聚合水凝胶易于结合三氯生胶团,难于释放它们。但这种不可逆结合的量是有限的。虽然聚合物水凝胶释放入血的三氯生的绝对量减少,血液中三氯生的维持时间短,但峰浓度和平均浓度仍然高于玻璃酸组和几丁糖组。
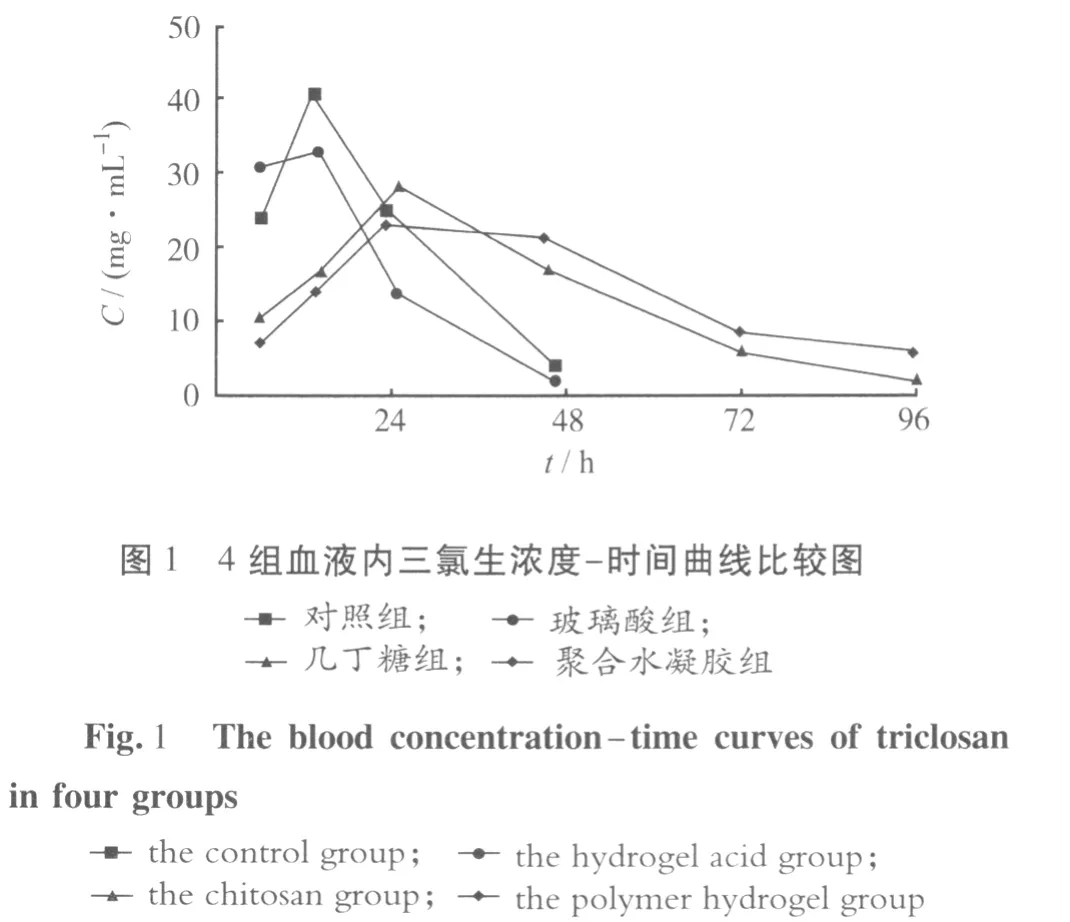
表3 5组空腹血糖的变化Tab.3 Changes of fasting p lasma glucose in five groups mmol·L-1±s

表3 5组空腹血糖的变化Tab.3 Changes of fasting p lasma glucose in five groups mmol·L-1±s
与对照组和聚合水凝胶组比较,*1 P<0.05Compared with control group and polymer hydrogel group,*1 P <0.05
组别 血糖升高最大 平均血糖降低最大 平均玻璃酸组 0.661±0.018*1 0.353±0.018*1 0.751±0.018*1 0.351±0.018*1几丁糖组 0.703±0.155*1 0.346±0.045*1 0.803±0.155*1 0.346±0.045*1聚合水凝胶组 1.034±0.067 0.614±0.085 1.601±0.137 0.605±0.079空白对照组 0.624±0.155*1 0.364±0.055*1 0.813±0.155*1 0.386±0.045*1对照组 1.501±0.137 0.746±0.108 1.026±0.067 0.663±0.112
玻璃酸组和几丁糖组的三氯生胶团可以看作两部分:自由释放部分和缓释部分,两者相比,玻璃酸吸水性强,且对环境变化敏感,缓释作用强于几丁糖凝胶,因此玻璃酸组血液中三氯生的峰浓度和平均浓度低于几丁糖水凝胶组。
近年来,人们认识到三氯生是通过与细菌脂肪酸合成酶系中烯酰基载体蛋白还原酶(enoylacyl carrier protein reductase,EACPR)相互作用,抑制脂肪酸的合成而起抗菌作用,有关其对细菌脂肪代谢作用的研究文章也陆续发表[5-11]。碳水化合物与脂肪相互转化的调节过程是机体血糖浓度赖以稳定的重要机制,生物体内两大供能物质脂肪与碳水化合物之间存在着一种平衡关系,一旦脂肪合成受到抑制,势必对碳水化合物的代谢产生影响[12-15]。本研究证实,三氯生对兔碳水化合物代谢有影响,并且这种影响与血液中三氯生水平的变化存在联系,需要进一步研究。
由于玻璃酸和几丁糖的水凝胶具有缓释作用,血液中三氯生的浓度波动小,可能是玻璃酸和几丁糖组空腹血糖变化不明显的原因。通过本实验可以得出,与三氯生乳剂和三氯生聚合水凝胶乳剂比较,三氯生玻璃酸乳剂和三氯生几丁糖乳剂血中三氯生平均浓度较低,空腹血糖水平无明显异常,并且三氯生玻璃酸糖乳剂和三氯生几丁糖乳剂相比,关节腔药物有效浓度无差异,血液药物浓度水平更低,空腹血糖水平无明显异常,玻璃酸组和几丁糖组血液三氯生维持时间比较长,更适于临床应用。
[1] WOLFE SW,SWIGART C R,GRAUER J,et al.Augmented external fixation of distal radius fractures:a biomechanical analysis[J].J Hand Surg,1998,23A:127-134.
[2] WOLFE SW,AUSTIN G,LORENZE M,et al.A biomechanical comparison of different wrist external fixators with and without K-wire augmentation[J].J Hand Surg Am,1999,24:516-524.
[3] NAIDU S H,CAPO J T,MOULTON M,et al.Percutaneous pinning of distal radius fractures:a biomechanical study[J].JHand Surg,1997,22A:252-257.
[4] SAEKI Y,HASHIZUME H,NAGOSHIM,et al.Mechanical strength of intramedullary pinning and transfragmental kirschner wire fixation for colles’fractures[J].JHand Surg Br,2001,26B:550-555.
[5] CHERNG A,TAKAGI S,CHOW C.Effects of hydroxypropyl methylcellulose and other gelling agents on the handling properties of calcium phosphate cement[J].J Biomed Mater Res,1997,35(2):273-277.
[6] TAKECHIM,MIYAMOTO Y,ISHIKAWA K,etal.Effects of added antibiotics on the basic properties of antiwashout-type fast-setting calcium phosphate cement[J].J Biomed Mater Res,1998,39(2):308-316.
[7] ISHIKAWA K,MIYAMOTO Y,KONM,etal.Non-decay type fast-setting calcium phosphate cement:composite with sodium alginate[J].Biomaterials,1995,16(7):527-532.
[8] GOODMAN SB,BAUER TW,CARTER D,etal.Norian SRS cement augmentation in hip fracture treatment:laboratory initial clinical results[J].Clin Orthop,1998,345:42-50.
[9] LARSSON S,MATTSSON P,BAUER TW.Resorbable bone cement for augmentation of internally fixed hip fractures[J].Ann Chir Gynaecol,1999,88:205-213.
[10] KIYOSHIGE Y,TAKAGIM,HAMASAKIM.Bonecement fixation for calcaneus fracture:a report on 2 elderly patients[J].Acta Orthop Scand,1997,68(4):408-409.
[11] HUSBAND J,CASSIDY C,LEINBERRY C,et al.Mylticenter clinical trial of Norian SRS versus conventional therapy in treatment of distal radius fractures[J].Trans Am Acad Orthop Surg,1997,64:212.
[12] HIDAKA N,YAMANO Y,KADOYA Y,etal.Calcium phosphate bonement for treatment of radius fractures:a preliminary report[J].J Orthop Sci,2002,7(2):182-187.
[13] KOPYLOV P,ADALBERTH K,JONSSON K,et al.Norian SRS functional treatment in redisplaced distal radial fractures:a randomized study in 20 patients[J].J Hand Surg,2002,27B(6):538-541.
[14] ERIKSSON F,MATTSSON P,LARSSON S.Effect of augmentation with resorbable or conventional bone cement on the holding strength for femoral neck fracture devices[J].J Orthop Trauma,2002,16(5):302-310.
[15] MATTSSON P,LARSSON S.Augmentation of femoralmeck fracture fixation with resorbable cement(Norian SRS)and its effect on early postoperative stability measured with RSA[J].Acta Orthop Scand,2000,70(Suppl287):59.
