耐药乳腺癌裸鼠模型免疫治疗初探*
2011-11-28司玉玲綦振家王英娟李世俊
庞 华 司玉玲 綦振家 王英娟 王 亮 李世俊
乳腺癌是危害人类生命的恶性肿瘤,特别是多药耐药性乳腺癌,其表现为治疗效果差、转移率高、死亡率高。细胞因子诱导的杀伤细胞(cytokine-induced killer cells,CIKs)是在白细胞介素(IL)-2、IL-1、干扰素(IFN)-γ和抗CD3单克隆抗体等作用下,由单个核细胞培养而获得的一种具有细胞毒作用的免疫活性细胞。树突状细胞(DC)是最具潜力的抗原提呈细胞,在初始免疫和获得性免疫中起到重要作用。以DC为基础的免疫治疗已经成为治疗耐药肿瘤的希望[1]。对于化疗无效和多次化疗后复发的肿瘤患者,其体内肿瘤细胞多存在原发或继发性多药耐药(MDR),P-糖蛋白(P-gp)是导致MDR的原因之一,它可以作为肿瘤抗原被识别杀伤[2]。本研究将表达P-gp的耐药乳腺癌细胞MCF-7/ADR抗原冲击DC,然后与CIK细胞共培养,观察其在MCF-7/ADR裸鼠体内的影响并比较抑瘤率。
1 材料与方法
1.1 材料
1.1.1 试剂 RPMI-1640粉剂购自美国Hyclone公司;新生牛血清购自Hyclone Laboratories Inc公司;淋巴细胞分离液购自Sigma公司;10%二甲基亚砜(DMSO)、重组人巨噬细胞集落刺激因子(rhGM-CSF)、重组人白细胞介素(rhIL)-4和重组人肿瘤坏死因子-α(rhTNF-α)均购自Bioscience公司;rhIL-2、抗人 CD3单抗、重组人干扰素(rhIFN)-γ、IL-12、IFN-γ、TNF-α、IL-2酶联免疫吸附测定(ELISA)试剂盒均购自晶美生物公司;抗人CD40-FITC、CD80-PE、HLA-DR-APC单抗均购自Burlingame公司;抗人CD3-PE、CD56-APC、CD8-FITC、PGP-FITC和IgG-FITC单抗均购自Immunotech公司。
1.1.2 靶细胞和裸鼠 MCF-7/ADR细胞(其P-gp抗原表达为90%左右)购自中国医学科学院血液病医院;5~6周大小SCID裸鼠购自北京军事医学科学院动物研究所。
1.2 方法
1.2.1 荷瘤裸鼠模型建立 收集对数生长期的MCF-7/ADR细胞,生理盐水洗涤2遍,1 800 r/min离心,计数,制成浓度为1×107/mL的细胞悬液,在每只裸鼠右侧腋下按每只裸鼠接种1 mL进行接种,肿瘤体积生长到直径0.5 cm为成瘤。
1.2.2 人乳腺癌细胞系MCF-7/ADR细胞冻融抗原的制备 收集对数生长期的MCF-7/ADR细胞,生理盐水洗涤2遍,1 800 r/min离心,计数,制成浓度为1×107/mL的细胞悬液,加入100 μL生理盐水中,放入液氮中,5 min后,迅速放入37℃水浴中,待其完全融化后,再次放入液氮中,反复3次,微孔滤膜过滤,收集滤液,4℃保存备用。
1.2.3 DC体外诱导培养 收集健康人外周血细胞,通过淋巴细胞分离液体分离获得单个核细胞,置于含10%新生牛血清的RPMI-1640完全培养基中,在37℃饱和湿度、5%CO2孵箱中培养2 h后,收集黏附细胞,加培养液调细胞浓度为1×106/mL,接种于24孔培养板(1 mL/孔)中,加入终浓度为1 000 U/mL的rhGM-CSF、500 U/mL的rhIL-4,在37℃饱和湿度、5%CO2孵箱中培养,48 h进行半量换液并加入首次浓度1/2量的上述细胞因子,在培养到第5天时,部分DC和上述冻融抗原按原细胞数1∶5进行冻融抗原冲击(AP-DC),与未冲击的DC共同于第7天加入TNF-α1 000 U/mL,继续培养到第8天。在整个培养过程中,每24 h观察细胞形态变化,培养结束时对DC细胞进行成熟表型流式细胞仪检测。
1.2.4 CIK细胞的分离及培养 收集单个核细胞中的非黏附细胞,并用RPMI-1640完全培养基调细胞数为3×106/mL,接种于24孔平底培养板(1 mL/孔),第1天加入1 000 U/mL的rhINF-γ,刺激24 h后,加入抗CD3单抗50 μg/L及300 U/mL的rhIL-2,以后每3 d以含有300 U/mL的rhIL-2的新鲜CIK培养液全量换液。培养到第8天,将CIK细胞分3组继续培养,分别是抗原冲击的DC与CIK共培养组(AP-DC+CIK组)、DC与CIK共培养组(DC+CIK组)和CIK单独培养组(CIK组)。DC与CIK细胞按照1∶10比例进行共培养,到共培养第15天,收集上述各组细胞进行表型及细胞因子(IFN-γ、TNF-α、IL-2)分泌水平等功能检测。
1.2.5 细胞表型测定 分别检测共育前后的CIK细胞表型(CD3、CD56、CD8)和AP-DC表型(CD40、CD80、HLA-DR)。将待测细胞调节浓度为1×106/mL,取细胞悬液100 μL/管,分别加入相应单克隆抗体各20 μL,混匀后置室温下暗室反应30 min,加PBS缓冲液,1 000 r/min,5 min离心洗涤后,以1%多聚甲醛固定备做流式检测。Cell Quest软件进行分析。
1.2.6 细胞因子分泌水平的测定 取3组细胞(AP-DC+CIK、DC+CIK、CIK)上清液用ELISA试剂盒分别进行IFN-γ、TNF-α、IL-2分泌水平的测定,具体操作按试剂盒说明书进行。
1.2.7 细胞分组经尾静脉注入裸鼠体内 以接种MCF-7/ADR的SCID裸鼠肿瘤体积生长到直径为0.5 cm为成瘤,将荷瘤裸鼠随机分到4组中,分别注射3组中的效应细胞,第4组注射生理盐水作为对照组(生理盐水组),从注射开始每7 d测量肿瘤的最大纵径(a)及最大横径(b)1次,肿瘤体积=0.5×a×b2,观察肿瘤生长的情况。注射治疗35 d后,处死荷瘤裸鼠,取出瘤体并称质量,计算抑瘤率,抑瘤率(%)=[1-(实验组瘤质量/对照组瘤质量)]×100%。
1.3 统计学处理 采用SPSS 10.0软件,计量资料数据用均数±标准差(±s)表示,各组内及组间相同指标进行配对t检验或方差分析,方差分析后组间进一步比较用Bonferroni法,P<0.05为差异有统计学意义。
2 结果
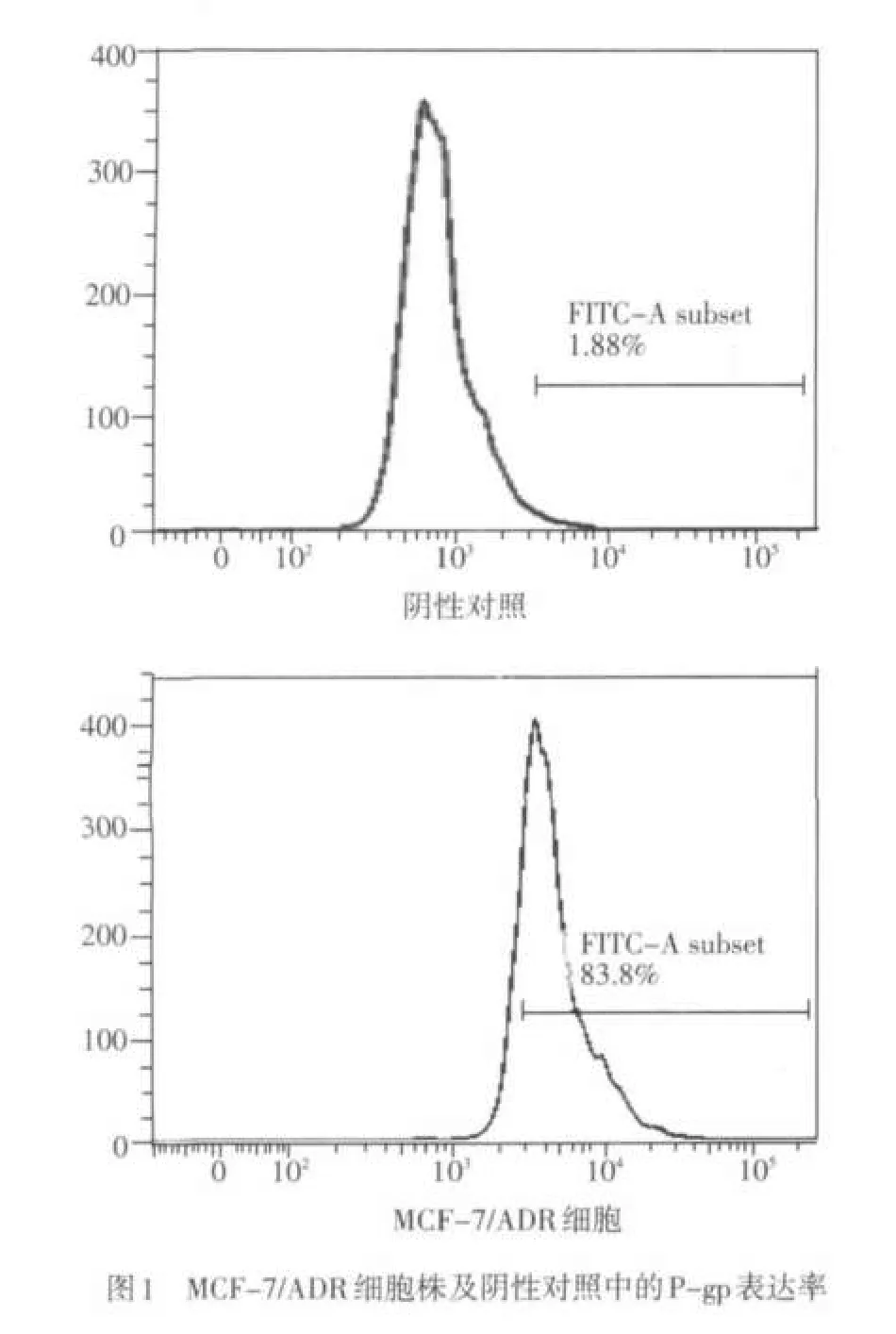
2.1 P-gp在MCF-7/ADR细胞的表达情况 流式细胞仪检测MCF-7/ADR细胞中P-gp阳性表达率为83.8%,见图1。
2.2 CIK细胞与DC共孵育前后增殖速率和表型变化
2.2.1 增殖速率变化 CIK细胞单独培养第4天开始倍增,细胞体积开始增大,细胞核大而圆,部分细胞聚集成簇;培养第7天之后,大部分细胞聚集成簇生长,形成肉眼可见的细胞团,悬浮生长于培养液中,见图2。与抗原冲击或未冲击DC共培养后,AP-DC+CIK组可扩增到原来的大约20倍左右,DC+CIK组则为原来的大约16倍左右。

2.2.2 与DC共培养后3组CIK细胞表型变化 共培养结束后,3组间CIK细胞表型比较差异均有统计学意义,CD3+CD56+细胞比例在AP-DC+CIK组最高,见表1。
2.3 DC形态观察及免疫表型
2.3.1 DC形态观察 新分离的骨髓单个核细胞呈球形散在分布,表面光滑;加入细胞因子组合培养48 h后,高倍倒置显微镜下可见部分细胞悬浮并发生聚集样增生;培养5 d后,大部分细胞均已悬浮,聚集样细胞群变大并可见明显的多形性,形状由开始时的圆形变成不规则形,部分细胞可见有树突状突起,见图3A;培养7 d后细胞均匀分散呈悬浮状,进一步变形,体积增大,胞浆丰富,具有树突状突起的细胞增多且突起更为明显,见图3B。
表1 与DC共培养后3组CIK表型分析(n=10,%,±s)

表1 与DC共培养后3组CIK表型分析(n=10,%,±s)
**P<0.01;各细胞表型组间两两比较均P<0.001
组别CIK组DC+CIK组AP-DC+CIK组F CD3+72.219±4.202 82.114±3.092 96.639±1.490 153.764**CD3+CD8+42.844±2.658 59.430±3.606 74.725±5.279 159.095**CD3+CD56+30.215±1.921 41.487±3.967 66.891±4.133 289.954**

2.3.2 与CIK共培养前后DC表型变化 将AP-DC与DC培养到第8天时采用流式细胞仪检测DC成熟表型,然后将它们与CIK共培养后,再次检测DC成熟表型,结果显示,共培养后的成熟标志明显高于共培养前,差异均有统计学意义(P<0.01),见表2。
表2 与CIK共培养前后DC表型分析 (n=10,%,±s)
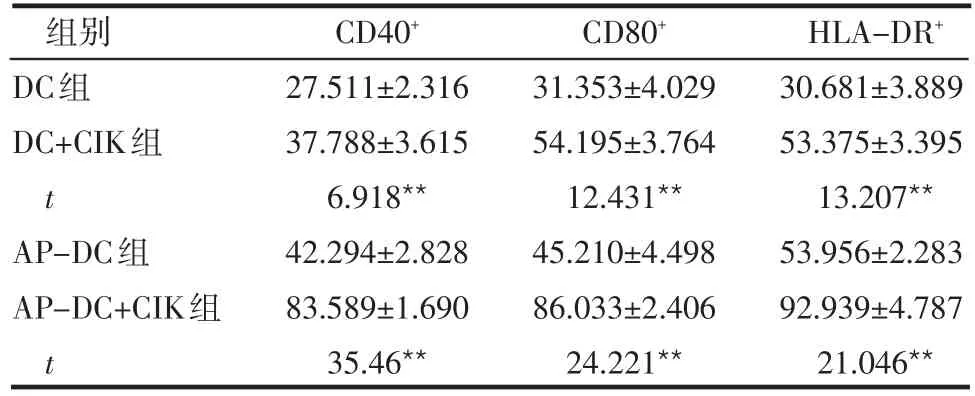
表2 与CIK共培养前后DC表型分析 (n=10,%,±s)
**P<0.01
组别DC组DC+CIK组t AP-DC组AP-DC+CIK组t CD40+27.511±2.316 37.788±3.615 6.918**42.294±2.828 83.589±1.690 35.46**CD80+31.353±4.029 54.195±3.764 12.431**45.210±4.498 86.033±2.406 24.221**HLA-DR+30.681±3.889 53.375±3.395 13.207**53.956±2.283 92.939±4.787 21.046**
2.4 细胞因子分泌水平测定 收集第15天CIK组、DC+CIK组和AP-DC+CIK组上清液,测定IFN-γ、TNF-α、IL-2分泌水平,AP-DC+CIK 组 IFN-γ是DC+CIK组、CIK组的约2倍、7倍,AP-DC+CIK组TNF-α是DC+CIK组、CIK组的约2倍、7倍,AP-DC+CIK组IL-2是DC+CIK组、CIK组的约2倍、3倍。
2.5 荷瘤裸鼠治疗前后肿瘤体积比较 治疗前4组荷瘤裸鼠间肿瘤体积差异无统计学意义,经不同治疗后,4组间肿瘤体积两两比较差异均有统计学意义,见表3。
表3 荷瘤裸鼠治疗前后肿瘤体积及治疗后的瘤质量比较(n=10,±s)
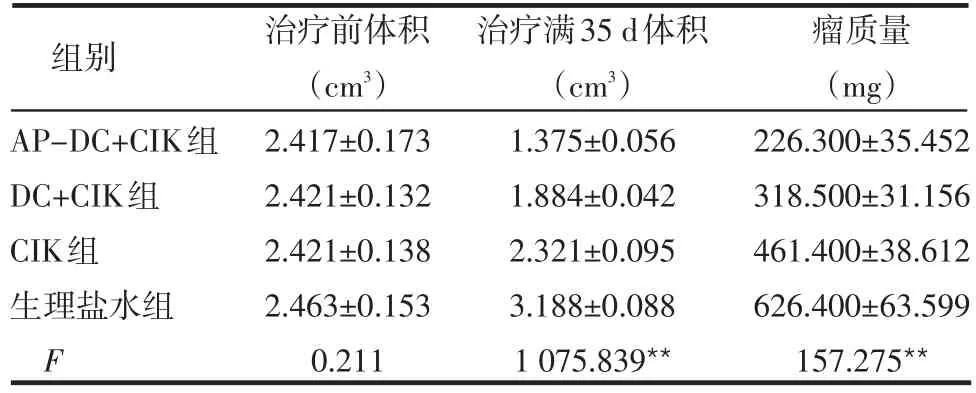
表3 荷瘤裸鼠治疗前后肿瘤体积及治疗后的瘤质量比较(n=10,±s)
**P<0.01;治疗满35 d体积和瘤质量4组间两两比较均P<0.001
组别AP-DC+CIK组DC+CIK组CIK组生理盐水组F治疗前体积(cm3)2.417±0.173 2.421±0.132 2.421±0.138 2.463±0.153 0.211治疗满35 d体积(cm3)1.375±0.056 1.884±0.042 2.321±0.095 3.188±0.088 1 075.839**瘤质量(mg)226.300±35.452 318.500±31.156 461.400±38.612 626.400±63.599 157.275**
2.6 荷瘤裸鼠治疗前后瘤质量和抑瘤率比较 4组荷瘤裸鼠瘤体质量差异有统计学意义,4组之间两两比较差异均有统计学意义(均P<0.001),见表3。AP-DC+CIK组、DC+CIK组、CIK组抑瘤率分别为63.87%、49.15%、26.34%。
3 讨论
乳腺癌目前在治疗上包括手术切除、放疗、化疗以及特异靶向抗体等方法,但疗效均不明显,最终都会出现肿瘤的耐药和复发。对于原发和继发耐药机制已经进行了多项研究,其中在ABC转运蛋白家族研究中发现P-gp是耐药机制重要原因之一[3]。肿瘤的生物免疫治疗已经为解决肿瘤耐药问题带来了希望。
CIK细胞是来源于T淋巴细胞的具有免疫活性的异质细胞群,具有较强的抗肿瘤毒性,可以杀伤对化疗耐药的肿瘤细胞,是治疗多药耐药肿瘤最具潜力的途径。DC细胞作为最具潜力的抗原提呈细胞,可以识别、加工、提呈抗原给T细胞[4],是激发特异性免疫应答的中心和抗肿瘤免疫的重要载体。临床研究中发现部分患者在用免疫效应细胞进行过继免疫治疗时疗效不太理想,认为是肿瘤细胞对这些免疫效应细胞发生了抵抗,可能与肿瘤患者功能性的DC缺乏、T细胞的免疫无能有关。随着CIK细胞在肿瘤过继免疫治疗中的作用越来越突出,DC细胞和CIK细胞相互作用后,CIK细胞可以被激活并杀伤肿瘤抗原分子。故针对多药耐药基因而进行的DC与CIK细胞之间的研究将成为重点。
本研究发现,CIK细胞与DC共育后,CIK细胞的增殖速率较CIK细胞单独培养时进一步增加,为单独CIK组的近20倍,其中以AP-DC+CIK组倍数最高,说明DC能促进CIK细胞增殖,抗原负载后的DC促增殖能力更强。CD3+CD56+细胞和CD3+CD8+细胞是CIK细胞中发挥细胞毒活性的主要细胞群。CD3+CD56+细胞在未培养的外周血淋巴细胞中所占极微(1%~5%),培养后其比例大幅增高,AP-DC+CIK组表达最高,其次是DC+CIK组,CIK组表达最低,提示在CIK与DC共育后,CIK细胞中CD3+CD56+细胞大量扩增,特别是负载抗原的DC能最大程度扩增CD3+CD56+细胞,CD3+CD8+细胞亦如此,在AP-DC+CIK组扩增最明显,提示CIK细胞在DC刺激下成熟度增加,负载抗原的DC能进一步增加CIK细胞的成熟度,杀伤能力亦随之增加,从表型分析提示AP-DC+CIK组的杀伤能力最强。进一步检测CIK细胞分泌IFN-γ、TNF-α和IL-2的能力时发现,AP-DC+CIK组表达高,其次是DC+CIK组,CIK组表达最低,提示DC能激发CIK分泌细胞因子的潜力,而负载抗原的DC可进一步增加细胞因子的分泌。分泌细胞因子亦是CIK细胞杀伤肿瘤细胞的机制之一,其活化后可以增加上述细胞因子的分泌量,提高杀瘤活性[5],故本结果亦能支持与DC共培养后,CIK杀伤肿瘤能力增强,与负载抗原的DC共育后,其杀伤能力进一步增强。同时有研究显示,CIK细胞对DC的成熟也有很大的促进作用并上调相应成熟表型表达[6],从而成熟DC可以进一步增加CIK的成熟度和杀伤能力,起到正向促进作用。
笔者前期研究提示,在对表达P-gp抗原的MCF-7/ADR乳腺癌耐药细胞的细胞毒进行杀伤时,AP-DC+CIK组的杀伤效应最强,其次是DC+CIK组,CIK组的杀伤效应最弱[7]。本研究在体内实验中得到同样结论,AP-DC+CIK组肿瘤抑制率最高,CIK单独治疗组肿瘤抑制率最低,提示CIK对肿瘤细胞有杀伤抑制作用,DC激活CIK细胞后杀伤能力得到增强,而负载肿瘤抗原的DC激活的CIK细胞杀伤能力最强,致使AP-DC+CIK组小鼠肿瘤体积最小,瘤体质量重最轻,抑瘤率最高。其机制可能为CIK细胞将耐药细胞的细胞周期阻滞于S和G2/M期的同时,诱导其凋亡,降低耐药基因的表达,提高耐药细胞的免疫原性,分泌细胞质颗粒,分泌穿孔蛋白(PFP),产生IL-2、TNF-α、INF-γ、粒细胞巨噬细胞集落刺激因子(GM-CSF)等具有抗肿瘤活性的细胞因子发挥抗肿瘤作用[8]。DC与CIK细胞共作用后,CIK细胞的杀伤能力进一步增强,其作用机制可能为:(1)DC高表达主要组织相容性复合体(MHC)-Ⅱ类分子(HLA-DR)和共刺激分子使CIK细胞充分接受第二信号激活,激活的CIK细胞通过免疫球蛋白Fc受体使淋巴细胞功能相关抗原(LFA)-1和细胞间黏附分子(ICAM)-1的结合从低亲和力转为高亲和力,并向细胞间排出含有α-氮-甲苯碳酰基-左旋-赖氨酸硫甲苯酯(BLT)的胞浆毒性颗粒,引发胞浆毒性颗粒依赖性溶细胞作用。(2)DC分泌多种细胞因子,刺激抗原特异性T细胞增殖,促进CIK的活化和分化,间接启动CIK[9]。本研究中,表达P-gp的MCF-7/ADR细胞抗原冲击的DC和CIK共培养后,能显著激活CIK细胞对MCF-7/ADR细胞的杀伤作用,提示CIK细胞除了其非MHC限制性杀伤作用,很有可能存在一定的特异性杀伤效应,其机制可能为CIK细胞中存在能够识别特异抗原的杀伤细胞[10],进而产生特异性杀伤。本实验结果有助于进一步探究对多药耐药肿瘤的获得性免疫治疗。
[1]Banchereau J,Palucka AK.Dendritic cells as therapeutic vaccines against cancer[J].Nat Rev Immunol,2005,5(4):296-306.
[2]Niethammer AG,Wodrich H,Loeffler M,et al.Multidrug resistance-1(MDR-1):a new target for T cell-based immunotherapy[J].FASEB J,2005,19(1):158-159.
[3]De EG,Raaijmakers MH,Boezeman JB,et al.Preferential expression of a high number of ATP binding cassette transporters in both normal and leukemic CD34+CD38-cells[J].Leukemia,2006,20(4):750-754.
[4]Randolph GJ,Jakubzick C,Qu CF.Antigen presentation by monocytes and monocyte-derived cells[J].Curr Opin Immunol,2008,20(1):52-60.
[5]蒋东霞,徐虹,胡杰英,等.人红白血病细胞来源的DC对细胞因子诱导的杀伤细胞逆转多药耐药的影响[J].实用诊断与治疗杂志,2007,21(7):494-496,498,561.
[6]Jin P,Han TH,Ren J,et al.Molecular signatures of maturing dendritic cells:implications for testing the quality of dendritic cell therapies[J].J Transl Med,2010,8:4.
[7]李世俊,张连生,柴晔,等.树突状细胞与细胞因子诱导的杀伤细胞共培养对多药耐药肿瘤细胞系的杀伤活性[J].中华肿瘤杂志,2007,29(10):733-737.
[8]Zhang H,Zhao Q,Zuo LF,et al.The functional mechanism of CIK cells on ovarian carcinoma cell lines SKOV3/CDDP[J].Xi Bao Yu Fen Zi Mian Yi Xue Za Zhi,2007,23(12):1167-1169.
[9]Curti A,Pandolfi S,Aluigi M,et al.Interleukin-12 production by leukemia-derived dendritic cells counteracts the inhibitory effect of leukemic microenvironment on T cells[J].Exp Hematol,2005,33(12):1521-1530.
[10]Franceschetti M,Pievani A,Borleri G,et al.Cytokine-induced killer cells are terminally differentiated activated CD8 cytotoxic TEMRA lymphocytes[J].Exp Hematol,2009,37(5):616-628.e2.
