小鼠核结合因子a1基因启动子报告载体的构建及鉴定*
2011-11-28王宝利王洪武
郑 纺 崔 壮 王宝利 王洪武
核结合因子a1(core binding factor a1,Cbfa1)是成骨特异性转录激活因子,在成骨细胞发育、分化和骨形成过程中起着至关重要的分子开关作用。鉴于Cbfa1在骨形成过程中的关键作用,因此构建Cbfa1基因启动子报告载体,通过观察药物对该启动子转录活性的影响,可以用于促骨形成药物的筛查及评价。
1 材料与方法
1.1 主要材料与试剂 小鼠成骨细胞系MC3T3E1、大肠杆菌菌种DH5α为本室保存。质粒表达载体PGL3-Basic、萤光素酶活性测定试剂盒(Luciferase assay system)、β-半乳糖苷酶活性测定试剂盒(β-galactosidase assay kit)和MluI、XhoI限制性内切酶均为Promega公司产品;质粒小量提取试剂盒和DNA提取试剂盒均购自索莱宝公司;Lipofectamine2000为Invitrogen公司产品;DMEM培养基、胎牛血清(FBS)、胰蛋白酶均购自GIBCO公司;dNTPs、KOD-plus ver2高保真DNA聚合酶为日本TOYOBO公司产品;T4DNA连接酶、DNA Marker为大连TaKaRa公司产品。引物序列及DNA序列分析由上海英骏生物技术公司合成及测序。
1.2 方法
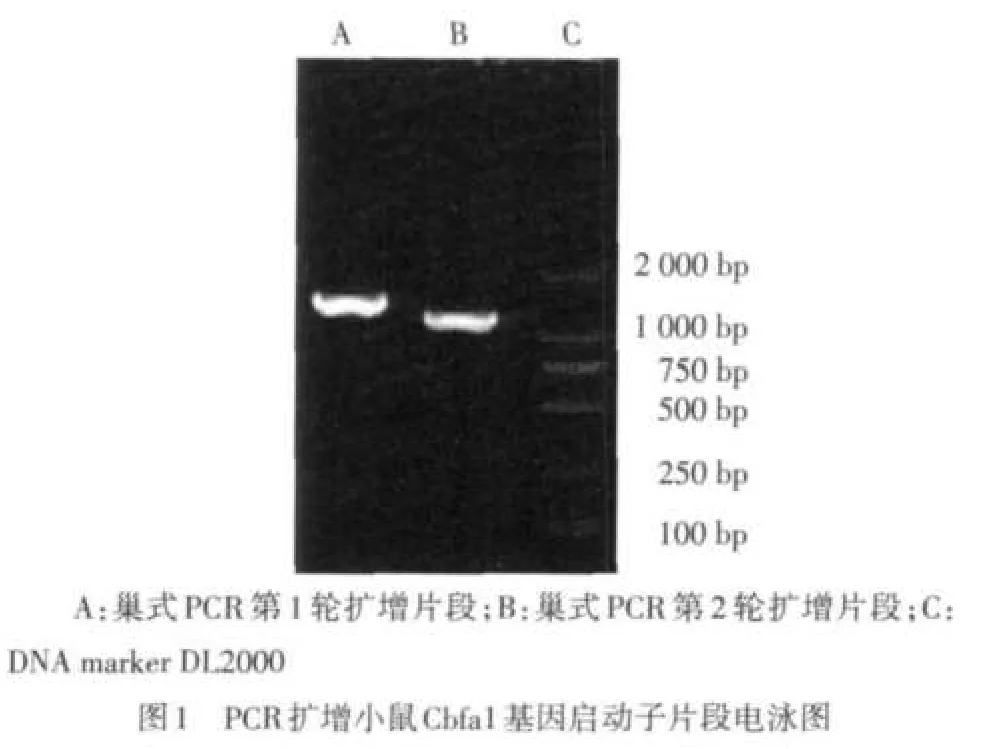
1.2.1 PCR扩增小鼠Cbfa1基因启动子区的DNA序列 取正常Balb/c小鼠尾静脉血5 mL,按照DNA提取试剂盒说明书进行操作,提取基因组DNA。分析小鼠Cbfa1基因的DNA序列,巢式PCR扩增Cbfa1启动子区-1 000 bp~+200 bp区域的片段。巢式PCR第1轮引物为Cbfa1-out-up:5′-TGCAGAAC TGCACCCAAAGTCCT-3 ′;Cbfa1-out-down:5′-GGCTGTTTG ACGCCATAGTCCCT-3′,扩增片段长度约为1 560 bp。接着以第1轮PCR凝胶纯化回收后产物为模板,以Cbfa1-in-XhoI-up:5′-AAAACTCGAGTTAAGATCTTCAAAGTAACCA-3 ′ 和Cbfa1-in-MluI-down:5′-AAAAACGCGTCGGAGTGAGCAAA TATTTGAAGGACCTACTA-3′为引物进行第2轮PCR,扩增Cbfa1启动子-1 000 bp~+200 bp区域并引入XhoI和MluI酶切位点,凝胶纯化回收第2轮PCR产物。两轮PCR反应条件均为:95 ℃预变性5 min,94 ℃ 30 s,60 ℃ 30 s,72 ℃ 45 s,共35个循环;72℃终延伸5 min。
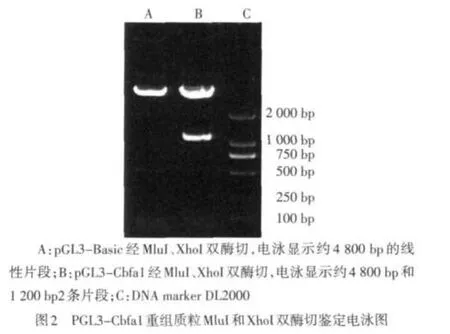
1.2.2 小鼠Cbfa1基因启动子报告载体的构建 XhoI和MluI双酶切PCR扩增并纯化回收的长约1 200 bpCbfa1启动子DNA片段,同时将萤光素酶报告基因载体pGL3-Basic行XhoI和MluI双酶切,回收线性化载体。T4连接酶将两者定向连接。XhoI和MluI双酶切并测序鉴定阳性克隆,正确插入的克隆命名为pGL3-Cbfa1报告基因载体。
1.2.3 MC3T3-E1细胞转染与报告基因分析 使用含10%FBS、100 U/mL青霉素、0.1 g/L链霉素的DMEM培养基将MC3T3-E1细胞培养至对数生长期后,用消化液处理细胞,换用含10%FBS无抗生素的DMEM培养基悬浮细胞,按2×105/孔接种至24孔板并随机分为pGL3-Cbfa1转染组和pGL3-Basic转染组,使用lipofectamineTM2000分别将1 μg的重组质粒pGL3-Cbfa1和对照载体pGL3-Basic瞬时转染至各组MC3T3-E1细胞内,每组设6个复孔,每孔均同时转染0.1 μg β-半乳糖苷酶质粒作为内参照以校正细胞的转染效率。转染48 h后收集细胞,加入冰预冷的细胞裂解液(0.1 mol/L KH2PO4,1 mmol/L二硫苏糖醇,pH=7.8),液氮冻融3次,4 ℃12 000 r/min离心20 min,收集上清。使用Luciferase assay system测定细胞的萤光素酶活性。相对荧光强度单位由β-galactosidase assay kit测定β-半乳糖苷酶活性做标准参照。
1.3 统计学处理 采用SPSS 16.0统计软件进行数据处理。两组细胞同时检测,每组细胞重复检测3次,取平均值作为该组细胞的萤光素酶活性或β半乳糖苷酶活性值。以细胞萤光素酶活性/β-半乳糖苷酶活性比值表示启动子萤光素酶的相对活性。pGL3-Cbfa1报告载体的活性采用独立样本t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 小鼠Cbfa1基因启动子区的扩增 巢式PCR第1轮扩增片段长度约为1 560 bp,巢式PCR第2轮扩增片段长度约为1 220 bp。见图1。
2.2 pGL3-Cbfa1重组萤光素酶报告基因载体的酶切鉴定和DNA序列分析 pGL3-Cbfa1重组萤光素酶报告基因载体经MluI和XhoI双酶切鉴定,得到4 800 bp和1 200 bp两条片段;pGL3-Basic经MluI和XhoI双酶切鉴定得到约4 800 bp的线性片段。经序列测定分析,重组报告载体中插入序列完全正确,载体序列与Cbfa1基因启动子序列正确拼接,见图2。
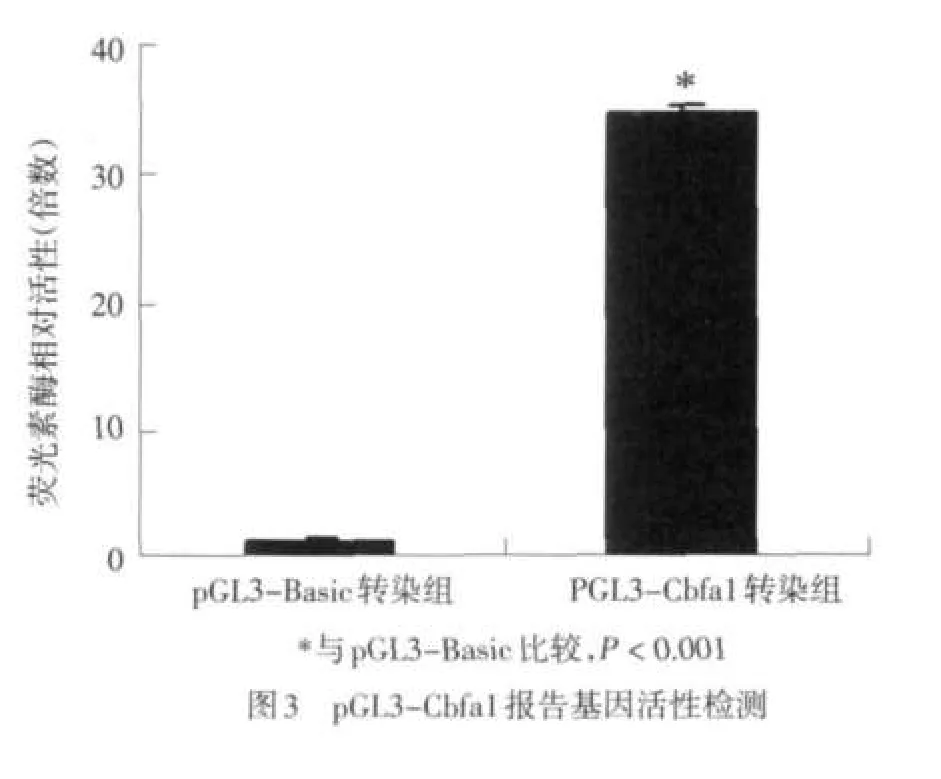
2.3 pGL3-Cbfa1重组萤光素酶报告载体的活性检测 重组报告载体pGL3-Cbfa1萤光素酶活性明显升高(t=19.795,P<0.001),约为pGL3-Basic的35倍,见图3。
3 讨论
骨质疏松的发生主要是由于成骨细胞的作用弱于破骨细胞的作用引起的,因此要想从根本上达到治疗骨质疏松的目的,增强成骨细胞活性、促进骨形成就显得更为重要。然而目前用于临床的药物基本上只能抑制骨丢失,不能促进骨形成,只能在一定程度上延缓疾病的进展,却不能逆转业已出现的骨量减少和骨显微结构的破坏,也就无法治愈骨质疏松。因此要想从根本上治疗骨质疏松,寻找能够增强成骨细胞活性、促进骨形成的药物至关重要。
Cbfa1是对成骨细胞分化、成熟起关键作用的转录因子。研究发现,成骨细胞谱系高表达Cbfa1,该基因能促进成骨细胞表达骨钙素、碱性磷酸酶、骨桥蛋白和Ⅰ型胶原蛋白等下游成骨细胞表征分子,诱导多潜能间充质干细胞向成骨细胞表型分化,促进骨小结形成[1-3]。Cbfa1基因敲除的杂合子小鼠出生时骨组织发育明显受阻,而纯合子小鼠出生时无成骨细胞和骨组织形成[4]。研究还发现,骨形态发生蛋白(bone morphogenetic protein,BMP)等局部因子可上调Cbfa1表达[5-6]。因此,包括BMP在内的许多局部因子与转录因子Cbfa1的相互作用在成骨细胞发育和骨形成过程中起着十分重要的作用。基于Cbfa1在骨形成过程中发挥的关键作用,笔者认为它可以作为分子靶点用于抗骨质疏松药物的筛选。
为此,本研究进行了Cbfa1启动子重组报告基因载体的构建,并检测了该报告载体的转录活性。用于构建报告载体的小鼠Cbfa1基因启动子序列来自基因组DNA的PCR扩增产物,考虑到如果直接扩增这段长约1 200 bp的区域,若恰好在启动子序列的关键元件发生碱基错配,会大大降低所构建载体的可信度。另外,直接将该片段与萤光素酶报告载体进行连接也不容易操作。因此,笔者采取了巢式PCR策略,通过两轮PCR反应,使用两套引物扩增特异性的Cbfa1基因启动子DNA片段。文中第2对引物的功能是特异扩增位于首轮PCR产物内的一段DNA片段,并分别在两条引物中引入能够将Cbfa1启动子定向克隆入萤光素酶报告载体pGL3-Basic的MluI和XhoI酶切位点。DNA序列分析结果证实整段序列全长无错配碱基,且拼接的位置和方向正确。接下来,笔者将Cbfa1基因启动子片段插入不含启动子的pGL3-Basic载体的多克隆位点,获得了重组报告基因载体pGL3-Cbfa1。该载体中Cbfa1启动子序列中含有许多重要的顺式作用元件[7],将它瞬时或稳定转染细胞后,可通过检测萤光素酶的表达水平来了解Cbfa1基因的基础表达和药物对Cbfa1基因启动子转录活性的影响。研究中,经转染小鼠成骨细胞系MC3T3-E1,报告基因分析研究发现pGL3-Cbfa1报告载体与对照载体相比显示出较高的活性,约为pGL3-Basic的35倍,该结果表明所构建的报告载体能够反映Cbfa1启动子的活性。本文中pGL3-Cbfa1报告载体的成功构建为借助于Cbfa1启动子进行抗骨质疏松药物筛选提供了一个非常好的研究工具,也为进一步建立抗骨质疏松药物的效果评价方法奠定了基础。
[1]Jonason JH,Xiao G,Zhang M,et al.Post-translational regulation of runx2 in bone and cartilage[J].J Dent Res,2009,88(8):693-703.
[2]Igarashi M,Kamiya N,Hasegawa M,et al.Inductive effects of dexamethasone on the gene expression of Cbfa1,Osterix and bone matrix proteins during differentiation of cultured primary rat osteoblasts[J].J Mol Histol,2004,35(1):3-10.
[3]Ziros PG,Gil AP,Georgakopoulos T,et al.The bone-specific transcriptional regulator Cbfa1 is a target of mechanical signals in osteoblastic cells[J].J Biol Chem,2002,277(26):23934-23941.
[4]Komori T,Yagi H,Nomura S,et al.Targeted disruption of Cbfa1 results in a complete lack of bone formation owing to maturational arrest of osteoblasts[J].Cell,1997,89(5):755-764.
[5]Jun JH,Yoon WJ,Seo SB,et al.BMP2-activated Erk/MAP kinase stabilizes Runx2 by increasing p300 levels and histone acetyltransferase activity[J].J Biol Chem,2010,285(47):36410-36419.
[6]Chen NX,Duan D,O’Neill KD,et al.High glucose increases the expression of Cbfa1 and BMP-2 and enhances the calcification of vascular smooth muscle cells[J].Nephrol Dial Transplant,2006,21(12):3435-3442.
[7]Xiao ZS,Liu SG,Hinson TK,et al.Characterization of the upstream mouse Cbfa1/Runx2 promoter[J].J Cell Biochem,2001,82(4):647-659.
